老年高血压女性患者心率与骨密度相关性研究
2019-03-27杨静付阿丹张旭艳
杨静 付阿丹 张旭艳
华中科技大学同济医学院附属武汉中心医院内分泌科,湖北 武汉 430000
骨质疏松症是快速增长的老年人群中重要的公共健康问题,它与骨折风险密切相关,会对生活质量产生不利影响,并增加发病率和死亡率[1-2]。骨质疏松症与多种心血管疾病有关,包括高血压。这种关联被认为部分归因于共同的风险因素,如年龄,以及涉及骨骼和心血管系统调节的共同潜在机制[3-4],但产生这种关系的机制在很大程度上仍是未知的。先前的研究已经证明自主神经系统在骨代谢中起着一定的作用。在下丘脑的控制下,交感神经系统通过β2-肾上腺素受体能影响成骨细胞,增加交感神经张力导致更多的骨吸收和更少的骨形成[5]。自主神经系统对维持心血管功能也很重要,尽管自主神经功能障碍在骨质疏松症和心血管疾病患者中的病理作用尚未阐明,关于这一主题的研究也很少。静息心率(heart rate, HR)是一种简单的、临床上可行的指标,可反映基础自主神经系统张力和缺血性心脏病及心力衰竭的风险因素[6]。最近HR已重新被评估为心脏代谢危险因素,高HR[≥80次/min(bpm)]与糖尿病,高血压和代谢综合征有关,尽管传统上HR在80~100 bpm之间被认为是正常的。HR尽管其简单但实用,心血管领域以外的人往往被忽视。骨质疏松症和高血压是影响老年妇女的常见慢性疾病。从公共卫生的角度来看,在老年高血压女性中进行简单的标志物鉴定是非常重要的,将有助于筛查骨质疏松症高风险人群。先前的研究表明[7],高HR(>80 bpm)是老年女性骨质疏松性骨折和冠心病相关死亡率的有力预测指标。尽管这种关联的确切机制尚不清楚,但它反映了自主神经失调,所以认为高HR与骨骼和心血管系统疾病相关。因此,笔者试图证实以前的工作,并进一步评估高HR和低BMD之间的关系,重点关注患有心血管疾病与死亡风险高的高血压患者。本研究将以静息HR为标记,研究老年女性高血压患者的自主神经功能障碍与低BMD之间的关系。
1 材料和方法
1.1 临床资料
选取2014年4月至2018年1月在我院就诊的老年女性高血压患者490例作为研究对象。符合高血压的诊断标准[血压(BP)≥140/90 mmHg]且年龄≥60岁;排除标准:继发性高血压;合并其他严重的心血管疾病(心肌病、新近心肌梗死、心力衰竭、严重心律失常等)以及外周血管疾病患者;肝肾功能不全、哮喘、慢性阻塞性肺疾病、糖尿病、恶性肿瘤、昼夜睡眠颠倒的患者;不能配合参与者。
1.2 方法
在检测血压和心率之前,所有参与者都被要求限制摄入酒精、咖啡及茶,并限制进行极限运动。训练有素的护士在受试者静坐至少5 min后,使用水银血压计测量血压。所有受试者均测量3次BP,用于分析的值取第二次和第三次测量的平均值。测量受试者身高和体重,并计算体质量指数(bone mass index, BMI)。受试者被分为吸烟人群(现在和以往吸烟)和不吸烟人群。酗酒者定义为每日饮酒量超过30 g的人。身体活动被定义为每周进行超过150 min的中等强度有氧运动,每周超过75 min的剧烈有氧运动,或每周进行30 min以上的有氧运动达到5 d或更以上。糖尿病和甲状腺疾病的病史是自我报告的。有关膳食钙摄入量的数据通过24 h回忆获得。禁食过夜至少8 h后收集静脉血样。使用激光流式细胞术(XE-2100D,Sysmex Corp.,Kobe,Japan)测量白细胞(WBC)计数。血清葡萄糖、肌酸酐、总胆固醇、甘油三酯、低密度脂蛋白、高密度脂蛋白和碱性磷酸酶水平使用自动模块化学分析仪(7600,Hitachi,Tokyo,Japan)进行测量。使用放射免疫测定试剂盒(DiaSorin,Stillwater,MN)的γ计数器(1470 Wizard,PerkinElmer,Turku,芬兰)测量血清25-羟基维生素D。血清甲状旁腺素(PTH)使用LIAISON分析仪和N-TACT PTH检测法(DiaSorin,Stillwater,MN)进行测量。休息至少5 min后,在休息时测量静息HR。采用双能X线吸收测量法(Hologic Discovery,Bedford,MA)测量总股骨、股骨颈和腰椎的骨密度(bone mineral density, BMD)。使用制造商提供的作为参考的基于亚洲的数据将BMD值转换成T值。根据世界卫生组织标准,骨质疏松症被定义为T评分为-2.5或更低,骨质减少为T评分在-2.5和-1.0之间,正常为T评分为-1.0或更高。我们通过评估特定部位(股骨、股骨颈、单独腰椎)和总体(任何股骨、股骨颈、腰椎骨质疏松症)来获知是否患有骨质疏松症。
1.3 统计学处理
为了确定静息HR对BMD和骨质疏松症差异的影响,根据静息HR将受试者分成两组,分别为正常(<80 bpm,n=364)和高(> 80 bpm,n=126)。选择这个值是因为HR高于80被发现与各种心脏代谢疾病的风险有关。使用t检验分析连续变量,并将其表示为平均值±标准差。分类变量使用卡方或Fisher精确检验进行分析,并以百分数表示。 BMD曲线也使用协方差分析(ANCOVA)进行比较,调整基线协变量。根据静息HR[(≤63,64~71,72~79,≥80)bpm]将参与者分为四分位数,使用ANCOVA和Bonferroni事后比较分析BMD组别差异。为了定义与HR有关的因素,使用Pearson相关系数(r)评估静息HR与可能的辅助因素(人口统计学、炎症、代谢标记)之间的相关性。最后,多因素Logistic回归分析用于评估混杂因素调整后高HR与骨质疏松症之间的关系。笔者试图全面调整可能影响BMD的混杂因素,如年龄、BMI、糖尿病或甲状腺疾病的存在,PTH异常和血清25-羟维生素D水平,体力活动、吸烟、重度酒精使用,WBC计数和禁食葡萄糖及甘油三酯水平。由于笔者的研究是作为病例对照设计的,因此主要以95%置信区间(CI)的优势比(OR)形式提供数据。ORs也使用已建立的方法转换为相对风险。统计分析采用SPSS 21.0版进行,P<0.05被认为差异具有统计学意义。
2 结果
2.1 一般临床资料
研究人群的基线特征如表1所示,HR较高的女性其年龄、糖尿病发病率、WBC、空腹血糖和甘油三酯水平均较高。其他变量包括血压、体质量指数、膳食钙摄入量和其他实验室检查结果,两组之间无统计学意义(P<0.05)。
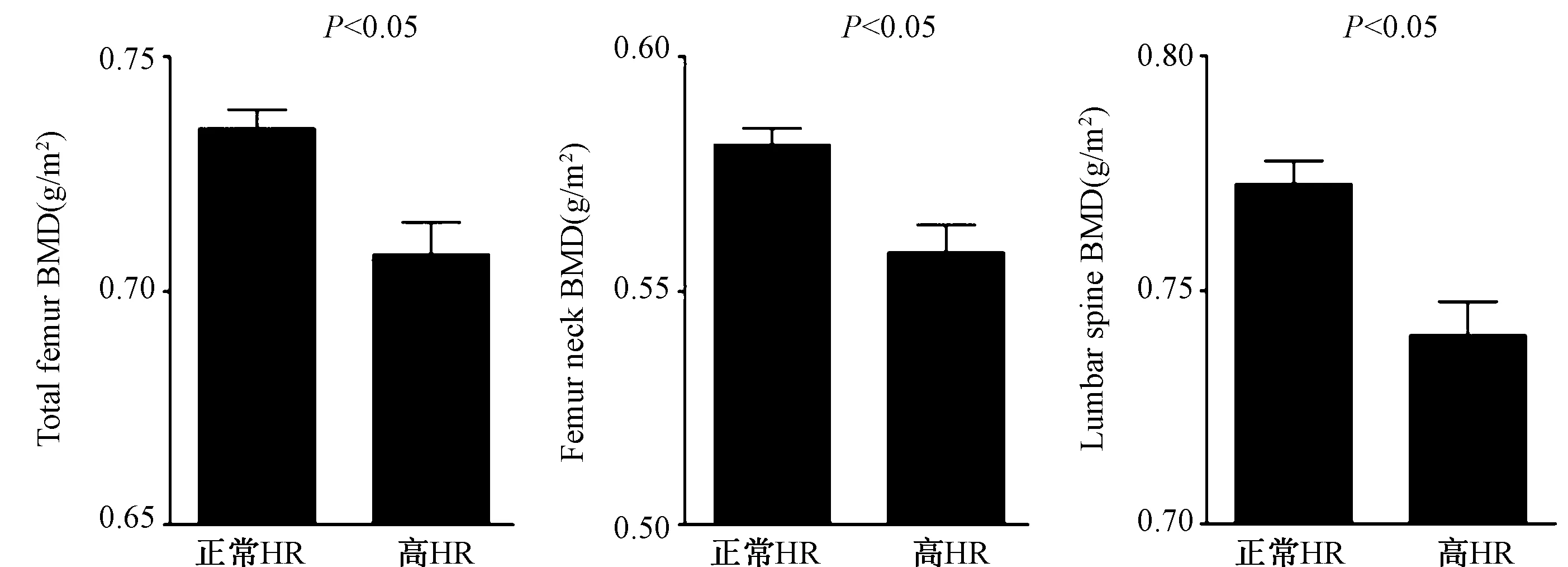
图1 高心率(HR)患者的骨密度(BMD)值的差异注:高心率组(≥80次/分)与正常心率(<80次/分)相比,所有部位(包括总体、股骨颈和腰椎)的BMD显著降低。Fig.1 Differences in bone mineral density (BMD) values according to heart rate (HR)
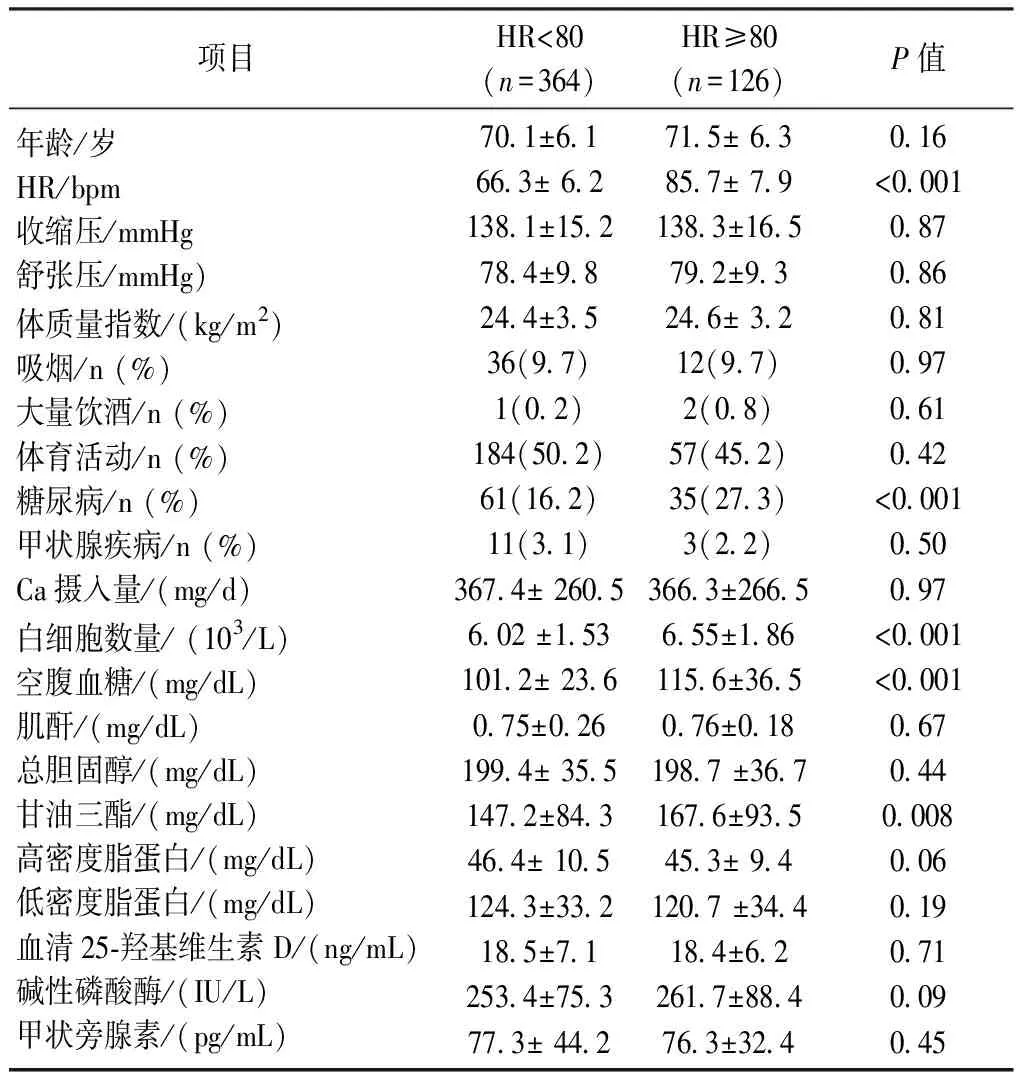
表1 根据高心率研究人群的基线特征(n=490)
2.2 HR和骨密度的相关性
高HR患者的总股骨、股骨颈和腰椎T值明显较低。调整年龄、糖尿病因素、白细胞计数、空腹血糖水平和甘油三酯水平后,这些差异仍然存在(见图1)。同样,在高血压患者中也观察到高HR组的BMD明显偏低。当受试者根据HR进一步分为四分位数时,各组间观察到不同的BMD趋势(P<0.05)。具体来说,即使调整了年龄、收缩压、糖尿病因素、甲状腺疾病以及WBC和空腹血糖,最高四分位数(≥80 bpm)受试者的BMD明显低于第三、四分位数受试者(72~79 bpm)的BMD水平。由于在80 bpm的HR阈值时BMD明显较低,随后的分析将受试者分成两组进行。高HR组患者骨质疏松症的患病率更高(总体60.2%vs 46.4%;股骨颈40.2% vs 31.3%;腰椎46.2% vs 34.6%;均P<0.05),如图2所示。各组之间的骨质疏松症、骨量减少和正常骨密度的患病率有显著差异,见表2。
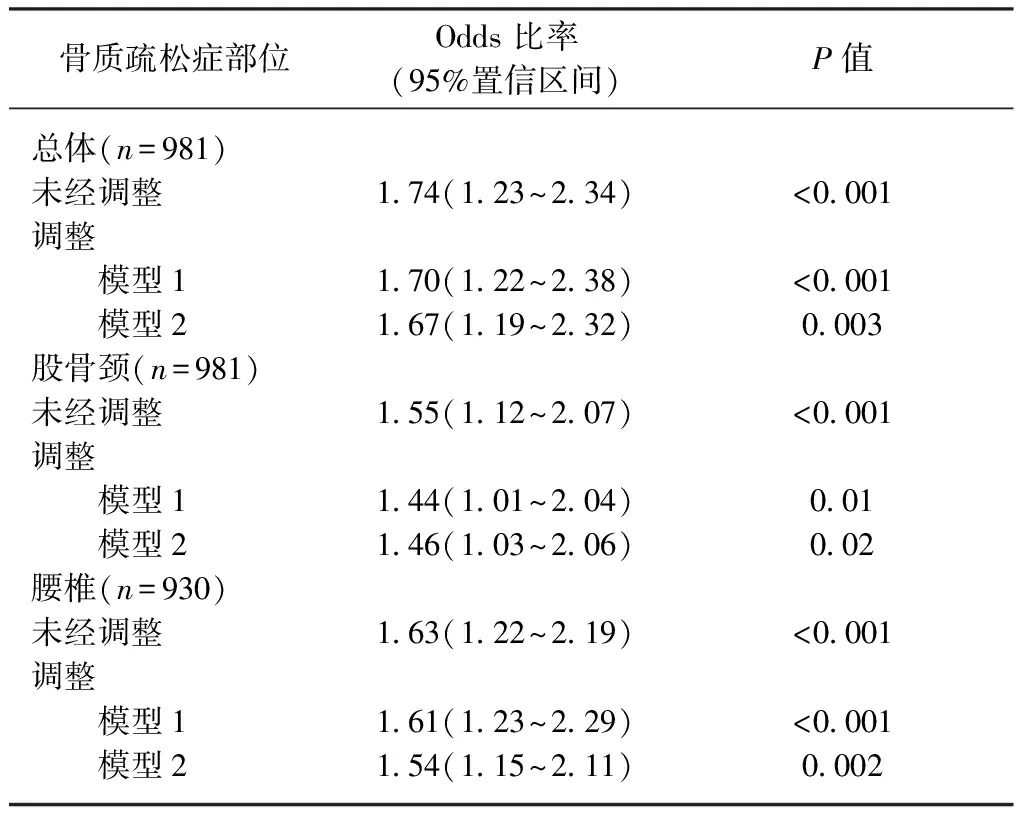
表2 高心率组骨质疏松症的风险(每分钟≥80次)
2.3 HR和炎症及代谢指标的相关性
HR与年龄(r=0.081,P<0.05)、WBC计数(r=0.163,P<0.05)、空腹血糖(r=0.171,P<0.05)和甘油三酯(r=0.064,P<0.05)呈正相关。
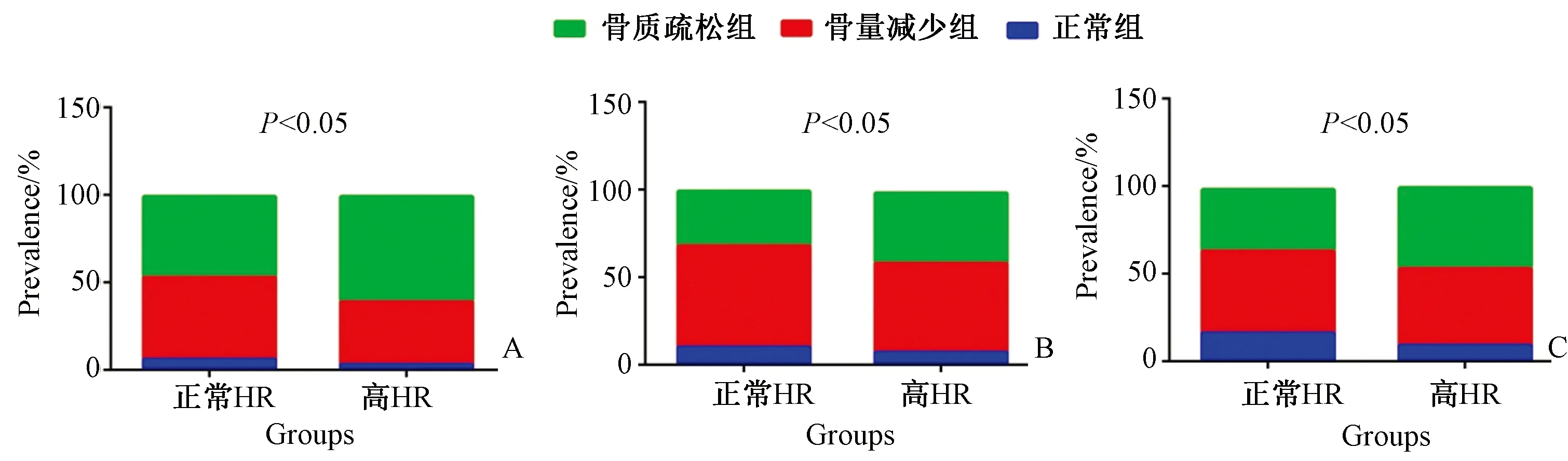
图2 HR患者不同的骨质疏松症的患病率。Fig.2 Differences in prevalence of osteoporosis according to heart rate (HR).注:A总体、B股骨颈、C腰椎骨质疏松症的患病率。 绿色代表骨质疏松症,红色代表骨质减少,蓝色代表骨密度正常。
2.4 高HR组患有骨质疏松症的风险
在调整年龄、BMI、糖尿病因素、甲状腺疾病、吸烟史、大量饮酒和体力活动、白细胞计数、空腹血糖、甘油三酯、血清25-羟基维生素D、碱性磷酸酶和甲状旁腺素后,高HR组总体骨质疏松症的风险高于正常HR组(校正OR=1.67,95%CI=1.19-2.32);高HR组的骨质疏松症风险与股骨颈和腰椎骨质疏松症相似(见表2)。
3 讨论
本研究调查了老年女性高血压患者HR与低BMD之间的关系,发现高HR的患者BMD较低,骨质疏松症患病率较高。无论年龄、体质量指数以及其他潜在的骨质疏松症危险因素,高HR组的骨质疏松症风险均高于正常HR组。本研究结果证实,高HR是骨质疏松症的重要风险指标,并提示老年女性高血压患者骨质疏松症病理生理学中植物神经功能紊乱可能发挥作用导致高HR,达到80 bpm或更高,与总体和个体部位骨质疏松症独立相关。
静息心率是代表基础自主神经张力的重要生命体征,无需特殊设备即可轻松测量,但在临床环境中常常被忽视,除非其极低或极高。最近,多项研究[8-9]提出,高HR(75~85 bpm),高于这些范围的HR与心血管和代谢疾病的风险相关。通过强调HR作为风险指标的作用,本研究观察结果与这些研究一致。我们还发现高HR的病理作用适用于骨质疏松症。为了尽量减少混淆的影响,此项研究包括了绝经后的老年妇女,并排除了服用雌激素替代治疗或慢性肾脏疾病的患者。还调整了可能与骨质疏松症有关的混杂因素。在控制这些协变量后,高HR患者总体骨质疏松症的可能性增加66%。另一项研究还发现HR高于80 bpm的老年女性患骨质疏松性骨折的风险更高,随着HR增加,骨折风险呈线性增加[7],骨质疏松症的发生率在HR为80 bpm时或更高。
尽管高血压患者的高HR和骨质疏松症之间存在密切关联,但其潜在机制尚不清楚。一个合理的解释是自主神经功能障碍在骨质疏松症和高血压的发病机制中起着举足轻重的作用。已知雌激素对神经系统以及血管和生殖系统具有多效性作用。自主神经失调也可能影响骨骼系统,增加骨吸收和减少骨形成,此外还会对心血管系统产生不利影响,导致高血压。笔者的研究还表明HR与炎症指标(高WBC)和生化代谢紊乱(高葡萄糖和甘油三酯水平)之间的关系。对于高HR和骨质疏松症之间的关联,另一种解释是高HR可能代表衰老过程。越来越多的证据[10-11]表明衰老可能会影响骨骼健康和自主神经功能。高血压和骨质疏松症是众所周知的与年龄有关的疾病[12]。尽管如此,高HR和骨质疏松症之间的关联在控制了受试者的年龄后仍然存在,说明骨质疏松症与高血压患者发病机制中植物神经功能紊乱是独立的角色。同样,高HR提示身体素质较差,这在一定程度上可能涉及骨质疏松症和高血压[13-14],尽管此项研究也调整了体力活动的效果。
本研究结果具有积极的临床意义,对于患有高血压的老年女性,除了通过评估BMD来预测骨折风险,HR也可能是一种有用的指标,适用于早期骨质疏松症筛查。尽管人口老龄化导致骨质疏松性骨折发病率增加,但许多国家的早期筛查并不普遍,因为许多人在发生致残性骨折之前毫无症状。HR可以通过触摸脉搏来测量,因此非常经济。以前用β-受体阻滞剂预防骨质疏松症的研究产生了矛盾的数据[15-16]。低剂量普萘洛尔预防骨丢失,但没有明显的血流动力学损害,而中、高剂量普萘洛尔对去卵巢大鼠模型的骨量没有明显的保护作用,并且与低BP和心输出量有关。最近,伊伐布雷定已被证明在不降低血压的情况下降低HR。目前仍未确定伊伐布雷定是否能改善骨骼健康,减少骨质疏松性骨折的发生率,同时减少血流动力学改变。
当然本研究也有其不足之处,首先无法确定高HR与骨质疏松症之间的因果关系或时间关系;其次,缺乏受试者服用高血压药物的信息;第三,仅根据BMD定义了骨质疏松症而未考虑骨质疏松性骨折;第四,缺乏受试者是否接受抗骨质疏松药物治疗的信息;第五,受试者完全是中国汉族人,所以研究结果不能推广到其他种族。总的来说,在高龄女性高血压患者中,高HR与骨质疏松症独立相关。
