倾向评分匹配法探讨预后营养指数与胃癌新辅助化疗后病理完全缓解的相关性
2019-03-27郅重阳彭良群张占东李宁刘洪兴花亚伟
郅重阳,彭良群,张占东,李宁,刘洪兴,花亚伟
(郑州大学附属肿瘤医院普通外科,郑州 450008)
预后营养指数 (prognostic nutritional index,PNI)由血清清蛋白和5倍外周血淋巴细胞计数之和得到,主要用于评价胃肠术前患者营养状况及免疫功能,后逐步作为预测术后并发症及生存时间的术前指标[1]。胃癌是我国发病率及死亡率均较高的恶性肿瘤,新辅助化疗 (neoadjuvant chemotherapy,NAC)联合根治术已成为主要的治疗模式,而 NAC后获得病理完全缓解 (pathologic complete response,pCR) 者3年生存率在95%以上,目前临床缺乏影响pCR率的相关参数。本研究旨在讨论PNI与胃癌NAC后获得pCR的相关性,提供一个有效且易获取的参数来评价NAC患者获得pCR的可能性。
1 材料与方法
1.1 入组标准
经电子胃镜检查确诊为胃癌;术前CT、MRI及其他相关检查 (穿刺活检、PET-CT等) 排除远处转移;未接受过其他放化疗;术前2周未接受肠外营养支持;术前1周行血常规及肝功检查,计算出PNI;未合并其他慢性消耗性疾病如其他恶性肿瘤、感染、出血、穿孔、胸腹水。
1.2 资料收集
回顾性分析2012年1月至2017年3月在郑州大学附属肿瘤医院行NAC且接受胃癌根治术的患者278例,其中男性207例,女性71例,中位年龄为59(52~66) 岁。
1.3 倾向评分匹配法 (propensity score matching,PSM) 过程
本研究是回顾性分析,资料未严格随机化,且临床影响PNI的变量较多,可导致各种混杂因素分布于不同PNI患者之间。PNI以45分为界值,分为PNI正常组及低PNI组[2]。采用PSM法对2组患者1∶1匹配,匹配成功者之间只存在PNI差异,其他协变量的差异无统计学意义。
1.4 化疗方案及手术
SOX方案:第1天至第14天口服替吉奥胶囊80 mg/m2,2次/d;第1天静脉滴注奥沙利铂130 mg/m2,每3周为1个周期。XELOX方案:第1天至第14天口服卡培他滨1 000 mg/m2,2次/d;第1天静脉滴注奥沙利铂130 mg/m2,每3周为1个周期。根据患者化疗不良反应调整剂量。距末次化疗3~5周后,按照日本胃癌协会《胃癌治疗指南》 (第3版) 规定行手术治疗[3]。
1.5 疗效评估及pCR定义
NAC每2~3个周期进行疗效评价,临床评效依据RECIST 1.1标准,分为完全缓解 (complete remission,CR) 、部分缓解 (partial remission,PR) 、疾病稳定 (stable disease,SD) 、疾病进展 (progressive disease,PD)[4]。术前临床分期及疗效评价均依据CT扫描。肿瘤分期方法采用第7版美国癌症联合委员会TNM分期。pCR定义为原发灶未见明确癌残留[5]。
1.6 统计学分析
采用SPSS 22.0统计学软件进行分析,计数资料的比较采用χ2检验,多因素分析采用二元logistic回归。消除数据中混杂因素,采用PSM,匹配精度设置为0.1。P < 0.05为差异有统计学意义。
2 结果
2.1 PSM前后2组患者基本临床资料的比较
匹配前,2组患者在年龄 (χ2=8.144,P = 0.004) 、分化程度 (χ2=10.160,P = 0.006) 、T分期 (χ2=5.096,P = 0.024) 、肿瘤部位 (χ2=7.544,P = 0.023) 分布不均衡,差异有统计学意义。利用PSM对低PNI组和PNI正常组匹配,共得到220例患者,以上差异经匹配后分布均衡 (均P > 0.05) 。见表1。
2.2 匹配前后影响NAC后pCR率的因素
匹配前,单因素分析提示分化程度 (χ2=9.018,P = 0.003) 、T分期 (χ2=6.811,P = 0.009) 、化疗周期(χ2=4.331,P = 0.037) 、PNI (χ2=7.305,P = 0.007) 、肿瘤部位 (χ2=6.856,P = 0.032) 是影响pCR率的危险因素。多因素分析提示,PNI (OR:3.026;95%CI :1.261,7.260;P = 0.013) 、分化程度 (OR:0.470;95%CI:0.270,0.819;P = 0.008) ,肿瘤部位 (OR:0.341;95%CI:0.164,0.708;P = 0.004) 是影响pCR率的独立危险因素。见表2。
匹配后,单因素分析提示分化程度 (χ2=3.237,P = 0.027) 、PNI (χ2=5.242,P = 0.022) 是影响pCR率的危险因素。多因素分析提示,PNI (OR:2.728;95%CI:1.130,6.587,P = 0.026) 是影响pCR率的独立危险因素。见表3。
3 讨论
NAC联合根治性手术成为进展期胃癌的主要治疗模式。全身化疗可杀灭经血道转移的微转移灶,减轻肿瘤负荷,减少肿瘤复发及微转移的概率,甚至达到pCR。pCR患者3年总生存率达95%,无复发生存率达90%[6]。SOX方案及XELOX方案的疾病控制率均在90%以上,pCR率约为4%,临床获得pCR的病例数较少。以往文献[7-8]报道,pCR率在0~26%。本研究中pCR率 (10.79%) 较既往报道同方案高,分析原因:(1) 对于术前一般情况较差者 (感染、出血、胸腹水、其他恶性肿瘤) 、远处转移者予以排除,减少了肿瘤负荷、转移及微转移的机会; (2) pCR患者较少,病例选择可能存在倾向及偏倚,且放宽了排除指证。文献[9]报道肿瘤分化程度是影响辅助化疗预后的危险因素,可能与肿瘤对药物敏感程度或者侵袭性有关。本研究中匹配前后单因素分析结果显示肿瘤分化程度与pCR率有关,匹配后数据纳入多因素分析,未得出阳性结果,可能为匹配后pCR样本量小以及本身研究的局限性,而不能单纯认为分化程度与pCR率无关,未来还需多样本临床研究来证实。
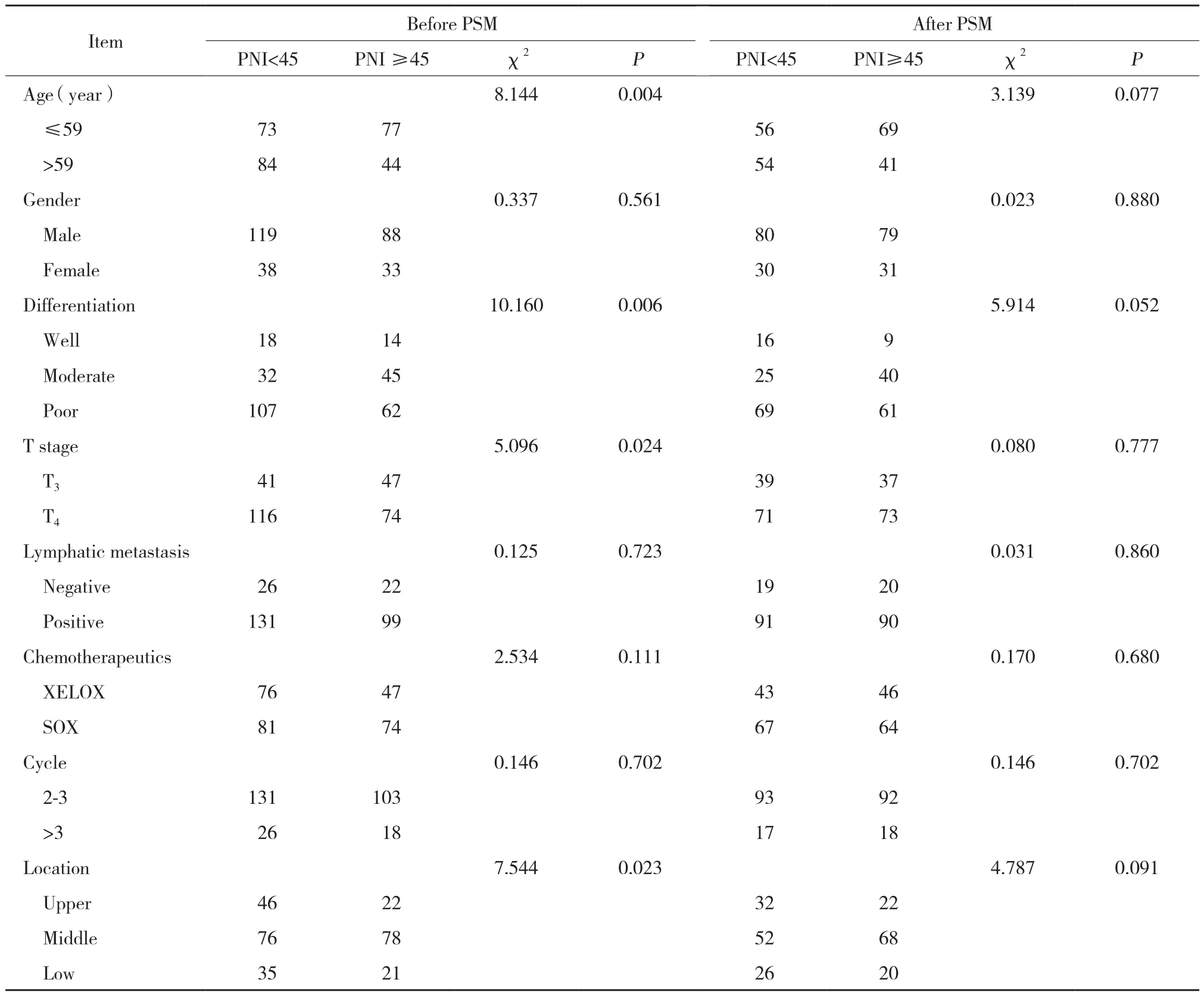
表1 匹配前后2组患者基本临床资料的比较Tab.1 The baseline characteristics of patients between two groups before and after matched
文献[10-11]报道低PNI的胃癌NAC患者生存时间短,术后并发症高,是导致死亡的独立危险因素,但未分析具体原因。本研究中,匹配前后多因素分析均得出PNI是影响胃癌NAC后pCR率的独立危险因素,可能原因:(1) 低PNI可导致化疗药物运输障碍,组织水肿可导致化疗药物分布异常,本研究应用口服药物 (替吉奥及卡培他宾) ,以氟尿嘧啶前体物质摄入人体,在药物酶作用下转化为氟尿嘧啶,低PNI导致细胞代谢功能差,前体物质转化障碍,从而减弱化疗药物作用; (2) PNI反映机体免疫功能,可能与术后全身炎症反应及肿瘤细胞免疫逃逸有关,而肿瘤细胞的生长也许更依赖于炎症微环境[12-13]; (3)PNI可反映机体营养状况,对NAC出现的不良反应(骨髓抑制、化疗相关性呕吐等) 耐受性较高,增加依从性。化疗的有效性可能是PNI影响患者预后的一个重要因素,未来需要更多临床试验来分析PNI和预后的关系。
PNI由白蛋白及外周血淋巴细胞计数得到,完全可用来反映机体营养状况、免疫功能。CRUMLE等[14]认为白蛋白可维持血浆胶体渗透压、减轻机体的炎症反应、维持血管内皮完整性以及保护各个脏器,能较为全面反映机体的营养状况。KANG等[15]认为胃癌术后低蛋白造成吻合口水肿,出现吻合口漏、腹腔积液及感染等并发症增加,导致免疫力下降,机体识别及杀死肿瘤细胞功能低下,进而造成转移或复发。有文献[16]报道术前或化疗前给予营养支持 (肠内或肠外) ,可减少术后并发症或化疗导致的不良反应发生率,生存时间较对照组长。
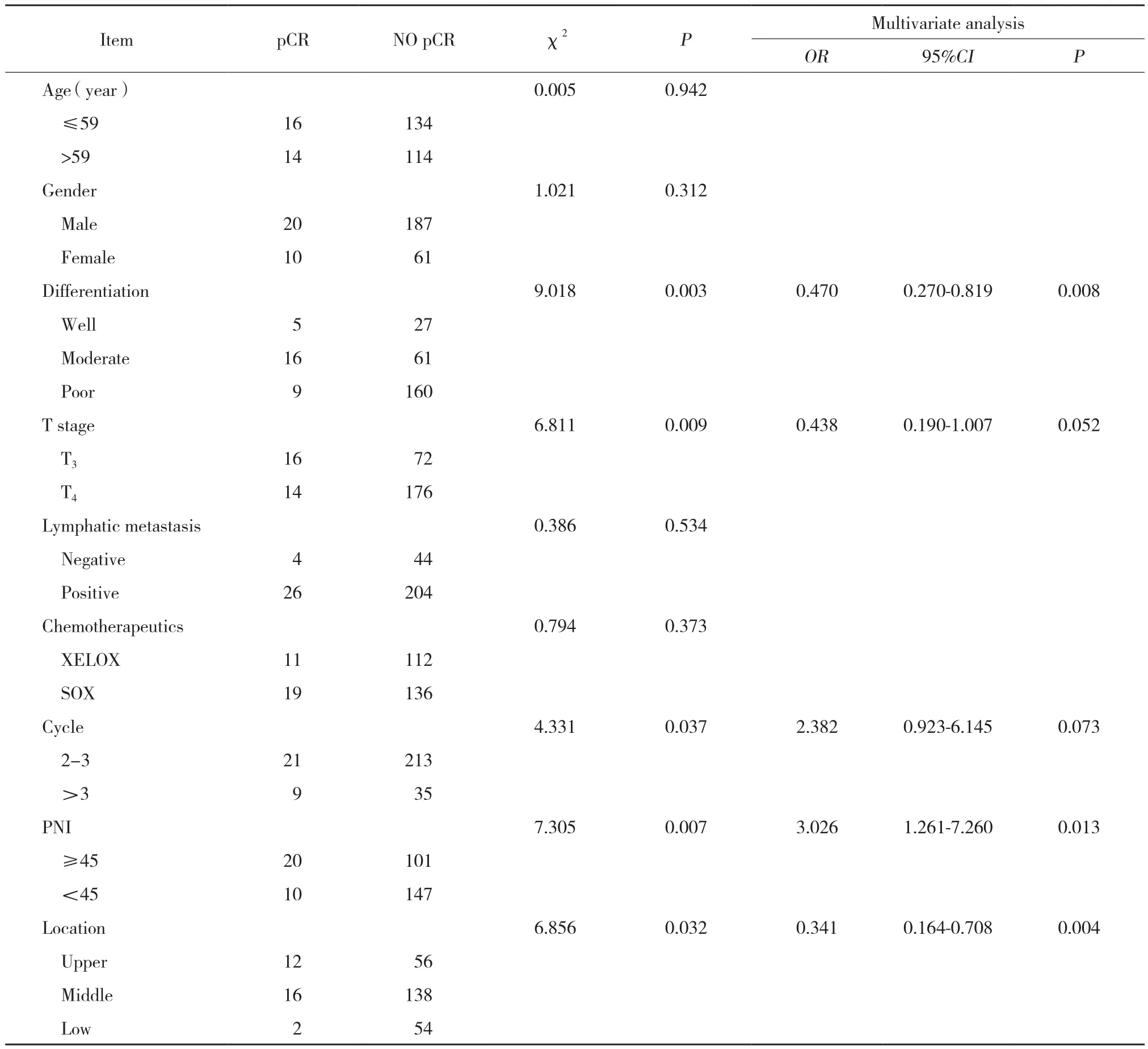
表2 匹配前影响pCR率的危险因素Tab.2 The risk factor associated the pCR rate before matched
本研究是回顾性分析,利用PSM可能达到前瞻性研究数据的准确性,但对于低PNI组患者并未采取干预措施 (肠内或肠外营养、免疫制剂等)。提高PNI能否提高pCR率,未来还需更多循证医学证据支持;若出现感染、出血、穿孔、胸腹水、远处转移等,不应采用PNI来判断患者营养状况及化疗效果。
综上所述,大多胃癌患者存在营养不良及免疫力低下,低PNI是影响NAC后获得pCR的独立危险因素。因此,术前或者化疗前应计算PNI,对于低PNI者可给予适当干预 (肠内或肠外营养、免疫制剂) 提高PNI,从而提高pCR率。

表3 匹配后影响pCR率的危险因素Tab.3 The risk factor associated the pCR rate after matched
