CNOT7基因敲减通过减少HepG2细胞TGF-β 1分泌影响免疫微环境
2019-03-27郭舜赵海潮任晓静任崇仁贺杰峰赵浩亮
郭舜,赵海潮,任晓静,任崇仁,贺杰峰,赵浩亮
(山西医科大学 1. 研究生院;2. 附属大医院普通外科,太原 030001)
肝细胞癌 (hepatocellular carcinoma,HCC) 是人类常见的恶性肿瘤之一。我国是 HCC 高发国家,HCC占全球病例总数和死亡人数的50%左右[1]。目前HCC的治疗模式已从单一学科治疗发展为多学科综合治疗,其中HCC的免疫治疗已成为国内外研究的热点[2-3]。CCR4-NOT转录复合体亚基7 (CCR4-NOT transcription complex subunit 7,CNOT7) 是真核生物CCR4-NOT蛋白复合体的重要亚基之一[4],参与调控多种肿瘤微环境相关蛋白的转录[5]。本课题组前期通过蛋白组学筛查,发现其在肝癌组织中显著高表达[6]。作为免疫特惠器官,肝脏具有独特的免疫系统,并参与机体局部及整体水平的免疫调节。HCC免疫微环境中富含调节性 T 细胞 (regulatory T cell,Treg) 、未成熟树突状细胞等免疫抑制细胞及转化生长因子-β 1 (transforming growth factor-β 1,TGF-β 1) 、白细胞介素-10 (interleukin-10,IL-10 ) 等免疫抑制因子。这种免疫抑制的微环境也成为 HCC 容易形成免疫逃逸的重要原因之一[7]。其中,TGF-β 1作为一种多效性细胞因子,是目前发现的肿瘤诱导产生的免疫抑制因子之一,在HCC 的免疫调节中发挥重要功能[8-9]。HCC患者体内 TGF-β 1水平越高,其预后越差,并与预后不良密切相关[8-9]。自然杀伤 (natural killer,NK) 细胞是固有免疫应答的参与者,有调查结果显示肝癌患者组织中NK细胞的数量与患者生存期长短密切相关,但是在临床研究中,将体外扩增的NK细胞进行回输,治疗效果并不理想,这可能与肝癌免疫微环境有关[10]。本研究旨在探讨CNOT7基因敲减对HepG2细胞分泌TGF-β 1的影响及其在HCC免疫微环境中的作用,为HCC的免疫治疗提供一些新的思路。
1 材料与方法
1.1 主要材料及试剂
HepG2细胞和NK细胞,购自中科院细胞库;Lipofectamine 3000、opti-MEM培养基、人TGF-β 1 ELISA试剂盒,购自武汉博士德公司;阴性对照质粒、CNOT7敲减质粒和CNOT7过表达质粒均购自上海吉凯基因生物化学技术有限公司。
1.2 HepG2细胞的培养与转染
HepG2细胞培养于添加10%胎牛血清和青链霉素双抗的DMEM培养基,于5% CO2和37 ℃的恒温密闭细胞培养箱中培养。规律传代3~4 d至细胞对数生长期,按1×106/孔接种于6孔板上,孵育12~15 h后,使用Lipofectamine 3000进行转染。根据Lipofectamine 3000说明书将实验分为3组:阴性对照组、靶向敲减CNOT7组和过表达CNOT7组,各组设有复孔。转染后放入37 ℃、5% CO2孵箱中培养6 h后,分别更换为含10%胎牛血清的培养基。转染后48 h,收集细胞进行转染分析,倒置荧光显微镜下观察细胞转染效率。采用Western blotting检测3组细胞CNOT7蛋白、TGF-β 1蛋白和核转录因子-κ B (nuclear factor kappa B,NF-κ B) p65蛋白的表达。采用ELISA法测定细胞培养上清液中TGF-β 1水平。
1.3 Western blotting
收集转染48 h后的各组细胞,用0.25%的胰蛋白酶将细胞消化并离心收集后用预冷PBS洗涤2次,溶解在含有PMSF和蛋白酶抑制剂的RIPA缓冲液中。BCA法测定蛋白浓度。每组取等量蛋白10 μ g与上样缓冲液混合后,常规行SDS-PAGE凝胶电泳,取目的条带转膜处理,用5% 牛血清白蛋白封闭后,分别加入1∶500稀释的CNOT 7一抗、1∶1 000稀释的TGF-β 1一抗、1∶400稀释的NF-κ B p65一抗以及1∶1 000稀释的β-actin一抗4 ℃孵育过夜。次日加入1∶2 000稀释的二抗,室温孵育1 h,TBS洗膜后用ECL检测试剂盒进行信号检测。以β-actin蛋白作为内参照,用ImageJ软件测量蛋白条带光密度值,最终结果表示为目的条带与内参β-actin的比值。
1.4 ELISA实验
取各组细胞培养上清液,按照试剂盒说明,检测上清液中 TGF-β 1表达水平。
1.5 细胞凋亡实验
将转染后3组细胞按1×106/孔接种于6孔板上,孵育过夜。NK细胞采用CD3+包被刺激24 h活化。活化的NK细胞分别与3组细胞共培养。CSFE标记肿瘤细胞,7-AAD标记发生凋亡的肿瘤细胞。6 h后,流式细胞术检测肿瘤细胞对NK细胞杀伤功能的敏感性。
1.6 统计学分析
2 结果
2.1 HepG2细胞转染效率分析
对HepG2细胞进行转染,通过倒置荧光显微镜观察细胞转染效率 (图1) ,各组细胞均发出明亮绿色荧光。采用Western blotting分析转染效率 (图2) 。与阴性对照组相比,靶向敲减CNOT7组CNOT7蛋白表达水平降低 (t = 7.975,P < 0.05) ,过表达CNOT7组CNOT7蛋白表达水平升高 (t = 8.017,P < 0.05) ,差异均有统计学意义。
2.2 HepG2细胞中CNOT7对TGF-β 1和NF-κ B p65蛋白
图1 倒置荧光显微镜下细胞荧光图像 ×200Fig.1 Fluorescence microscopy images of cells ×200
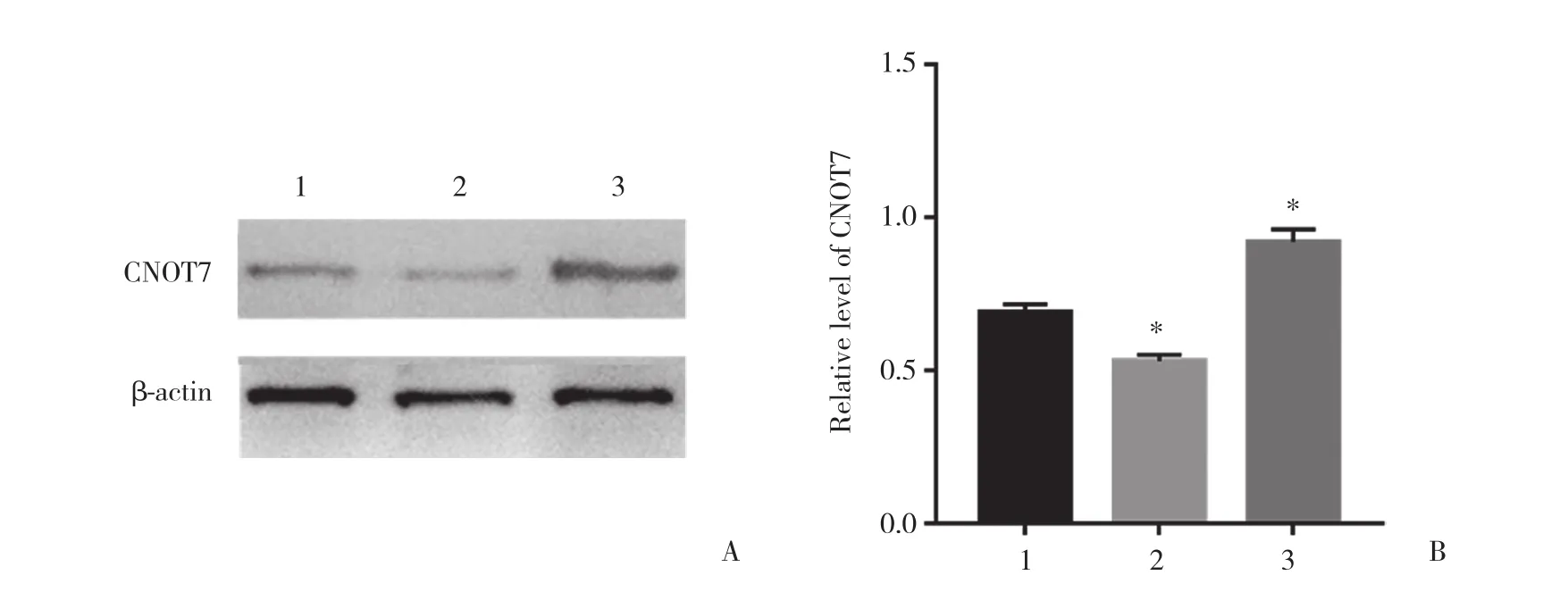
图2 细胞转染后HepG2细胞中CNOT7蛋白的表达Fig.2 Expression of CNOT7 in HepG2 cells after transfection
表达水平的影响
通过Western blotting分析细胞转染后HepG2细胞中TGF-β 1和NF-κ B p65蛋白表达变化 (图3) 。结果显示,与阴性对照组相比,靶向敲减CNOT7组TGF-β 1 (t = 7.374,P < 0.05) 和NF-κ B p65蛋白 (t =4.436,P < 0.05) 表达水平显著降低,过表达CNOT7组TGF-β 1 (t = 18.56,P < 0.05) 和NF-κ B p65蛋白 (t =4.729,P < 0.05) 表达水平显著升高,差异均有统计学意义。
2.3 CNOT7对培养上清液中 TGF-β 1水平的影响
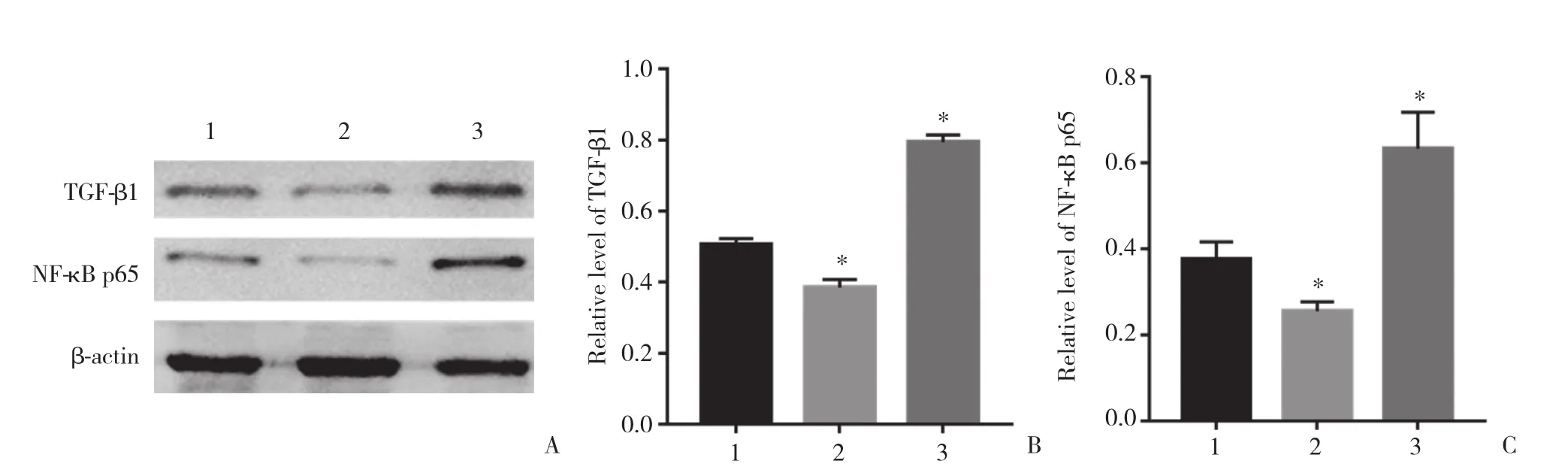
图3 细胞转染后HepG2细胞中TGFβ- 1和NFκ- B p65蛋白的表达Fig.3 Expression of TGF-β 1 and NFκ- B p65 in HepG2 cells after transfection
ELISA结果显示,与阴性对照组相比,靶向敲减CNOT7组细胞培养上清液中TGF-β 1水平显著降低(t = 15.136,P < 0.05) ,过表达CNOT7组TGF-β 1水平显著升高 (t = 10.514,P < 0.05) ,差异均有统计学意义。见图4。
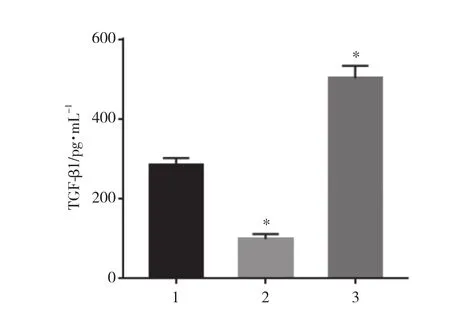
图4 培养上清液TGF-β 1浓度Fig.4 TGFβ- 1 concentration in culture supernatant
2.4 NK细胞对HepG2细胞杀伤能力的变化
流式细胞仪检测NK细胞对转染后2组细胞的杀伤能力。由图5可见,NK细胞与转染后的HepG2细胞共培养后,靶向敲减CNOT7组凋亡细胞比例为29.7%,较阴性对照组14.5%显著升高,过表达CNOT7组凋亡细胞比例为5.7%,较阴性对照组显著降低,差异均有统计学意义 (P < 0.05) 。
3 讨论
TGF-β 1可有多种来源,在 HCC 组织中主要由Treg细胞分泌和肿瘤细胞自身分泌。肿瘤微环境中Treg 细胞的增加,很可能主要依赖于肿瘤来源的TGF-β 1[11]。肿瘤细胞分泌的 TGF-β 1可抑制 CD8+、NK细胞的杀伤功能,并将初始的 CD4+T 细胞诱导成 Treg 细胞;导致肿瘤细胞周围 Treg 细胞富集,分泌更多 TGF-β 1,形成肿瘤局部免疫抑制的微环境[12]。研究表明,TGF-β 1在细胞免疫和细胞凋亡过程中起重要作用。在肿瘤发展早期,TGF-β 1对肿瘤细胞起抑制作用,但是当肿瘤细胞对其抑制作用产生抵抗时,TGF-β 1反而会促进肿瘤进展,从而诱导肿瘤细胞迁移和侵袭,介导免疫抑制和肿瘤局部免疫微环境的改变,促进肿瘤细胞存活[13]。因此,探索肿瘤细胞高分泌 TGF-β 1的机制并通过靶向抑制其分泌,将有助于改善肿瘤的免疫微环境。

图5 细胞转染后NK细胞对HepG2细胞杀伤能力的变化Fig.5 Changes in the killing ability of NK cells toward HepG2 cells after transfection
本研究发现CNOT7基因在HepG2细胞系中能够正向调控TGF-β 1和NF-κ B p65蛋白表达水平,提示CNOT7可能通过NF-κ B p65通路调控TGF-β 1表达水平。此外,本研究还发现,敲减CNOT7后HepG2细胞外分泌的TGF-β 1水平显著降低。与此同时,与阴性对照组相比,CNOT7基因敲减后,HepG2细胞对NK细胞杀伤力的敏感性显著增加。这提示CNOT7基因表达下调部分逆转HepG2细胞对NK细胞的免疫耐受。通过检测细胞转染后NF-κ B p65蛋白的变化,发现CNOT7在HepG2细胞系中显著促进NF-κ B p65蛋白表达水平,提示CNOT7能够通过NF-κ B p65调控TGF-β 1表达水平。
综上所述,本研究结果表明:CNOT7基因可能通过NF-κ B信号通路调控TGF-β 1的分泌水平参与了HCC免疫微环境的调节,同时CNOT7基因表达下调增强NK细胞对肿瘤细胞的杀伤作用。CNOT7基因敲减改善HCC的免疫微环境,这可能为后续研究HCC免疫治疗提供新的靶点。
