基于荧光分析法和APTLD相结合的多环芳烃的检测
2019-03-26王书涛郑亚南朱文浩
杜 云, 王书涛, 郑亚南*, 朱文浩
(1. 河北科技大学 电气工程学院, 河北 石家庄 050018;2. 燕山大学 河北省测试计量技术及仪器重点实验室, 河北 秦皇岛 066004)
1 引 言
多环芳烃(Polycyclic aromatic hydrocarbons, PAHs)作为大气环境中主要污染物质之一,因其具有较强的致畸性、致癌性和致突变性,而引起了世界各国人们的共同关注[1]。多环芳烃是指分子中含有两个及两个以上苯环或杂环的碳氢化合物,包括苊、萘、芴、苯并类等150余种,是一类环境中广泛存在的化学致癌物[2]。多环芳烃广泛分布于空气、海洋、土壤中,大多来源于石油产品的泄露或精炼、矿物燃料及有机物的不完全燃烧、火山爆发及森林火灾等,严重危害着人类健康[3]。因此,研究一种快速检测多环芳烃化合物的方法具有十分重要的意义。PAHs的稳定性强、同分异构体的种类比较多,检测起来十分不易[4]。目前,针对芴(Fluorene,FLU)、苊(Acenaphthene,ANA)等多环芳烃的检测方法,常见的有气相色谱法(GC)、气相色谱-质谱法(GC-MS)、高效液相色谱法(HPLC)等,但这些方法在应用过程中干扰因素太多,无法进行在线监测[5]。而荧光光谱法因其具有操作简单、灵敏度高、样本数目比较少、实验数据包含信息量大等无法比拟的优点[6],在实时监测多环芳烃方面显示出巨大的应用潜力。
由于光源、光路等仪器本身噪声,以及外界干扰的存在,会使多环芳烃荧光光谱数据包含一定的噪声,所得光谱图上会带有毛刺,给后续数据分析带来误差,因而将Savitzky-Golay(SG)多项式曲面平滑法应用到三维光谱数据预处理过程中,对曲面进行拟合进行光谱平滑处理[7]。生活中多环芳烃大多以混合物的形式存在,所得光谱信号重叠严重,很难用化学或物理方法直接分离或测量。交替惩罚三线性分解算法(Alternating penalty trilinear decomposition,APTLD)避免了PARAFAC算法收敛速度慢、对组分数敏感的缺点,并有效防止了双因子退化,是将PARAFAC算法与SWATLD算法相结合的优化策略[8]。我们通过将APTLD算法与三维荧光光谱数据相结合,对多环芳烃混合物进行定性定量分析,取得了较好的回收率。
2 方法原理
2.1 三线性模型
在J个发射波长数、I个激发波长数下对K个样本(包括校正样本和预测样本)进行测定,得到一个大小为I×J×K的三维响应数据阵X[9]:
(1)
其中,i=1,2,…,I;j=1,2,…,J;k=1,2,…,K;xijk表示三维数据阵X中的一个元素;n表示荧光组分数;ain表示载荷矩阵A中的元素(i,n);bjn表示载荷矩阵B中的元素(j,n);ckn表示载荷矩阵C中的元素(k,n);eijk表示三维残差阵E中的元素。
2.2 交替惩罚三线性分解算法(APTLD)
APTLD是在基于PARAFAC模型基础上,利用交替最小二乘与交替惩罚限制相结合,通过同时最小化3个交替惩罚误差,达到三线性分解的过程[10]。三线性模型所得到的目标函数是各元素残差的平方和,如公式(2)所示:
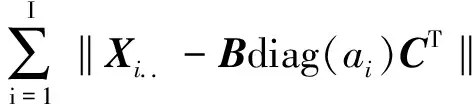
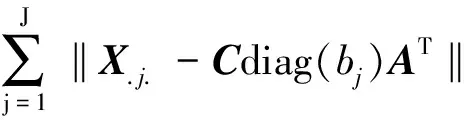
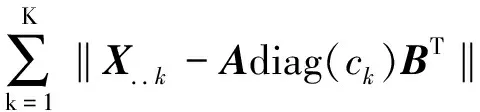
(2)
APTLD算法是在交替最小二乘原理基础上,根据公式(3)同时求得三维数据阵X的激发光谱矩阵A和发射光谱矩阵B以及相对浓度矩阵C的过程。
(3)
式中,Xi..、X.j.、X..k分别是三维数据阵X的第i个水平矩阵(J×K)、第j个侧面矩阵(K×I)和第k个正面阵I×J;A+、B+、C+分别表示A、B、C的Moore-penrose广义逆。α、β、γ控制着PARAFAC与SWATLD的权重,这3个参数的数值越大,APTLD越靠近SWATLD,这样就可避免像PARAFAC对预估计组分数的敏感,同时可在背景干扰下对待测样品进行定性和定量分析。
3 实 验
3.1 实验仪器与参数设置
仪器:英国Edinburgh Instruments公司生产的FS920荧光光谱仪,精密电子秤(型号为FA1004)。
参数设置:将FS920光谱仪的实验参数设置如下,激发波长扫描范围和发射波长扫描范围分别为200~370 nm和240~390 nm,激发波长的步长和发射波长的步长分别为10 nm和2 nm,仪器的激发狭缝宽度和发射狭缝宽度均为2.78 mm。为了避免瑞利散射的影响,设置发射起始扫描波长始终滞后激发起始扫描波长40 nm。
3.2 样品配制
样品:上海阿拉丁生化科技公司生产的FLU和ANA标准样品(纯度大于99.5%),甲醇(光谱级),超纯水。
配置标准溶液:用精密电子秤称取FLU和ANA各0.01 g,分别用少量甲醇溶液溶解,并置于两个10 mL的容量瓶中进行定容,得到2种被测物的一级储备液,浓度为1 g/L;分别取0.1 mL两种物质的一级储备液,置于2个10 mL的容量瓶中,并用超纯水稀释定容,持续震荡5 min,得到两种被测物的二级储备液,浓度为10 mg/L;分别再取0.1 mL二级储备溶液,置于2个10 mL的容量瓶中,并用超纯水稀释定容,持续震荡5 min,得到两种被测物的标准溶液,浓度为100 μg/L,并置于温度为4 ℃的环境中避光保存;接下来将不同体积各被测样品标准溶液,以不同比例和浓度混合,具体浓度配比如表1所示。
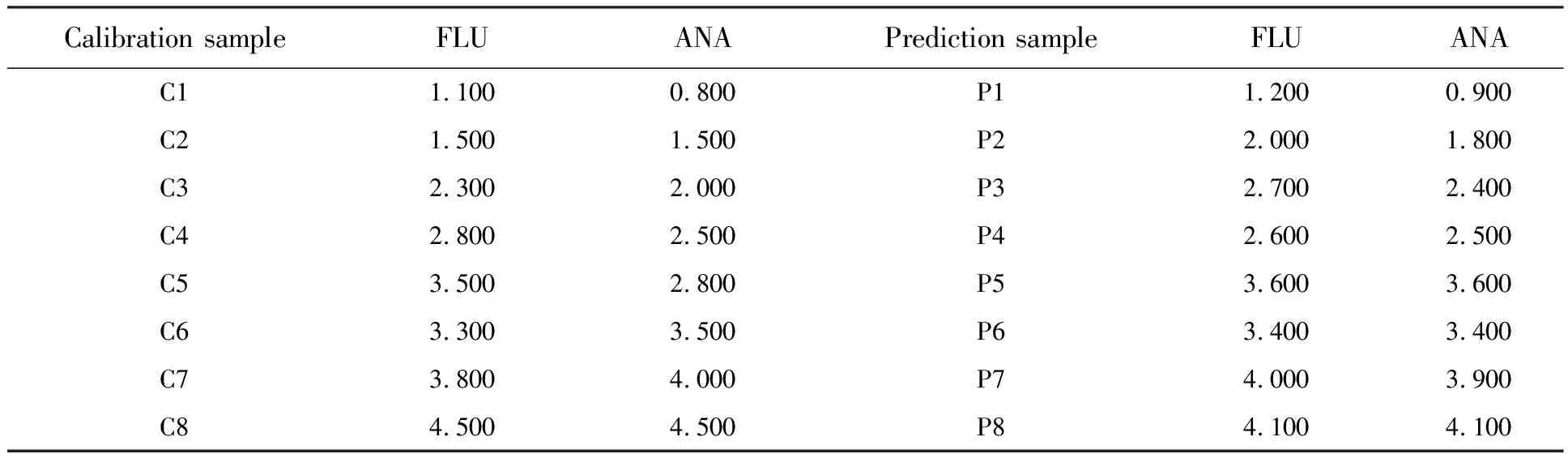
表1 样品质量浓度表
4 数据分析
4.1 FLU和ANA的荧光分析
本文选用甲醇作为3种被测多环芳烃的溶剂,而甲醇也是一种具有荧光特性的物质,为了了解甲醇是否对被测物质的荧光光谱产生影响,首先需要对溶剂甲醇进行光谱扫描和荧光特性分析。选定甲醇的激发波长扫描范围和发射波长扫描范围分别为200~370 nm和240~390 nm,得到甲醇溶剂的荧光光谱图,如图1所示。通过观察可以得到,甲醇的荧光峰位于λex/λem=300/350 nm,当其激发波长λex>500 nm时,光谱中有明显的瑞利散射,为避免瑞利散射对被测物质FLU和ANA荧光光谱的影响,将ANA和FLU的激发波长扫描范围均设置为小于500 nm。
分别取质量浓度10 mg/L的FLU和ANA溶液,对其进行荧光扫描得到FLU和ANA的三维荧光光谱和等高线图,如图2和图3所示。FLU溶液在λex/λem=302/322 nm处存在一个明显的荧光峰,该峰涵盖了被测溶液绝大部分有效荧光信息,便于对荧光特征更深入地分析。并且当激发波长和发射波长分别在260~290 nm和300~320 nm范围时存在连续侧峰。ANA溶液存在两个荧光峰,分别为λex/λem=290/322 nm和λex/λem=290/336 nm。
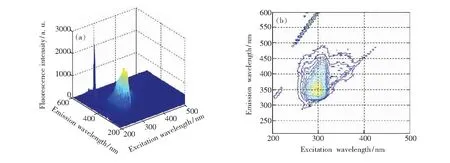
图1 甲醇的三维荧光光谱和等高线图
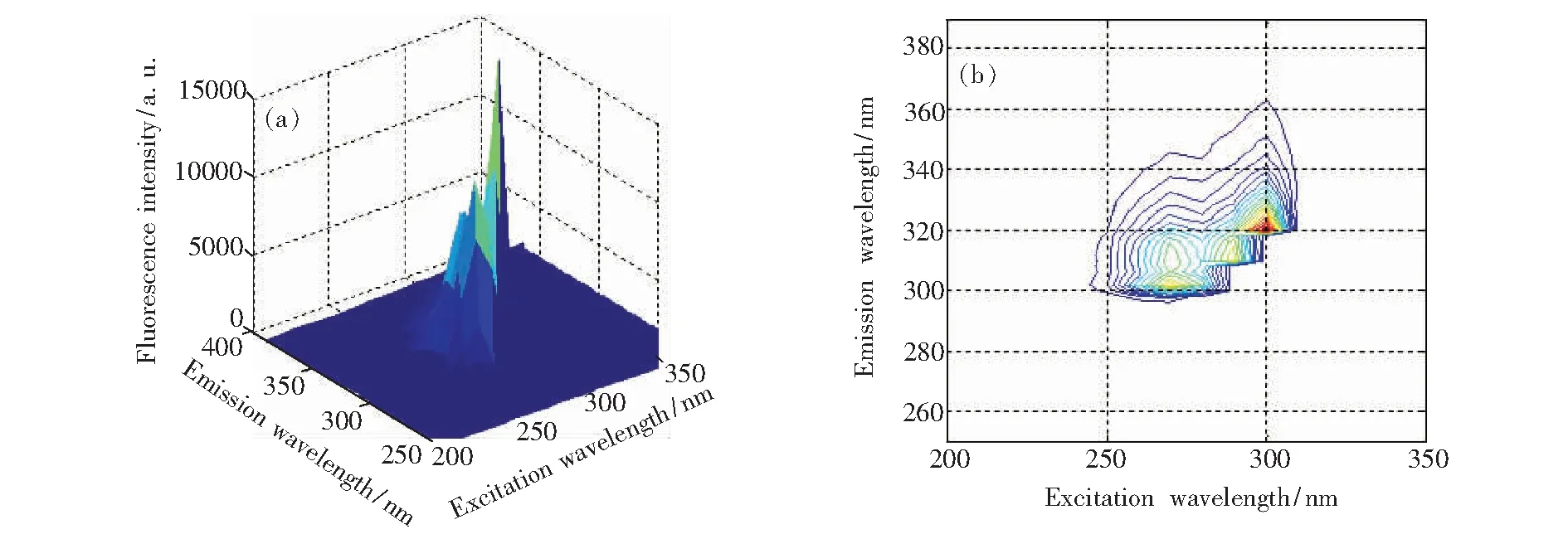
图2 FLU的三维荧光光谱和等高线图
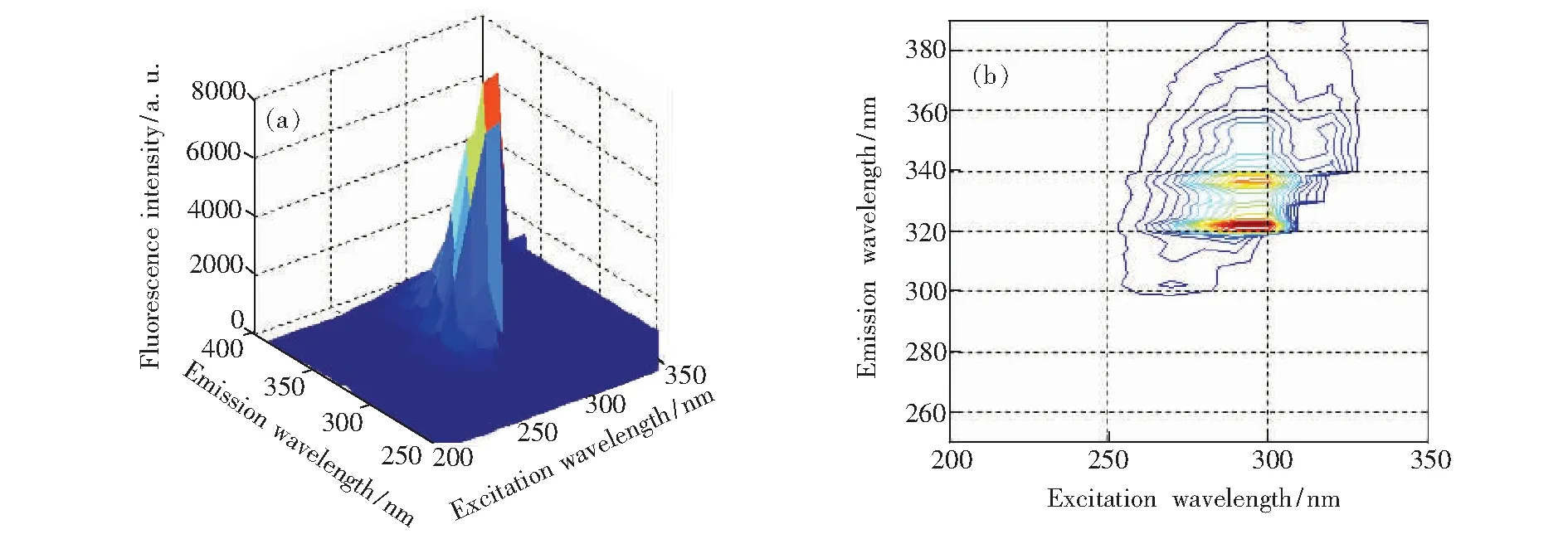
图3 ANA的三维荧光光谱和等高线图
通过分别观察两种溶液的荧光光谱特性,我们发现FLU溶液和ANA溶液在322 nm处存在相同的激发波长,FLU溶液的荧光特征峰λex/λem=302/322 nm与ANA溶液的两个荧光特征峰λex/λem=290/322 nm和λex/λem=290/336 nm均相聚较近。因此,FLU和ANA的混合溶液中FLU和ANA的荧光光谱重叠现象十分严重。
图4为4组不同浓度配比的FLU和ANA混合溶液的等高线光谱图。通过观察可以看出,在发射波长范围为240~390 nm、激发波长范围为200~370 nm内,受浓度配比的影响,不同浓度配比混合溶液的荧光光谱并不相同,混合液的光谱并不只是简简单单的线性叠加,仅根据光谱特性很难对各组分进行光谱分辨及浓度预测。
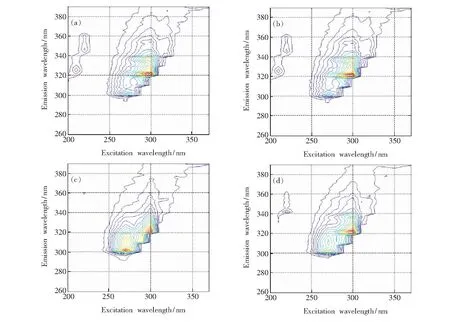
图4 4组混合物的等高线光谱图。(a)FLU:1.1 μg/L,ANA:0.8 μg/L;(b)FLU:4.5 μg/L,ANA:4.5 μg/L;(c)FLU:1.2 μg/L,ANA:0.9 μg/L;(d)FLU:2.0 μg/L,ANA:1.8 μg/L.
Fig.4 Contour fluorescence spectra of 4 groups of mixture.(a) FLU: 1.1 μg/L, ANA: 0.8 μg/L. (b) FLU: 4.5 μg/L, ANA: 4.5 μg/L. (c) FLU: 1.2 μg/L, ANA: 0.9 μg/L. (d)FLU: 2.0 μg/L, ANA: 1.8 μg/L.
4.2 FLU和ANA的光谱预处理
将Savitzky-Golay(SG)多项式曲面平滑法应用于本实验,以对质量浓度为10 mg/L的ANA溶液的数据进行平滑处理为例,得到如图5、图6和图7所示的处理结果,分别为平滑前后的三维荧光光谱、等高线光谱和荧光发射光谱对比图。
通过对比平滑前后的荧光光谱图,由图5我们可以看出,经Savitzky-Golay(SG)多项式曲面平滑处理后,ANA的荧光光谱变得更加平滑,光谱形状几乎没有发生改变,并去掉了部分冗余信息,使光谱信息更加凸显。由图6和图7我们可以看到,平滑处理后,ANA的荧光光谱中毛刺明显减少,光谱曲线也变得相对光滑,荧光特征峰位置和荧光强度也基本保持不变。因此,Savitzky-Golay(SG)多项式曲面平滑法可以很好地用于多环芳烃的三维荧光光谱预处理,并为后续数据处理分析做铺垫。
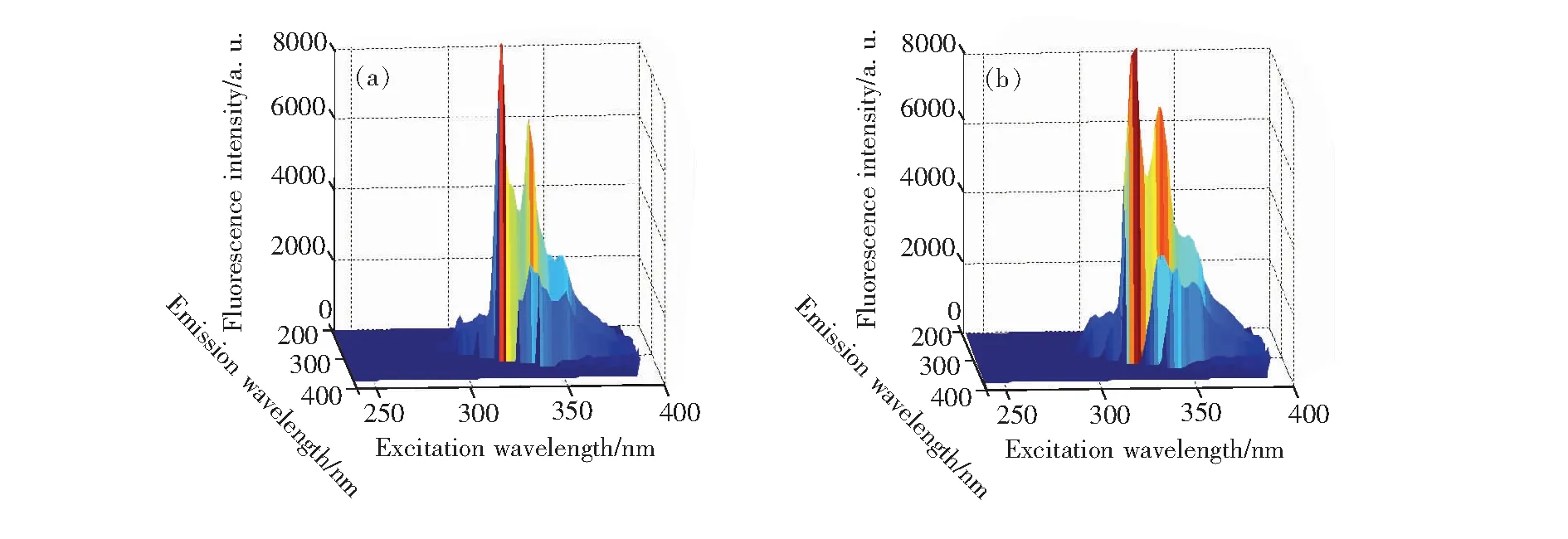
图5 ANA平滑前后三维荧光光谱对比图
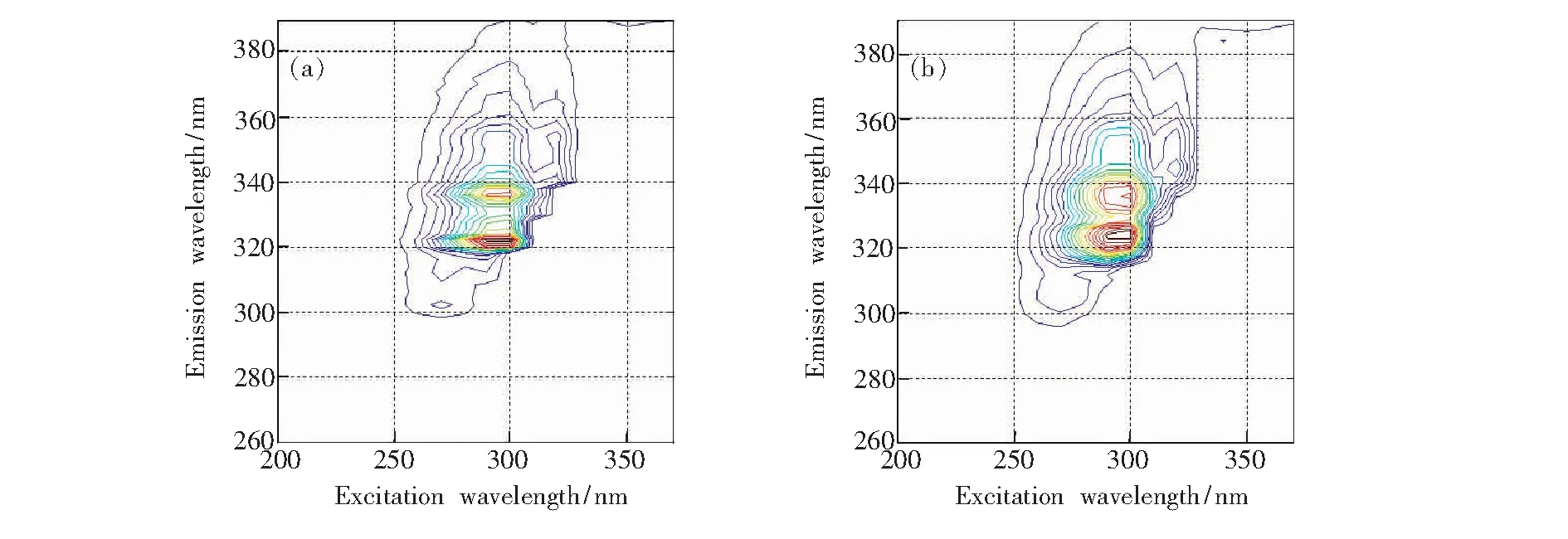
图6 ANA平滑前后等高线荧光光谱对比图
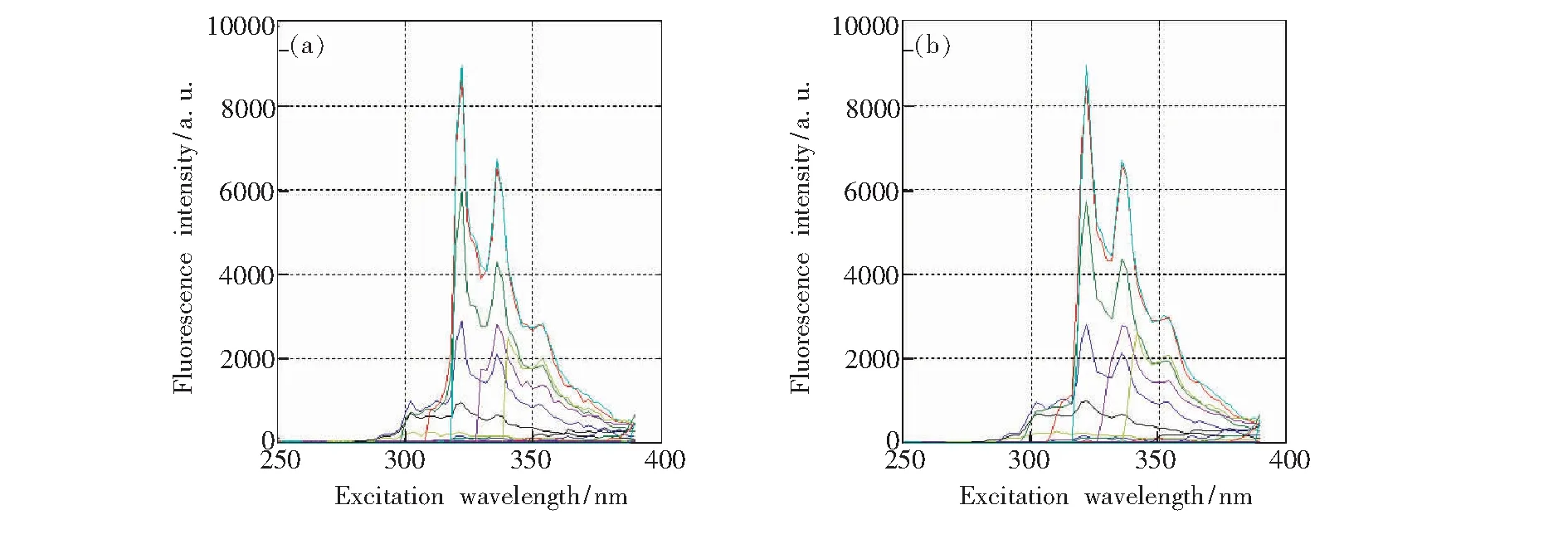
图7 ANA平滑前后荧光发射光谱对比图
4.3 FLU和ANA混合样品的定性定量分析
扫描校正和预测样品集中的样本C1~C8和样本P1~P8,得到一个16×76×18的三维数据阵X1。在数据解析之前,首先采用核一致诊断法[11]对三维数据矩阵X1估计因子数,如图8所示。
由图可知,当因子数是1和2时,核一致值是100%,当因子数超过2 ,随着因子数增大,核一致值逐渐减小,直至偏离三线性模型(即核一致值小于60%),因此选择N=2为最佳因子数,其中2个组分数分别为FLU和ANA所贡献。
用PARAFAC算法和APTLD算法分别对FLU和ANA混合溶液进行定性分析,图9为分别用PARAFAC算法和APTLD算法对X1分解得到的解析图,(a1)~(a3)分别为N=2(N代表因子数)时PARAFAC算法分解的样本图、发射波长图、激发波长图;同上述一样,(b1)~(b3)分别是N=2时APTLD算法定性分解的3种图。其中“黑色”代表ANA,“红色”代表FLU。通过分析发现,两种算法均可将FLU和ANA从混合物中成功地分辨出来。与PARAFAC算法相比APTLD算法对FLU和ANA混合物分解得到的发射光谱曲线形状更接近FLU和ANA的真实标准发射光谱曲线形状。因此,相对于PARAFAC算法来说,APTLD算法对FLU和ANA混合物定性分析的总体实验结果略好。
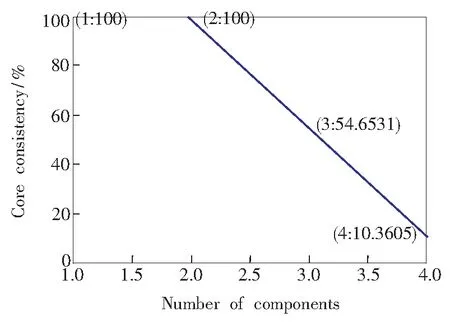
图8 X1的核一致值
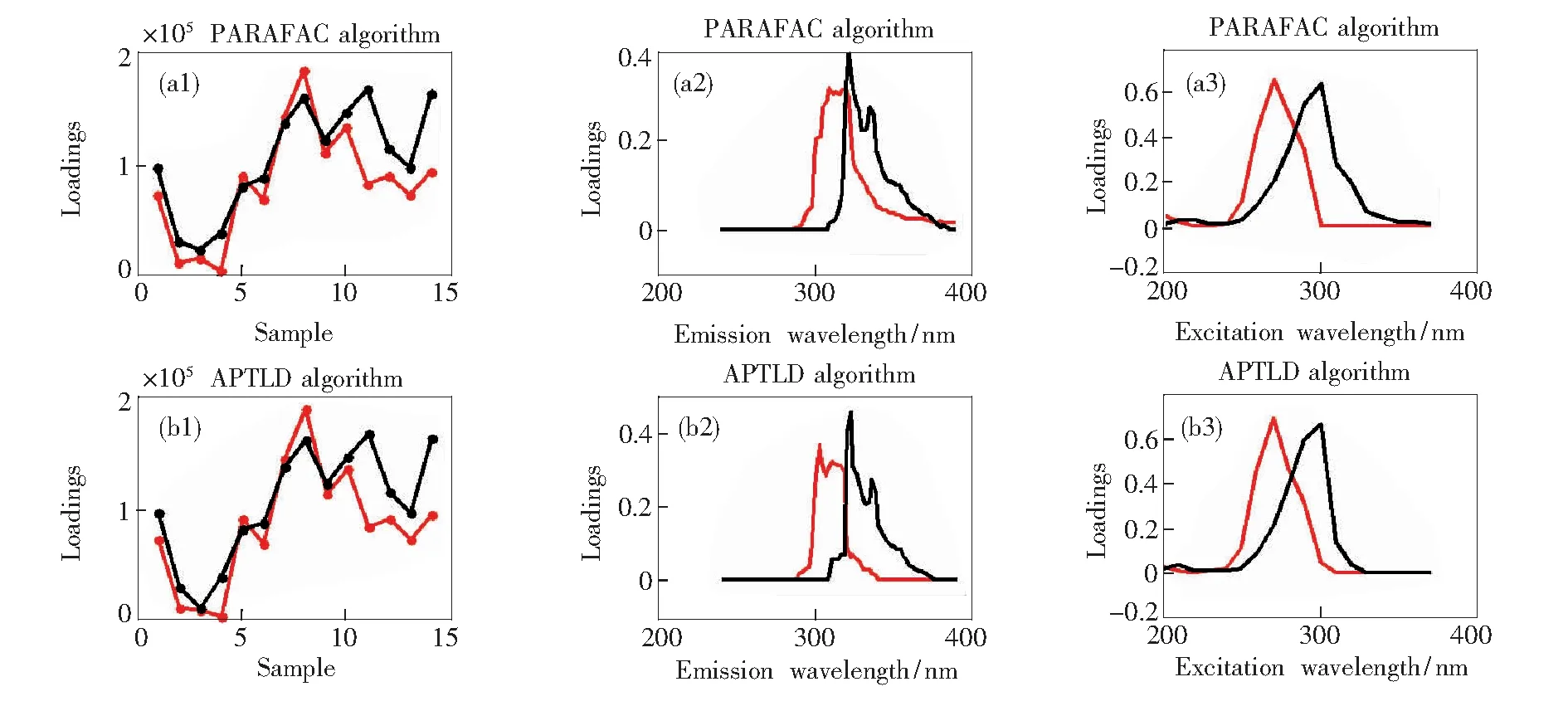
图9 PARAFAC算法和APTLD算法对混合物的定性分析
为验证APTLD算法对FLU和ANA混合物分辨效果确实优于PARAFAC算法,将FLU和ANA的二级储备液样本分别作为FLU和ANA的真实光谱数据,并利用归一化处理等手段对其进行处理,得到FLU和ANA的真实激发和发射光谱,然后将其与算法分解得到的激发和发射光谱拟合,拟合曲线如图10所示。通过观察发现,PARAFAC算法对混合物分解得到的发射光谱中,FLU的分解光谱与真实光谱存在一定偏差;而APTLD算法对混合物分解得到的发射光谱中,FLU的分解光谱与真实光谱吻合程度很高。且APTLD算法分解所得的估计光谱与真实光谱的整体拟合度也略高于PARAFAC算法。
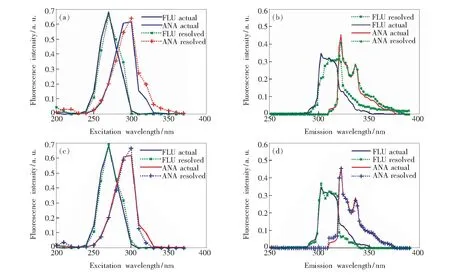
图10 FLU和ANA的解析光谱与真实光谱拟合曲线。(a,c)PARAFAC的解析光谱与真实光谱拟合曲线;(b,d)APTLD的解析光谱与真实光谱拟合曲线。
Fig.10 Spectra of actual solution and analyzed solution of FLU and ANA. (a, c) Spectra of actual solution and PARAFAC analyzed solution. (b, d) Spectra of actual solution and APTLD analyzed solution.
对预测样本P8~P15进行浓度估计,得到FLU和ANA的预测浓度、回收率等定量结果,如表2所示。从表2中可以看出两种算法对FLU和ANA含量预测均取得了很高的回收率,预测得到的结果与真实浓度十分接近。FLU和ANA的均方差关系为:APTLD 表2 FLU和ANA的浓度预测和回收率表 设计了多环芳烃类污染物的检测实验,获得FLU、ANA及两者混合溶液的荧光光谱,并进行荧光分析。针对多环芳烃类混合溶液不易检测的问题,提出APTLD与三维荧光光谱法相结合的方法,以数学分离代替化学分离。首先利用Savitzky-Golay(SG)多项式曲面平滑法去除三维荧光光谱数据的冗余信息,进而分别采用平行因子法(PARAFAC)算法和交替惩罚三线性分解(APTLD)算法对光谱数据进行分解,对混合物进行定性的分类鉴别和定量的浓度预测。实验结果表明,两种算法均能分辨出FLU和ANA,均取得了很高的回收率,但APTLD算法分解所得的估计光谱与真实光谱的整体拟合度略高于PARAFAC算法。因此,APTLD算法的检测效果更好,更适合对FLU和ANA的检测。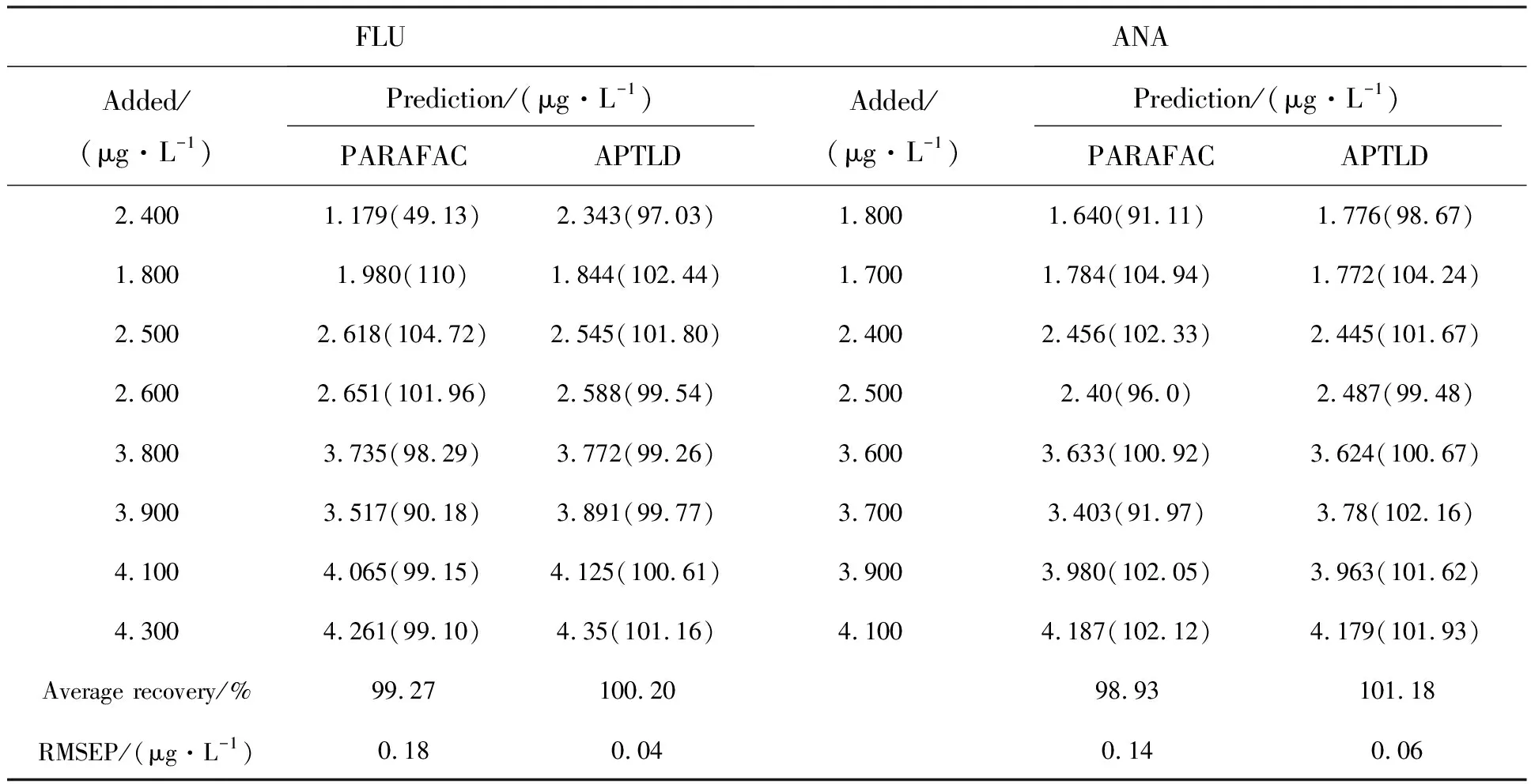
5 结 论
