体外培养法与RNA等温扩增法对脲原体检测能力比较
2019-03-26刘亚丽张文娟窦亚玲徐英春
刘亚丽,叶 莎,张文娟,王 洁,刘 畅,陈 雨,甘 勇,李 军,窦亚玲△,徐英春
(1.中国医学科学院北京协和医院检验科,北京100730;2.巴州人民医院检验科,新疆库尔勒 841000;3.保定市传染病医院检验科,河北保定071000; 4.河北省人民医院检验科,河北石家庄 050000;5.中国医学科学院北京协和医院皮肤科,北京100730 )
脲原体为黏膜相关病原体,主要存在于人体呼吸道及泌尿生殖道黏膜。当机体免疫力低下或接受侵袭性操作时,脲原体可进入血液引起感染甚至播散至其他器官。脲原体可通过直接接触进行传播,尤其在青春期性活跃健康人群下生殖道中可被分离到。从目前数据来看,脲原体可引起男性非衣原体、非淋球菌性尿道炎、急性附睾-睾丸炎、感染性结石,输卵管型不孕症、子宫内膜炎,还可引起极低体质量儿的下呼吸道感染、先天性肺炎、菌血症等[1-6]。此外,近期的研究数据还显示,由于脲原体会降低精液中精子浓度和影响精子活力而导致男性不育[7-10]。目前,针对脲原体的检测方法有多种,包括显微镜检查、抗原检测、血清学试验、体外培养法、分子生物学检测等。其中,体外培养法和分子生物学检测在临床微生物实验室中开展较多,且对临床指导价值较大。通过体外培养的方法,24~48 h就可检出脲原体,且可进行半定量和体外药敏。一般认为,当男性尿道脲原体数量>104CFU/mL时,具有临床意义[11-13]。分子生物学方法在对脲原体进行快速检测的同时,部分方法还可将微小脲原体和解脲脲原体进行很好区分[14]。虽然,两种检测方法在国内多家实验室均有开展,但目前还没有关于二者横向对比的研究。本研究将培养联合测序法作为参考方法,横向评估体外培养法和RNA恒温扩增法对脲原体的检测能力,从而为临床诊断和治疗提供更有利的指导。现将结果报道如下。
1 资料与方法
1.1一般资料 选取2016年1-8月就诊于北京协和医院皮肤性病科、妇产科、泌尿外科等多个临床科室,且送检标本为首次尿的患者,共计103例。
1.2方法
1.2.1采集标本 无论男女患者,仅留取清晨首次尿,或长时间(至少2 h)不排尿后的前段尿0.5 mL。
1.2.2检测方法 送检后将标本平均分成3份,第1份采用RNA等温扩增法检测脲原体,第2份采用体外培养法进行检测,第3份采用体外培养联合测序法进行检测,即培养结束后无论阳性阴性均要提取肉汤中核酸,进行普通PCR扩增和Sanger法测序。第3份测序的目的:(1)区分微小脲原体和解脲脲原体;(2)排除细菌污染可能。
1.2.3观察指标 将体外培养联合测序法作为参考方法,RNA恒温扩增法和单纯体外培养法作为待评估方法,分别评估两种待评估方法对脲原体检出的灵敏度和特异度。
1.2.4体外培养 采用法国生物梅里埃Mycoplasma IST 2试剂盒进行脲原体的检测,具体操作步骤严格按照厂家说明书完成。药敏折点:四环素S≤4.00 μg/mL R≥8.00 μg/mL;多西环素S≤4.00 μg/mL R≥8.00 μg/mL;克拉霉素S≤1.00 μg/mL R≥4.00 μg/mL;阿奇霉素S≤0.12 μg/mL R≥4.00 μg/mL;红霉素S≤1.00 μg/mL R≥4.00 μg/mL;交沙霉素S≤2.00 μg/mL R≥8.00 μg/mL;环丙沙星S≤1.00 μg/mL R≥2.00 μg/mL;氧氟沙星S≤1.00 μg/mL R≥4.00 μg/mL;原始霉素S≤2.00 μg/mL。其中S代表敏感,R代表耐药。
1.2.5RNA等温扩增法 脲原体核酸检测采用RNA等温扩增法(上海仁度生物科技有限公司),以16S rRNA作为靶基因。原理:带有T7启动子的引物与靶标RNA结合,开始逆转录合成cDNA;在莫洛尼鼠白血病病毒逆转录酶 (M-MLV RT)RNase H活性作用下,靶标RNA链降解,形成单链cDNA;之后反向引物与cDNA结合,在M-MLV RT聚合酶活性作用下,产生靶标核酸(RNA)的一个双链DNA拷贝,且该双链带有T7启动子。在T7 RNA聚合酶作用下,一条DNA双链上产生多个(100~1 000个)RNA拷贝;每一个RNA拷贝再从反转录开始进入下一个扩增循环。采用Roche Light Cycler 480 (美国)主机扩增及Roche Light Cycler 480 Software release 1.5.0 SP4进行数据分析。
1.2.6普通PCR扩增与Sanger测序 从体外培养阳性和阴性的肉汤中提取核酸(德国QIAamp MinElute Virus Spin Kit_DNA提取试剂盒),针对其脲酶基因进行普通PCR 扩增。针对脲原体采用通用引物-脲酶基因(GenBank 登录号 AF085724和 AF085732),前引物:5′-CGA AAT TGT GAT GAA CGA AGG-3′;后引物:5′-GGT GAT AGC GTT AGA TTA GGA G-3′,418 bp[15]。PCR反应体系为30 μL,采用高保真PCR SuperMix Ⅰ (北京天根生物科技有限公司),反应条件为94 ℃ 4 min,94 ℃ 1 min,54 ℃ 1 min,72 ℃ 1 min,35个循环,72 ℃ 10 min。扩增产物采用Sanger测序法测定其序列,引物与PCR扩增引物相同。测序结果分别与GenBank AF085724和AF085732进行比对,仅当序列比对一致率在>99% 时才被认为准确鉴定到种。
1.3统计学处理 采用SPSS24.0进行统计学分析,3种不同方法对脲原体进行检测,其检出率行Pearson′sχ2检验,P<0.05表示差异有统计学意义。
2 结 果
2.1患者信息 该研究共收集了103份非重复尿标本,分别来自103例患者,其中男性80例(77.7%),女性23例(22.3%),男女构成比差异有统计学意义(P<0.05)。103例患者中,30~<40岁49例(47.57%),患者人数最多;其余年龄段患者人数依次为20~<30岁28例(27.18%)、40~<50岁12例(11.65%)、0~<20岁6例(5.83%)、50~<60岁5例(4.85%)、≥60岁3例(2.91%)。
2.2不同检测方法测定脲原体结果比较 基于体外培养联合测序的方法,共有24例标本 (23.30%) 检测出了脲原体,其中14例 (17.50%) 分离自男性,10例(43.47%) 分离自女性,差异有统计学意义(P=0.022)。从年龄段来看,40~<50岁脲原体检出率最高[41.67%(5/12)];其余年龄段检出率依次是20~<30岁39.29%(11/28);30~<40岁16.33%(8/49);0~<20岁0%(0/6)、50~<60岁0%(0/5)和≥60岁0%(0/3)。如将体外培养联合测序法作为参考方法,横向评估体外培养法和RNA等温扩增法的灵敏度和特异度,其结果为体外培养法灵敏度和特异度分别为75.00%(18/24)和100.00%(79/79);RNA等温扩增法的灵敏度和特异度分别为95.83%(23/24)和96.20%(76/79),差异无统计学意义(P>0.05),见表1。在体外培养法与RNA等温扩增法结果不一致的8例标本中,全部属于RNA等温扩增法阳性,体外培养法弱阳性或阴性,经培养联合测序验证后,有5例(62.5%)证实存在脲原体。
2.3菌种鉴定 利用PCR联合测序的方法,对24份脲原体检出阳性标本进行了菌种鉴定。其中17例(70.83%)为微小脲原体,7例(29.17%)为解脲脲原体,未检查到二者共同存在的情况。
2.4体外药敏 18例培养阳性的标本进行了体外药敏测定,其中多西环素、交沙霉素、四环素、原始霉素敏感率100.00%,克拉霉素、红霉素和阿奇霉素的敏感率>80.00%,环丙沙星和氧氟沙星的体外敏感率分别为11.11%和22.22%,见表2。

表1 不同检测方法测定脲原体结果比较
注:*表示脲原体数量小于104CFU/mL为阴性
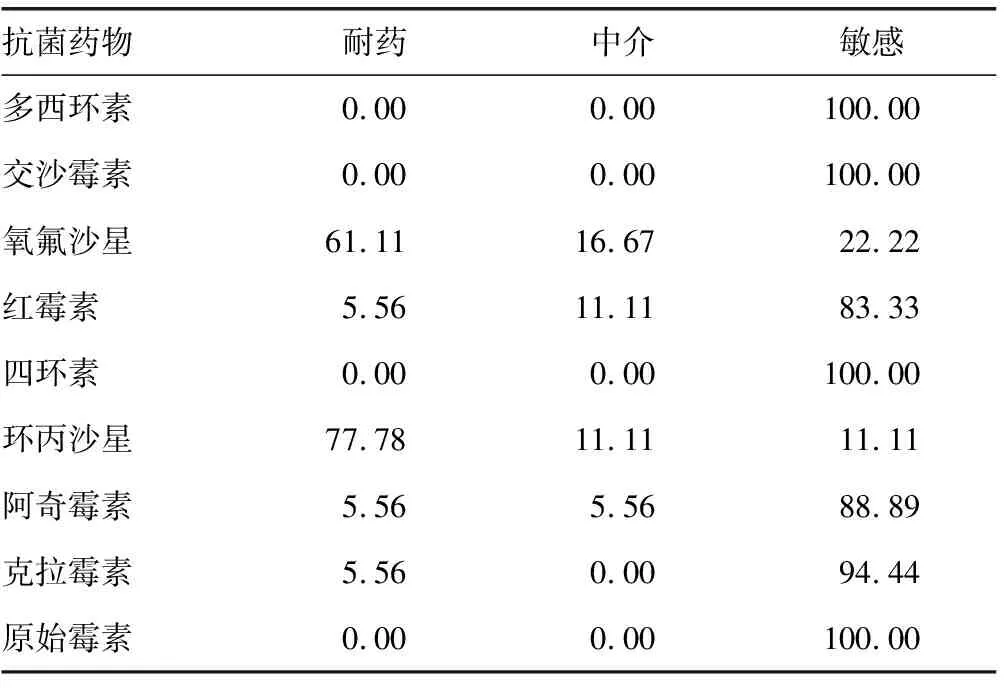
表2 18例培养阳性脲原体体外药敏试验结果分析(%)
3 讨 论
为避免标本对结果的影响,该研究仅采集清晨尿标本,混匀后平均分成3份,分别用3种不同的方法进行检测。此外,为更好地评估体外培养法和RNA等温扩增法的检测性能,该研究采用体外培养联合测序的方法作为参考方法。因为仅通过颜色判断培养阳性或阴性是不够准确的,所以该研究从培养液中提取核酸联合PCR扩增和测序的方法验证脲原体的真实性。
当横向评估体外培养法和RNA等温扩增法时,虽然二者灵敏度和特异度差异无统计学意义(P>0.05),但从方法原理来讲,RNA等温扩增法的灵敏度相对较高,体外培养法的特异度稍高。体外培养法有6例培养阴性但参考方法阳性,部分由于培养法通过定量检测可以排除定植,而核酸检测则不能以此区分定植和感染。 在分析RNA等温扩增法时,发现有1例属于参考方法阳性、体外培养法培养液红色而RNA等温扩增法阴性的标本。研究者推测标本中可能存在干扰PCR反应的物质,但具体原因仍不清楚。另外,还有3例属于RNA等温扩增法阳性而参考方法阴性的情况。这3例均为男性患者,由于门诊患者信息资料不全,且相关检查不够完善,已无法查证患者是否有典型的感染症状,抑或是无症状携带。
此外,该研究还对脲原体的菌种进行了进一步的鉴定。目前,脲原体分为解脲脲原体和微小脲原体两种,其中以微小脲原体较常见[12],与本研究结果完全相符。有研究表明,解脲脲原体和微小脲原体可同时存在[6,12],但该研究未发现此种情况。另外,体外药敏结果显示,喹诺酮类药物的耐药率非常高。目前研究证明,GyrA、GyrB、ParC、ParE序列的改变是导致脲原体对喹诺酮类药物耐药的主要原因,尤其是ParC的 S83L突变最为常见[16-19]。由于机制研究不是本课题的研究重点,所以会在后续研究中进行深入探讨。
4 结 论
与体外培养联合测序法相比,体外培养法和RNA等温扩增法均表现出了较好的灵敏度和特异度。但从临床应用角度来讲,二者联合使用可能会对脲原体感染的诊断和治疗提供更全面的指导。
