微滴数字PCR检测含有目的基因的PUC57质粒问题分析
2019-03-26杨德平刘维薇
杨德平,刘维薇
(1.上海健康医学院附属周浦医院检验科,上海 201318;2.上海市同济大学附属第十人民医院检验科,上海 200072;3.上海市皮肤病医院检验科,上海 200070)
近年来,微滴数字聚合酶链反应(ddPCR)作为新一代PCR,具有高灵敏度、高精密度和高准确度,使它在检测体细胞稀有等位基因突变或低浓度的DNA样本时比传统的实时荧光定量PCR(qPCR)更加可靠和适用[1]。它使用绝对定量取代标准曲线,已作为一种替代方法广泛用于临床和医学研究[2-4]。该方法依赖于对传统PCR反应有限的稀释和泊松统计[2,5]。在有限的稀释后,大多数反应不包含或仅包含一个靶分子,并且每个反应是独立的测试。通过泊松统计计算出有荧光信号的比值,最后得出样本中的绝对模板量[6-7]。PUC57质粒是大肠杆菌载体含有2 710 bp。本实验利用ddPCR检测含有目的基因的PUC57质粒,对检测过程中出现的酶切、酶切孵育时间和酶切后放置天数的问题进行了探讨,为同行提供参考。
1 材料与方法
1.1材料 根据GenBank中乙肝病毒DNA(HBV DNA)的序列,经过序列比对分析,针对HBV DNA保守区设计引物和探针,用引物扩增的那段目的基因片段(95 bp)构建PUC57质粒,质粒的构建由上海生工生物工程有限公司完成。质粒含有2 806 bp,质粒的浓度为237 ng/μL,通过换算为7.82×1010copies/μL。为获得线性DNA模板,用ECORⅠ酶对PUC57质粒进行酶切。酶切好的质粒放在2~8 ℃冰箱保存待用。
1.2仪器与试剂 ECORⅠ酶、10×ECORⅠ buffer购自上海生工生物工程有限公司,ddPCR试剂及其耗材购自美国Bio-Rad公司。QX200TM微滴生成仪、PX1TMPCR板封口机、QX100TMPCR仪、QX200TM微滴读取仪购自美国Bio-Rad公司。DH100-2恒温金属浴购自杭州瑞诚仪器有限公司。
1.3引物与探针 通过序列比对分析,针对HBV DNA保守区设计的引物和探针由上海生工生物工程有限公司合成,5′→3′引物探针序列为F:TAG ACC ACC AAA TGC CCC TA;R:GAG GCG AGG GAG TTC TTC TT;探针:FAM-ACT GTT GTT AGA CGA CGA GGC AGG TCC-BHQ1。
1.4酶切 将含有目的基因的PUC57质粒与ECORⅠ试剂按比例进行混合,放入37 ℃恒温金属浴中孵育,为了使酶切后的质粒通过ddPCR检测后所得值与质粒理论值相符,研究者用了2个孵育时间,一份混合物孵育2 h,另一份混合物孵育4 h,在孵育的时间到达后,每份混合物再65 ℃孵育20 min,灭活ECORⅠ酶,酶切总体积为20 μL(包括ECORⅠ 1 μL、10×buffer 2 μL、PUC57质粒4 μL、ddH2O 13 μL)。酶切得到的线性DNA模板再用ddH2O稀释成100、101、102、103copies/μL,稀释的模板用于ddPCR检测。最后比较两个孵育时间后,酶切混合物经过ddPCR检测所得值与质粒理论值差异有无统计学意义。
1.5ddPCR检测 按照仪器操作指南,反应体系为20 μL,其中ddPCR Supermix 10 μL,上下游引物(900 nmol/L)各1 μL,探针(250 nmol/L)0.3 μL,质粒4 μL,ddH2O 3.7 μL。使用QX200TM微滴生成仪生成微滴,然后用PX1TMPCR板封口机热封96孔板,最后使用QX100TMPCR仪对含有目的基因的PUC57质粒进行扩增,反应条件为:95 ℃ 10 min;94 ℃ 30 s,57 ℃ 60 s,35个循环;98 ℃ 10 min;4 ℃保存。扩增结束后将96孔板放入QX200TM微滴读取仪中对扩增产物进行分析,检测到荧光信号的被记为阳性反应,没有检测到荧光的被记为阴性反应。最后通过QuantaSoft分析软件计算出质粒的绝对浓度。
1.6统计学处理 采用SPSS20.0统计软件进行。所有拷贝数进行Log10转换,正态分布资料两组间比较采用两独立样本t检验。偏态分布资料采用Mann-WhitneyU检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1ddPCR检测酶切孵育2 h与4 h后的PUC57质粒结果比较 酶切孵育2 h后检测结果经Log10转换后分别为0.146、1.531、2.486、3.475 copies/μL,酶切孵育4 h后检测结果经Log10转换后分别为0.663、1.556、2.643、3.623 copies/μL,检测结果见图1。两个酶切孵育2 h与4 h后,ddPCR检测结果孵育时间后,酶切混合物经过ddPCR检测所得值与质粒理论值差异均无统计学意义(t=-0.192、-0.403,P>0.05)。
2.2ddPCR检测酶切与没有酶切的PUC57质粒 没有酶切的PUC57质粒检测结果经Log10转换后均值分别为0.362、0、0.851、0.398、0.857、2.174 copies/μL,酶切的PUC57质粒检测结果经Log10转换后均值分别为0.568、1.656、2.672、3.637、4.681、5.332 copies/μL,检测结果见图2。酶切组与没有酶切组之间差异有统计学意义(Z=-4.194,P<0.05),酶切组与理论值之间差异无统计学意义(t=-0.2,P>0.05)。
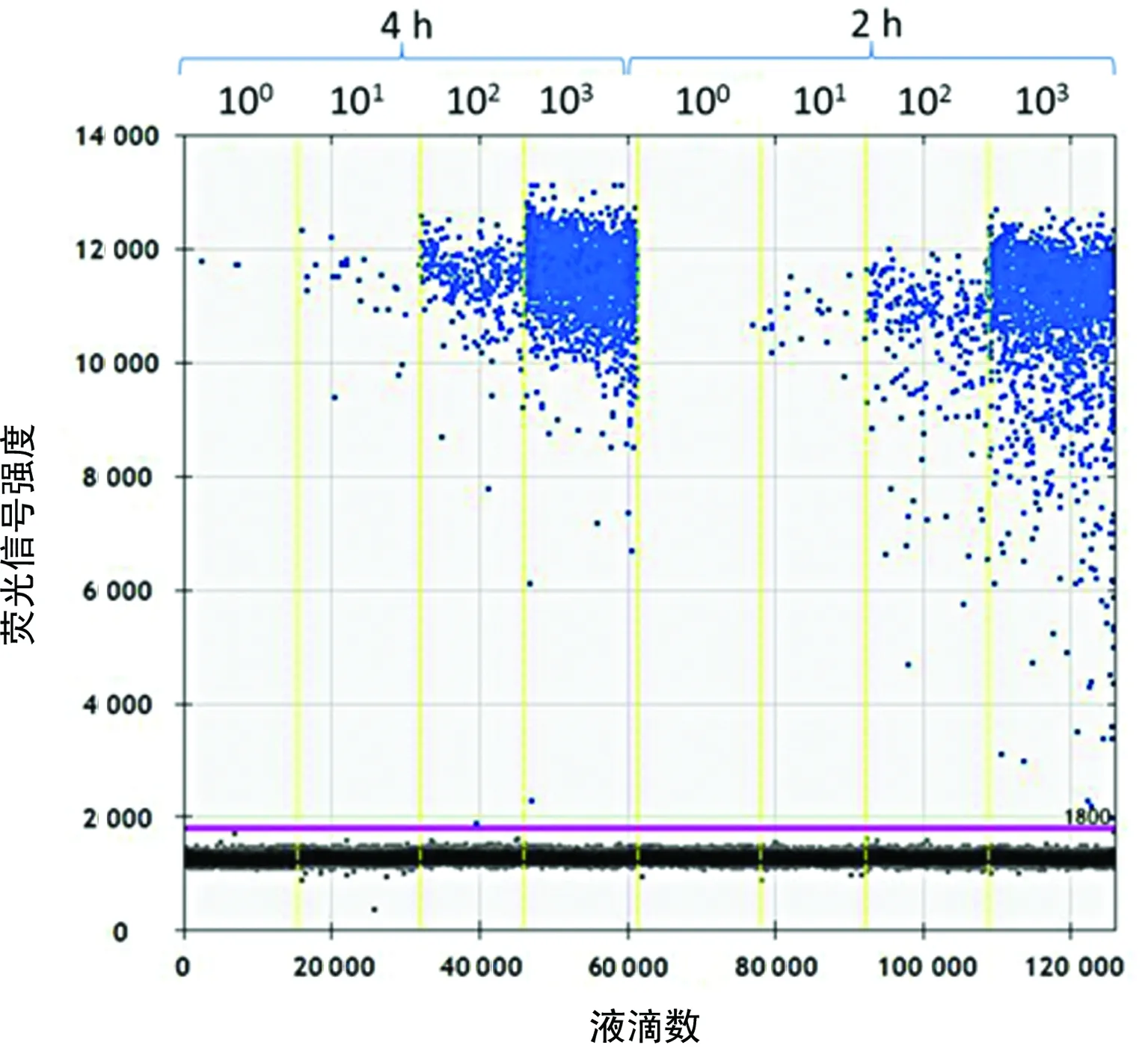
图1 酶切2 h与4 h的PUC57质粒ddPCR检测结果
2.3ddPCR检测放置不同天数的酶切PUC57质粒 选用酶切PUC57质粒的101和103copies/μL的稀释度,用ddPCR分别检测刚酶切的、放置在2~8 ℃冷藏2周和4周的PUC57质粒,每个稀释度各检测2次,刚酶切的PUC57质粒的101稀释度的检测结果均值是47 copies/μL,103稀释度的检测结果均值是4 520 copies/μL。2周后的检测结果分别是30和1 738 copies/μL。4周后的检测结果分别是20和660 copies/μL。从检测结果可以看出随着酶切PUC57质粒放置天数的增加,高低浓度的质粒检测值在逐渐降低。见图3。
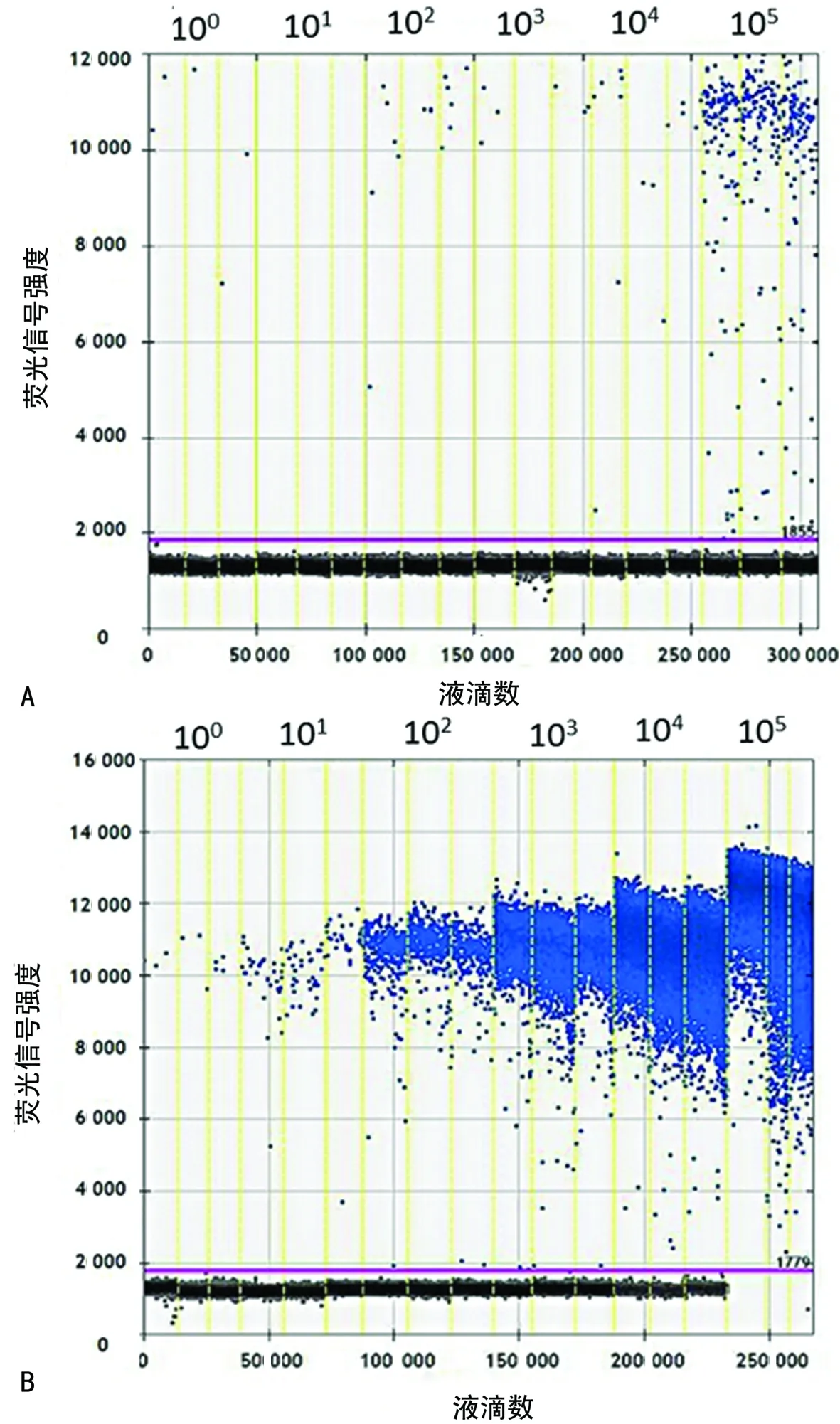
注:酶切与没有酶切的PUC57质粒分别用ddH2O稀释成100、101、102、103、104、105copies/μL,每个稀释度用ddPCR检测3次;A为没有酶切的PUC57质粒组;B为酶切的PUC57质粒组
图2酶切与没有酶切的PUC57质粒ddPCR检测结果
注:A为刚酶切检测结果;B为酶切后放置2周检测结果;C为酶切后放置4周检测结果
图3放置不同天数的酶切PUC57质粒ddPCR检测结果
3 讨 论
ddPCR由于它是不依赖于外部校准曲线或参考,能敏感的和特异的检测核酸,同时相比qPCR,它对PCR抑制剂低敏感[8],已成为一种新的分子检测技术[9-10]。这项技术是稀有事件检测或拷贝数变异估计等需要精确定量应用的理想工具[11]。因此,ddPCR的应用越来越广泛,在癌症检测,核酸定量上应用越来越多[12-13]。ddPCR正在迅速取代qPCR作为独立的DNA定量分析的一种有效方法[14]。本研究对HBV DNA的一段保守区域设计引物和探针,同时对这段保守区域构建质粒,再利用ddPCR检测含有HBV DNA目的基因的PUC57质粒。
本文在用ddPCR检测PUC57质粒前先用ECORⅠ酶对构建好的PUC57质粒进行酶切,在酶切过程中用了两个孵育时间,一个是孵育2 h,另一个是孵育4 h。研究结果显示,利用ddPCR分别检测酶切2 h和4 h的PUC57质粒,结果与质粒理论值进行比较,差异无统计学意义(t=-0.192、-0.403,P>0.05)。说明ECORⅠ酶在孵育2 h后就可以把PUC57质粒完全切开,能保证酶切后质粒通过ddPCR的检测结果和质粒的理论值一致,从而也保证了接下去的ddPCR性能验证实验顺利进行。所以没必要担心酶切时间不足,质粒酶切不完全而影响实验结果,这与文献报道的时间相符[15]。
本研究利用ddPCR对酶切和没有酶切的PUC57质粒进行检测,对检测结果进行比较,发现没有酶切的PUC57质粒ddPCR几乎没有检测出来,而酶切的PUC57质粒检测结果很好,两者相比,差异有统计学意义(Z=-4.194,P<0.05)。酶切的PUC57质粒检测结果与PUC57质粒理论值相比,差异无统计学意义(t=-0.2,P>0.05)。究其原因,可能没有酶切的PUC57质粒是环状容易形成超螺旋结构,在高温变性时双链DNA不容易打开,在低温退火时引物和探针不能结合到模板链上,从而影响了扩增效率。另一方面,可能是ddPCR自身原因导致。伯乐QX200TM微滴式数字PCR是将20 μL的反应体系通过微滴发生器产生20 000个油包水的微滴,每个微滴只有1 nL。没有酶切的PUC57质粒含有2 806 bp,体积相对比较大,可能不容易形成微滴,从而降低了检测结果。而酶切过的PUC57质粒只有95 bp的目的基因片段,体积小容易形成微滴,所以检测结果与PUC57质粒理论值相符。
同时,本研究还对放置了不同时间的酶切PUC57质粒进行检测。研究结果显示,放置了2周和4周的酶切PUC57质粒相比刚刚酶切的PUC57质粒,其检测值在逐渐降低,说明酶切的PUC57质粒随着放置时间的延长,可能线性DNA模板又还原成环状的模板,从而降低了扩增效率,该假设有待进一步实验证明。例如对放置了2周和4周的酶切PUC57质粒进行核酸电泳,看在2 806 bp位置有没有条带出现,如果有说明线性DNA模板已还原成环状的模板,如果没有就要分析其他原因,如95 bp的线性DNA片段自身发生了降解,具体原因还有待进一步分析。
4 结 论
ddPCR是一种灵敏和准确的新型核酸定量方法,特别是在检测低拷贝载量。在科研工作中经常会用ddPCR检测质粒,本研究得出的结论是利用ddPCR检测含有目的基因的PUC57质粒时要先进行酶切再检测,酶切时间只需2 h即可将质粒酶切完全,同时酶切的PUC57质粒不宜放置过久,要尽快检测。
