微萃取-原子吸收法测定水样中的隔离子
2019-03-25席志军张艳玲
席志军 张艳玲

摘要:文章以1-十二醇为萃取剂,甲醇为分散剂,建立了测定环境水样中痕量隔的微萃取-火焰原子吸收分光光度法,并对萃取条件进行了优化。实验结果表明:在优化后的实验条件下,该法对隔离子的富集倍数为119倍,线性范围为1~200ng/mL,相关系数为0.9915,检出限为0.25ng/mL,相对标准偏差2.1%-4.3%。
同时,利用该法对实际的自来水与河水进行了分析检测,其加标回收率为95.8%-97.7%之间。
关键词:微萃取;原子吸收;隔离子
中图分类号:TQ028.3+2文献标识码:A 文章编号:1001-5922(2019)06-0053-04
随着科技经济的急速发展,人们的生活水平有了很大的提升,但也给环境造成了严重的污染,而且重金属污染更是极为严重。目前,重金属污染主要有化工生产、机械制造等产生的重金属废水,汽车尾气和一些农药除草剂的过量使用。这些重金属离子进入环境中不易被降解,会通过食物等聚集进入人体,造成慢性中毒。隔的毒性较大,若在人体蓄积,会对人体的器官及免疫系统造成不可逆损害。
目前,隔的检测手段最常用的为火焰原子吸收分光光度法,其操作简单、成本低、选择性高,但是一般重金属镉的含量较低,该法测量的灵敏度较低,测量结果不稳定,因此在测量前应对待测离子进行预处理富集,并除去样品中的干扰项。常用的富集手段以萃取手段为主,但萃取过程使用的有机溶剂会对人体造成一定的危害,且操作较为复杂。为了能尽量降低有机溶剂,Leong等提出了悬浮凝固化有机液滴液相微萃取的技术,该法有效的将分散液相微萃取和悬浮固化微萃取相结合,实现了操作简单、萃取时间短、回收率高且易于检测等优点,该法一经提出,就被广泛应用于化学、医药等领域。本文主要利用该技术对水样中的痕量隔进行萃取检测,分析筛选了萃取的最佳实验条件,并对实际水样中的痕量隔进行了分析检测,建立了水样中痕量镉测定的新方法。
1 实验部分
1.1实验药剂与材料
实验药剂:Cd2+标准储备液(1000ug/L);Cd2+工作液(10mg/L);丙酮、正十二醇、正十一醇、十六烷、8-羟基喹啉等均为分析纯;甲醇为色谱纯;蒸馏水。缓冲溶液:由不同比例的M/25混酸(H3PO4,CH3COOH和H3BO3)与0.2mol/L的氢氧化钠配成广泛缓冲溶液。实验际待测水样取自来水与河水。实验仪器:原子吸收分光光度计、离心机、多功能氮吹仪、pH计、电子分析天平。
1.2实验方法
微萃取过程:量取20mL的待测溶液于25mL的离心管中,加入2g的NaCl,利用缓冲溶液调节pH至7,再加入0.75mL的8-羟基喹啉螯合剂,随后立马加入一定量的萃取剂1-十二醇和分散剂甲醇混合溶液,急速搅拌使其形成乳浊液体系,样品中的待测物经萃取转移至1-十二醇液滴中,随后高速离心,使得萃取液滴漂浮至溶液表面,最后在冰浴条件下使得萃取剂凝固,并将其转移至另一小试管中,加入375uL的甲醇后,利用原子吸收光谱仪对样品进行分析。实验过程中,主要考察了萃取剂与分散剂的体积,萃取时间,pH值、螯合剂加量以及干扰离子等对实验的影响,并对实验条件进行优化,优化实验选择20ng/mL的镉离子样品溶液进行,样品体积为20mL。
2结果与讨论
2.1萃取剂的选择及优化
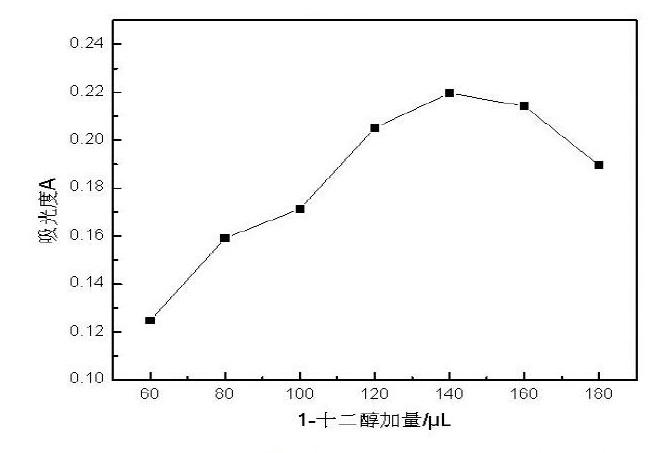
为了研究以1-十二醇作为萃取剂对萃取效果的影响,实验过程中不改变其他的实验条件,当萃取剂1-十二醇的加量分别为60、80、100、120、140、160、180uL时,以隔离子的吸光度为考察对象,萃取效果如图1所示:
由1图可知,当萃取剂1-十二醇的加量逐渐增大时,样品的萃取回收效果呈现出先逐渐增多后逐渐降低的特征曲线,当1-十二醇的加量增大至140uL时,萃取样品隔离子的吸光度0.2196A,之后萃取回收率明显下降,出现这一现象的原因可能是当加入过量的萃取剂1-十二醇时,使得溶液中的有机相增大,离心反应后使得目标萃取物的浓度有所降低,使得样品的吸光度有所下降。因此,本实验选择的萃取剂加量为140uL。
2.2分散剂的优选
在萃取过程中加入一定含量的分散剂,不仅可以很好地使萃取剂分散,还可以形成乳浊液体系,有利于实验的进行。当实验的其他条件不变时,以隔离子的吸光度为考察对象,研究加入不同量的分散劑(甲醇)对实验的影响,实验结果如图2所示:
由图2可以看出,随着分散剂甲醇加量的增加,萃取产物中隔离子的吸光度逐渐增大,当甲醇的加量为1.6mL时,吸光度达到最大,萃取效率最佳,之后继续增大分散剂甲醇的加量,隔离子吸光度逐渐减小。出现这一现象的原因可能是分散剂甲醇量较少时,1-十二醇不能完全分散至水相中,不能形成乳浊液体系,使得萃取效率明显降低。但是当甲醇量过多时,隔离子的溶解度增大,且不易被萃取,萃取效率明显降低。因此,本实验的最佳分散剂体积为1.6mL。
2.3pH值的选择及优化
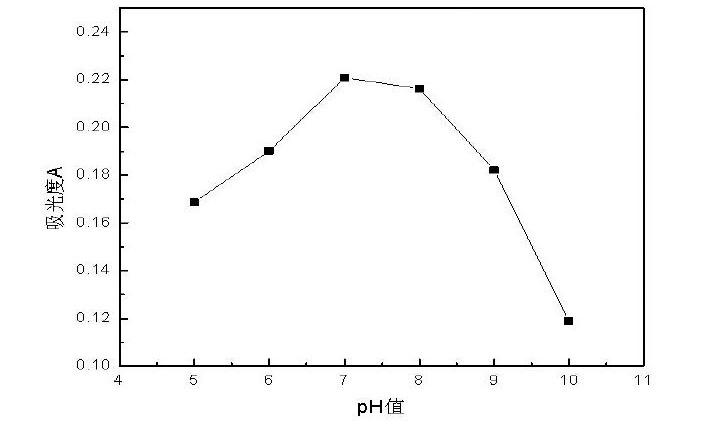
为了研究溶液的酸度对对实验结果的影响,本实验主要考察了pH在5~10范围下对吸光度的影响,实验结果如图3所示
由图3可知,当溶液的pH值逐渐增大时,其吸光度逐渐增大,当pH值为7时,吸光度达到最大值,此时的回收率最佳,之后继续增大溶液的pH值后,其萃取物的吸光度逐渐降低。产生这一现象的原因可能是溶液的酸碱性会影响金属配合物的稳定性,在酸性条件下时,金属离子与配位剂形成的配合物不稳定;而在碱性的环境中,隔离子又会发生水解反应,影响了配位反应的进行。因此,溶液在酸性和碱性环境中不利于配合物的稳定形成,本实验溶液的pH值选择为7。
2.4螯合剂加量的选择及优化螯合剂的加入可以与铬离子形成稳定的金属配合物,为了研究螯合剂8-羟基喹啉的加量对萃取物吸光度的影响,在其他实验条件不变的情况下,实验结果如图4所示。
由图4可知,随着8-羟基喹啉加量的逐渐增大,萃取物的吸光度也逐渐增大,当螯合剂的加量达到0.8mL时,吸光度达到最大值,继续增大螯合剂的加量,吸光度有所下降。产生这一此现象的原因可能是由于在加入少量的螯合剂时,水溶液中的待测铬离子不能完全被螯合,使得萃取效率较低;当加入过量的螯合剂时,因为水溶液中的待测隔离子有限。不能完全满足配位反应,同时,过多的螯合剂之间也会互相聚集,使得部分配位点不能与金属离子产生配位反应,导致萃取效率降低。因此,本实验中螯合剂8一羟基喹啉加量为0.8mL。
2.5萃取时间对反应的影响
金属离子与螯合剂发生配位反应后,加入萃取剂一分散剂的混合溶液,可以有效的将金属配合物萃取出来,为此分析了不同的萃取时间对萃取效果的影响,实验结果如图5。
由图5可以明显看出,随着萃取时间的延长,产物的吸光度值变化基本不大,说明萃取时间的长短对于萃取效率没有显著地影响,进一步表明该试验方法中的螯合反应与萃取反应能快速完成并达到平衡点。
2.6其他离子的影响
为了研究出水体中其他离子(Mg2+2+;Ca2+2+;Fe3+3+;Fe2+2+;SO42--;Cl-)对萃取效果的影响,在待测溶液中加入一定浓度干扰离子,探讨其浓度对铬离子萃取效果的影响。实验结果如表1所示,同时研究发现实际水样中这几种离子的浓度均在最大允许值之下,因此证明了该方法的可靠性。
2.7样品分析检测
经过以上实验,筛选出了最佳的实验条件,并得到隔的回归方程:A=0.01098c+0.0016,相关系数为0.9915,且在1~200ng/mL之间具有良好的线性范围,且实验的相对标准偏差为2.96%,方法的检出限为0.25ng/mL,隔离子的富集倍數为119倍。同时,对实际自来水和河水中的隔离子含量进行了萃取、测定。并平行测定5次进行回收率实验,结果如下表2所示,且平均加标回收率为95.8%-97.7%之间,相对标准偏差2.1%-4.3%。
3 结论
本实验主要研究了微萃取与火焰原子吸收光谱结合对水样中隔离子的检测,并筛选出了最佳的微萃取条件,建立了一种灵敏、快速测定水样中痕量隔的方法,且该法重现性较佳,检测线低,结合了分散液相微萃取与悬浮固化微萃取的优点,是水样中痕量隔元素检测的一种新途径。同时为其他金属离子的萃取富集、检测提供了一些新的思路与见解。
