小球藻破碎率检测方法的定量比较
2019-03-25秦胜男黄远星
秦胜男,黄远星,穆 岩
(1.上海理工大学 环境与建筑学院,上海 200093;2.河北省环境监测中心站,河北 石家庄 050056)
小球藻是一类普生性单细胞绿藻,易培养、倍增速率快、温度耐受性强、油脂含量较高[1-2],具有非常高的利用价值。目前,其油脂可作为生物柴油的原料[3-5],同时还可提取其他多种有效成分,比如生长因子CGF(chlorella growth factor)。小球藻富含维生素,可作为生产维生素A、维生素B1、维生素B2、维生素B6和维生素C等的来源[6]。它也是进行生物技术研究的材料,其多糖与蛋白质已被证明具有显著的抗肿瘤活性、抗原病菌以及抗病毒感染能力[7]。
但小球藻具有坚韧的纤维素细胞壁[8],无论是提取油脂或是胞内蛋白等,都需要采用破碎方法将细胞壁破碎,而在破碎过程中需检测小球藻破碎率来表征破碎程度,因此,选择操作简便、测量精准的破碎率检测方法尤为重要。
光密度法是利用藻细胞在某一波长处的光吸收值来测定细胞密度的方法[9],同时超声波破碎后的藻液亦可用丙酮提取比色法来测定悬浊液中的叶绿素含量[10]。细胞计数法是定量分析中较为可靠的方法[11],但其操作过程较为繁琐,且若取量不均,或样品中的细胞浓度过低时,容易造成一定程度的误差[12]。
本文比较了浊度法、吸光度法、细胞计数法和紫外分光光度法检测破碎率的可行性,为优化定量比较小球藻破碎率的方法提供了参考与依据。
1 材料与方法
1.1 实验材料与试剂
实验用小球藻藻种(FACHB编号752)由武汉中科院水生所藻种库购得。
BG-11 培养基[13]:硝酸钠(1.5 g·L-1),磷酸氢二钾(0.04 g·L-1),硫酸镁(0.075 g·L-1),二水氯化钙(0.036 g·L-1),柠檬酸(0.006 g·L-1),柠檬酸铁铵(0.006 g·L-1),乙二胺四乙酸(0.001 g·L-1),碳酸钠 (0.02 g·L-1),微量元素母液(1 mL·L-1):硼酸(2.86 g·L-1),四水合氯化锰(1.86 g·L-1),七水硫酸锌(0.22 g·L-1),二水钼酸钠(0.39 g·L-1),五水硫酸铜 (0.08 g·L-1),六水硝酸钴(0.05 g·L-1)。
实验用仪器:赛福PGX-350B智能培养箱,JYD-1200L超声波细胞粉碎机,CT14D离心分离机,2100p浊度仪,723N可见分光光度计,TV-1810紫外分光光度计,Bright-Line细胞计数板(HAUSSER SCIENTIFIC公司),光学显微镜(DME),LGJ-10D真空冷冻干燥机,日立S4800扫描电子显微镜。
1.2 小球藻的计数
采用四种计数方法对小球藻破碎前、后进行定量测定:
(1)浊度法:测定藻液浊度[14]。
(2)吸光度法:分别在波长为540、680 nm下测定藻液吸光度[15]。
(3)细胞计数法:使用细胞计数板对藻液中的小球藻进行直接计数[12]。
(4)紫外分光光度法:将藻液进行转速为12 000 r·min-1、时间为 20 min 的离心操作。取上层清液,在260 nm下测定其紫外分光光度[16]。
采用每种方法对每个样品测定3次,取平均值。
1.3 小球藻的培养
小球藻采用逐级放大法进行培养。先将小球藻藻种与BG-11培养基按照体积比1:5培养两周,然后将所得藻液与BG-11培养基按照体积比1:5再培养两周,最后将所得全部藻液与BG-11继续按照体积比1:5进行培养。在第三次放大培养后,每24 h测量一次小球藻藻液浊度、540 nm吸光度与细胞计数。整个培养过程在赛福PGX-350B智能培养箱中进行,温度为25℃,光照度为 5 000 lx,光暗时间各 12 h。
1.4 小球藻的破碎
取200 mL藻液置于超声波细胞粉碎机中,将探头深入液面以下5 cm进行破碎。超声破碎条件为:破碎时间为5 s,间歇时间为5 s,两者交替进行。在超声功率分别为360、540、720、1 080 W 时,分别进行 5、10、30、60 min 的破碎。
1.5 小球藻的扫描电镜观察
先将小球藻藻液置于真空冷冻干燥箱中在- 28 ℃ 冷冻 4 h,再真空干燥 72 h,然后利用日立S4800扫描电镜观察其结构。
1.6 数据分析
细胞计数法、吸光度法和浊度法的数据处理:取未被超声破碎前的初始值为xi,实验中所测到的最小值为xmin(对应最高的破碎水平)。细胞计数法的最小值取零,吸光度法和浊度法则取被检测到所有数据中的最小值。时间t时浊度法、吸光度法和细胞计数法检测出的数据为xt,Xt则代表在该时间条件下细胞的破碎率[11],有

紫外分光光度法的数据处理:为了与其他检测方法进行对比,以ymax代表溶液内检测出的有机物的最大值,yi代表超声破碎前的初始有机物的浓度,yt代表时间t时溶液内检测出的有机物的浓度[11],则有

2 结果与讨论
2.1 小球藻生长曲线

图1 三种方法检测得到的小球藻生长曲线Fig.1 Growth curves of Chlorella vulgaris detected by turbidity, 540 nm absorbance and cell counting
在进行超声波破碎前需对小球藻藻液进行培养。实验用藻种在恒温培养箱内进行培养,在最后一次扩大培养后开始检测,每隔24 h进行取样,分别测量其浊度、540 nm吸光度和细胞密度,结果如图1所示。从图中可看出,藻细胞密度随时间增加而增长,三种方法检测得到的生长曲线较为吻合,表明这三种方法均可较准确地测定溶液中完整的藻细胞密度。黄美玲等[17]证明藻液吸光度与单位体积下细胞数量存在良好的线性关系,光密度法能快速且较为精准地测定小球藻生物量。浊度法和吸光度法的测量结果标准偏差非常小。而细胞计数法由于是人工操作,产生了较大的标准偏差,但大都小于10%,说明该方法具有一定的可靠性。藻细胞密度经过30 d的培养达到 9.5 × 106个·mL-1,满足实验要求,可进行超声波破碎。
2.2 四种方法检测小球藻破碎情况
浊度法在此前被认为是一种较为粗略的检测小球藻破碎率的方法[11],其操作简便,且无需对超声破碎后的样品进行进一步处理,直接检测即可。
图2为浊度法,540、680 nm吸光度法,细胞计数法和紫外分光光度法检测的小球藻破碎情况。在超声功率为360 W时,浊度法、540 nm吸光度法、细胞计数法和紫外分光光度法的检测结果呈现同样的规律,溶液内的细胞破碎率均随着超声破碎时间的增加而增加。除了680 nm吸光度法检测到的破碎率在30 min时略有下降外,总体来说四种方法检测出的结果变化趋势一致。由于藻液总体破碎率低,在60 min时,细胞计数法所测得的细胞破碎率为18.3%,溶液内的细胞碎片没有大幅增多,细胞内流出物较少,与原始藻液相比,溶液内的小球藻密度、体积及形态变化较小。同时也说明,这四种方法在低功率破碎时,虽难以测出具体破碎率,但破碎趋势具有一定的规律性。而在超声功率分别为540、720和1 080 W时,浊度法检测出的溶液内细胞破碎率随着时间的增加呈先上升后下降的趋势。究其原因,可能是藻液在中高功率超声破碎下,溶液内的细胞碎片大大增加,又因水的浊度不仅与水中存在的颗粒物含量有关,而且和其粒径、形状、颗粒表面对光散射特性都有密切关系[14]。所以,藻液内大量的细胞碎片可能会干扰所测浊度数据。随着细胞碎片的大幅增多,检测出的溶液内细胞破碎率反而减小。综上所述,在超声功率大于540 W时,浊度法检测小球藻破碎率的结果存在一定的不确定性。
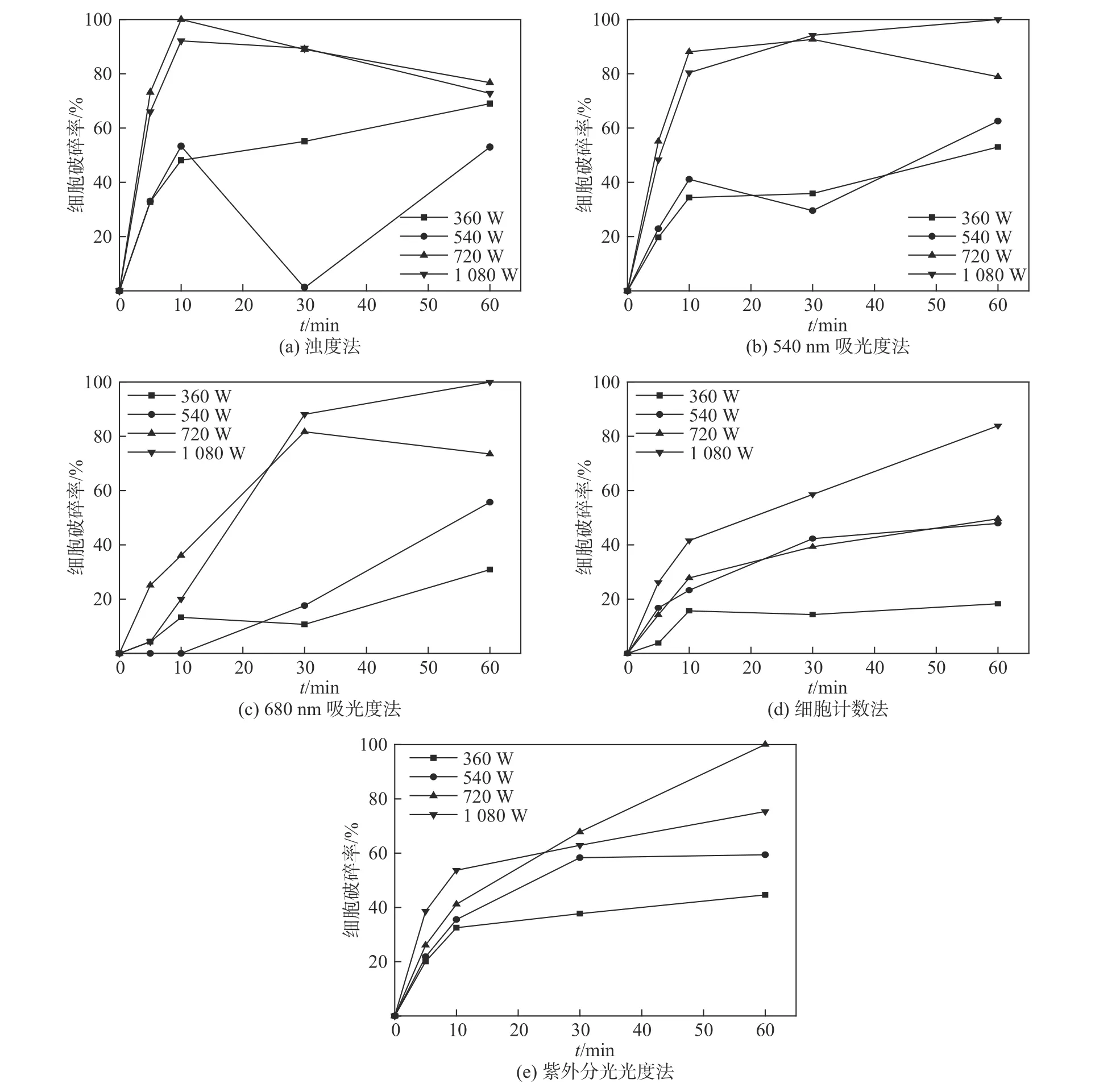
图2 浊度法、540 nm/680 nm吸光度法、细胞计数法和紫外分光光度法检测的小球藻破碎情况Fig.2 Cell rupture of chlorella vulgaris detected by turbidity, 540 nm/680 nm absorbance, cell counting and UV absorbance
540、680 nm吸光度法和紫外分光光度法都属于光密度法,通过测定细胞悬液或溶液的吸光值来间接测定生物量,具有快速、简便的特点,但细胞的形态、组分及光学性质的变化可能会导致误差的产生[18]。经过超声波破碎后,小球藻内的物质由细胞内流入周围溶液中,由于超声波破碎过程中易产生局部高温现象,造成热敏性活性物质失活[19],从而导致流出物的物理或化学性质发生改变,而不同物质的吸收光谱不同。由图2(b)、(c)对比看出,680 nm 吸光度法稍优于540 nm吸光度法,说明680 nm吸光度法在间接检测小球藻破碎率上具有较高的准确性。
国内外学者在检测小球藻密度时多使用细胞计数法[20-22]。当前应用比较广泛、操作比较方便的细胞计数法是细胞仪计数[22],但其无法对细胞的结构和形态学特征进行研究[23],也无法确定环境中的样品是完整细胞还是细胞碎片。所以本文采用细胞计数板在光学显微镜下对小球藻进行人工直接计数[15]。
从图2(d)中可看出,在同一超声功率时,溶液内的细胞破碎率随时间增加逐步递增,而在同一时间下,除了超声功率在540、720 W时,两者破碎率较为接近外,溶液内总体细胞破碎率随着功率的增大逐步递增。在超声功率为360 W时,从10 min至60 min,细胞计数法检测出小球藻破碎率由15.7%增至18.3%,而在超声功率为 1 080 W 时,从 5 min 至 60 min,细胞破碎率由26.2%增至83.9%。这说明功率是影响破碎率的重要因素之一。分析认为,超声功率为540、720 W时破碎率接近是因为两者功率相差不大,且细胞计数法具有一定的误差性,所以可以认为细胞计数法是一种检测小球藻细胞破碎率较为可靠的方法。
紫外分光光度作为有机物的替代指标,两者之间具有良好的线性关系[16]。从图2(d)、(e)的对比可看出,紫外分光光度法和细胞计数法的检测结果具有非常相似的逐步递增趋势,呈现出同样的规律,但两者检测出的细胞破碎率不一致,所以,紫外分光光度法检测小球藻破碎率虽较为理想,却无法检测出具体破碎率。鉴于紫外分光光度法比细胞计数法更为简便与快捷,因此对测量小球藻破碎率具有一定的可参考价值。
2.3 三种检测方法与细胞计数法的对比分析
图3给出了三种检测方法与细胞计数法的对比。图中,点[0,0]代表未破碎的悬浮藻液,[1,1]代表完全破碎后的藻液。因为细胞计数法是能直接、可靠测量出小球藻破碎率的方法,为了进一步分析浊度法、紫外分光光度法与吸光度法检测结果作为细胞破碎率指标的一致性,将标准化后的数据与细胞计数法结果在图3中绘出[11]。图3显示,680 nm吸光度法测得的数据大致落在细胞计数线的两侧,尤其是在破碎率较低时,两者十分接近。这说明680 nm吸光度法所表征出的破碎率遵循和细胞计数法的相似的规律。540 nm吸光度法测得的数据在低破碎率时均匀地分布于直线上方,与细胞计数法保持一定的相似性。但在中高破碎率时,两者相差较大,无明显规律。浊度法用来检测小球藻破碎率数据不佳,由于超声波破碎后,溶液内增加了大量的细胞碎片,检测出的细胞破碎率均偏大。紫外分光光度法检测出的细胞破碎率均分布于细胞计数直线上方,与直线保持一致的趋势,说明紫外分光光度法测出的具体破碎率普遍大于细胞计数法测出的。所以需谨慎运用紫外分光光度法检测小球藻的破碎率。
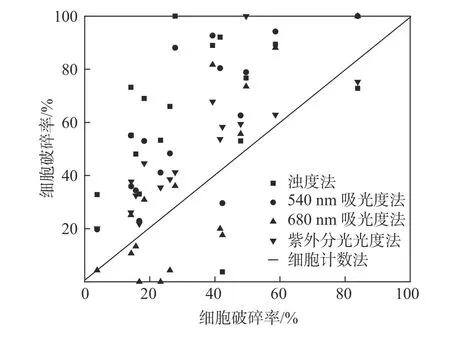
图3 三种检测方法与细胞计数法的对比Fig.3 Comparison among the turbidity, 540 nm/680 nm absorbance, UV absorbance and cell counting for cell rupture detection of Chlorella vulgaris
2.4 不同破碎条件下扫描电镜图片分析
为了进一步了解超声波的破碎机理,实验选取了未经破碎处理,破碎超声功率为1 080 W、破碎时间分别为5、60 min的小球藻,用扫描电镜观察其微观结构。图4为超声波破碎小球藻细胞的电镜图片。从图中可看出,未经超声波破碎处理的小球藻表面光滑平整,呈球形结构。超声功率为 1 080 W,破碎时间为 5 min 的小球藻颗粒边缘出现很多细裂纹,而破碎时间为60 min的小球藻颗粒表面凹凸不平,出现非常多的褶皱,且细胞中间出现空洞。
超声波是一种弹性机械振动波,它能产生强烈的空化效应、高加速度、击碎和搅拌作用等多种效应,使提取介质中的微小气泡压缩、爆裂,加速溶剂穿透,从而使藻细胞壁破碎,加速有效物质的溶出[24]。在相同超声功率下,破碎5 min的小球藻细胞壁被空化汽泡击出裂纹,细胞壁的致密结构遭到破坏,而破碎60 min时,小球藻的细胞壁被空化气泡击碎,出现空洞,细胞内的有效物质溶出,且细胞表面由于空化气泡的来回撞击,产生变形,呈现出图4所示的结构。

图4 超声波破碎小球藻细胞的电镜图片Fig.4 SEM pictures of Chlorella vulgaris ruptured by ultrasonic
3 结 论
本文比较了四种检测小球藻破碎率的方法,为定量检测超声波法破碎小球藻的破碎率提供了依据。细胞计数法无论是测定小球藻破碎趋势,还是测定其破碎率,都是较为理想的检测方法。紫外分光光度法与细胞计数法的检测结果高度一致,可以大致推测小球藻的破碎情况,但难以得到具体的破碎率。680 nm吸光度法在同一超声功率时,随着时间的增加,检测结果具有一定的规律,在检测小球藻破碎率时具有一定的参考性。在较大功率的超声波破碎下,浊度法用于检测小球藻破碎率存在一定的不确定性。通过扫描电镜可观察到,超声波通过空化汽泡击穿小球藻细胞壁,形成空洞,使有效物质溶出,并使细胞表面产生变形。
