改性蛋壳材料对重金属离子的去除机理研究
2019-03-25刘宁莉徐苏云
闫 佳,颜 宁,赵 越,刘宁莉,徐苏云
(上海理工大学 环境与建筑学院,上海 200093)
我国作为人口大国,每年的禽蛋产量在2 500万t左右,占世界总量的45%,全国每年丢弃的蛋壳约为40万t。大量废弃的蛋壳直接进入填埋场,既污染环境,又是对资源的浪费[1-2]。研究[3]发现,蛋壳由碳酸钙(占蛋壳质量的93%)、碳酸镁(~1%)、磷酸钙和磷酸镁(~2.8%)及有机物(~3.2%)组成,是一种生物矿化的产物,可以开发利用,提高其附加值。近年来,国内外越来越多的研究者发现,对蛋壳进行研磨、煅烧、改性等处理制备的吸附材料,既能用于去除水环境中的重金属Pb2+、As5+、Cd2+等[4-5]以及有机污染物如染料[6],又可用于污染土壤的修复[7]。
然而通过比较文献发现,以蛋壳为原料采用不同处理方法制备的材料,对重金属的去除效果差异显著。例如:谢越等[8]直接利用破碎后的蛋壳废料吸附水体中的Cr(VI),其饱和吸附量仅为 0.091 7 mg·g-1;而刘明星等[9]利用蛋壳原料合成的碳化羟基磷灰石,对Cr(VI)饱和吸附量可提升至 29.85 mg·g-1;Liao 等[10]利用蛋壳制备的碳化羟基磷灰石对Pb2+的饱和吸附量为94.3 mg·g-1,而 Kaplan 等[11]在 900 ℃ 高温处理蛋壳后直接将其用于吸附能量饮料中的Pb2+,饱和吸附量可高达923 mg·g-1。材料中的有效成分羟基磷灰石(HAp),既可通过离子交换以Ca2+置换Pb2+、Cd2+等,又可通过表面络合作用捕获重金属离子,而后者作用会受到溶液pH的影响[12]。
本研究以废弃蛋壳为原料,对比采用微波法和铁改性法制备的材料的表面性质,并将其用于去除水中Cu2+、Cd2+、Pb2+三种重金属离子,探究pH、吸附剂投加量等对重金属离子去除率的影响,以期为此类材料的制备和应用提供理论依据。
1 实验部分
1.1 试剂与仪器
药 品 CuSO4、CdCl2、Pb(NO3)2、NaOH、CaHPO4、FeSO4:分析纯,购自国药集团化学试剂有限公司。实验主要仪器有L400-P3型真空抽滤机(上海领德仪器有限公司)、BSA124S型电子分析天平(赛多利斯科学仪器有限公司)、DHG-9145A型电热鼓风干燥箱(上海一恒科学仪器有限公司)、85-2A型恒温磁力搅拌器(金坛市城东新瑞仪器厂)、Multi 3430型pH计(德国 WTW)、Optima 8000型 ICP-OES(PE China)、3H-2000 PS4型 BET 测试仪(贝世德仪器有限公司)、D8 ADVANCE型X-射线衍射仪(德国 Bruker)、VEGA3 型扫描电镜(TESCAN)、BSA124S型马弗炉(赛多利斯科学仪器有限公司)。
1.2 材料制备
将在学校食堂收集到的蛋壳放入自来水中浸泡数小时,洗去蛋壳表面的泥土、蛋液等杂质,加入少量的氢氧化钠浸泡30 min,待壳膜分离后,将去膜后的蛋壳烘干、备用。
1.2.1 微波法处理蛋壳材料(ME)
将蛋壳置于马弗炉中,并升温至500 ℃煅烧3 h,继续升温至 900 ℃,保持 3 h,随后冷却至室温。煅烧后的蛋壳和CaHPO4·2H2O按钙磷摩尔比1.67∶1进行混合。将混合物放入研钵中研磨均匀,加入适量蒸馏水,80 ℃水浴加热,恒温磁力搅拌90 min。产物经过洗涤、抽滤后再进行微波辐射,高火反应15 min后放入105 ℃干燥箱中烘干,将烘干后的样品研磨成粉末,过100目筛,装袋备用。
1.2.2 铁改性复合材料(FE)
分别取0.6 mol·L-1氨水与0.3 mol·L-1FeSO4溶液200 mL,将氨水缓慢加入到FeSO4溶液中并充分搅拌,继续向其中缓慢加入100 mL 1 mol·L-1H2O2溶液,溶液中有黑色沉淀生成,沉淀物用蒸馏水洗涤、抽滤后放入105 ℃干燥箱中烘干,研磨成粉末。上述固体粉末与ME样品按质量比1:1混合,加入50 mL蒸馏水,充分搅拌,80 ℃水浴加热,恒温磁力搅拌90 min,产物经过抽滤后放入105 ℃干燥箱中烘干,研磨成粉末,过100目筛,装袋备用。
1.3 吸附实验
利用硫酸铜、氯化镉和硝酸铅分别配制一定浓度的重金属模拟水样。取100 mL重金属溶液于250 mL锥形瓶中,加入一定量的吸附材料,分别探究各因素(反应时间、吸附剂投加量、重金属离子初始质量浓度、溶液pH)对实验的影响。搅拌一定时间后,取反应上清液,用0.45 μm滤膜过滤。测量溶液中残留的重金属质量浓度,按照式(1)、(2)计算出相应的重金属去除率RH及材料的平衡吸附量qe,从而确定最佳吸附条件。所有的吸附实验均在常温(25 ℃)下进行。
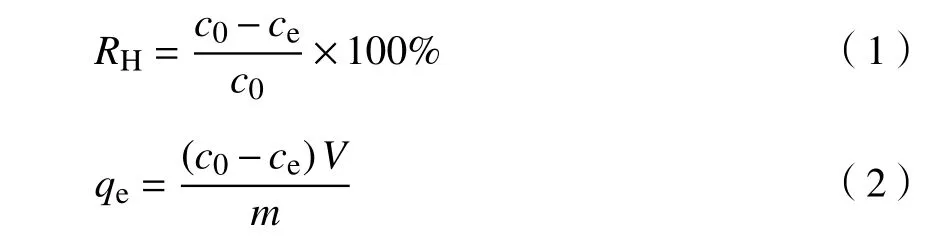
式中:c0、ce分别为重金属离子初始质量浓度、吸附后平衡质量浓度,mg·L-1;V为溶液体积,L;m为吸附剂用量,g。
2 实验结果与讨论
2.1 制备材料的图谱表征
ME和FE分别采用扫描电镜和X射线衍射(XRD)表征,结果分别如图1、2所示。由图1中可见:ME表面附有大量的细小颗粒,比较粗糙,这为材料吸附重金属离子提供了良好的场所;而FE表面有大量针状结构,表面凹凸不平,这对于吸附重金属离子有较大的优势。经测定,FE 的比表面积为 125 m2·g-1,孔径为3.42 nm,说明制备过程中掺入的铁元素降低了材料粒子之间的团聚能力,使其结晶度下降,材料的分散性良好。与未掺入铁元素的ME相比,其比表面积明显增大,这增加了材料表面的吸附位点,因此更有利于该材料对重金属离子的吸附与离子交换。

图1 ME 和 FE 扫描电镜图谱Fig.1 Scanning electron microscopy pictures of ME and FE
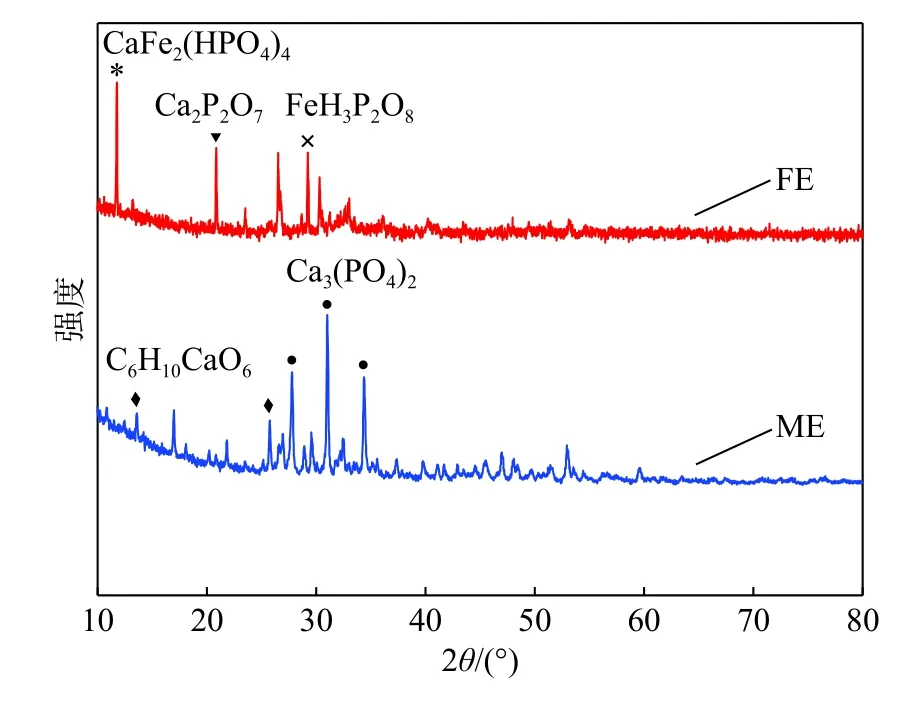
图2 ME 和 FE XRD 图谱Fig.2 XRD patterns of ME and FE
由XRD图谱分析可知,ME的主要成分有Ca3(PO4)2、C6H10CaO6;FE的主要成分包括CaFe2(HPO4)4、FeH3P2O8、Ca2P2O7。其中Ca、P是鸡蛋壳与CaHPO4混合煅烧后的主要成分,而Fe的存在表明制备过程中添加的硫酸亚铁试剂中的Fe以某种形态附着在蛋壳表面,其中较大的可能性为水合氧化铁。
2.2 ME 对重金属离子的去除效果
考察了吸附反应时间、ME投加量和溶液初始pH对重金属离子的去除效果,结果如图3所示。由图3(a)中可见:当c0= 50 mg·L-1时,Cu2+、Cd2+、Pb2+的去除率均在大约 20 min 后接近反应平衡;ME对Cu2+、Cd2+的去除效果最佳,去除率接近100%,而对Pb2+的去除率为90%左右;随着ME投加量的增加,ME对三种重金属离子的去除率均随之增大。图3(b)中显示,当ME投加量达到0.6 g·L-1时,对重金属离子的去除率均在90%以上,此后继续增加投加量,重金属离子的去除率增加不明显,因此,ME的最佳投加量可控制在0.6 g·L-1。计算得到ME对Cu2+、Cd2+、Pb2+的饱和吸附量分别为179、252、286 mg·g-1。
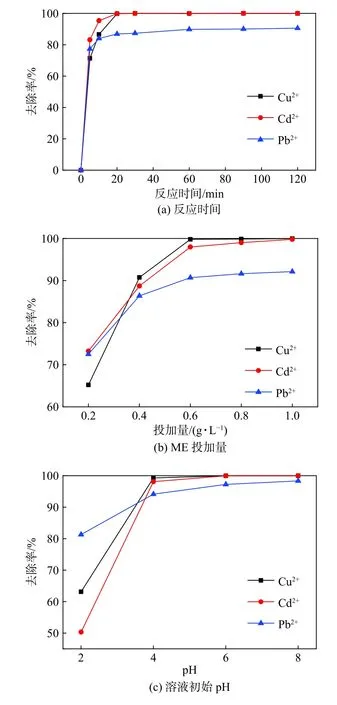
图3 反应时间、ME 投加量、溶液初始 pH 对 ME吸附重金属效率的影响Fig.3 Effects of reaction time, ME dosage and initial pH on the adsorption of heavy metals by ME
三种重金属在碱性条件下都将产生氢氧化物沉淀,因此pH定在2~8之间。由图3(c)中可见,在pH = 2的强酸性条件下,重金属离子的去除率较低,为50%~80%;当pH升至4,在弱酸条件下,重金属离子的去除率迅速升高,均达到90%以上;之后再继续升高pH,重金属离子的去除率几乎保持不变。该结果与Liao等[10]和 Yasukawa等[13]研究结果相似,Pb2+等离子可在羟基磷灰石表面通过络合去除。而在强酸(pH = 2~3)条件下,羟基磷灰石表面正电荷离子如≡CaOH2+和≡POH0增加,阻碍了重金属离子在羟基磷灰石表面的络合固定。
为了进一步探究pH对ME吸附重金属效率的影响机理,关注反应后溶液的pH变化以及材料表面的沉积物,此处以Cu2+为例展开讨论。反应前 ME 的质量浓度为 0.6 mg·L-1、pH = 6,改变溶液中Cu2+初始质量浓度,结果如图4所示。从图中可见,反应后溶液pH与Cu2+初始质量浓度有关:当Cu2+初始质量浓度较低时,反应后溶液pH变化幅度大,反应结束时pH为9~11;而当Cu2+初始质量浓度升高时,pH变化幅度小,反应后溶液pH维持在6附近。因此,推断ME进入溶液后会缓慢释放出碱度,在该碱性pH条件下,部分Cu2+以Cu(OH)2沉淀的形式从溶液中去除并附着在吸附材料表面。图5为反应后ME表面的XRD图谱,结果显示,反应后材料表面既有Cu2P2O7等结合物,又有Cu(OH)2沉积。而由于ME投加量一定,所能提供的碱度也一定。当重金属离子初始质量浓度较低时,吸附结束后溶液中的碱度仍有富余,而当重金属离子初始质量浓度达到某一限值时,由于生成大量的Cu(OH)2沉淀,溶液中碱度被耗尽,反应后溶液pH仍保持在5~6。笔者对上述实验数据进行了吸附模型模拟,Langmuir和Freundlich吸附模型的拟合度均不佳,间接印证了吸附过程中化学沉淀与络合吸附的共存机制。

图4 不同 Cu2+质量浓度溶液吸附反应后的 pH 和去除率Fig.4 Solution pH and removal efficiency after adsorption with different initial Cu2+concentrations

图5 吸附后 ME 表面的 XRD 图谱Fig.5 XRD pattern of ME after adsorption
2.3 FE 对重金属离子的去除率及影响因子
2.3.1 FE 对三种重金属离子的去除率
考察了吸附反应时间对重金属离子的去除率。当重金属离子初始质量浓度为50 mg·L-1、pH在6~7之间、FE投加量为0.6 g·L-1时,分别在不同时间测定溶液中残留重金属离子质量浓度,结果如图6所示。由图中可见:FE对Cu2+、Cd2+的吸附效果较差,反应120 min后,去除率均低于20%;FE对Pb2+的去除率较高,并在60 min左右达到平衡,对Pb2+的去除率达到99.89%。因此,该材料的吸附反应时间取60 min为宜。
2.3.2 FE 吸附去除 Pb2+的影响因子
图7为FE投加量、Pb2+初始质量浓度、溶液pH对FE吸附Pb2+及去除率的影响。由图7(a)中可知,随着FE投加量的逐渐增加,Pb2+的去除率显著提高。当FE投加量增加至0.6 mg·L-1时,Pb2+的去除率接近100%。本实验选取的最佳吸附剂用量为0.6 mg·L-1。由图7(b)中可知,当Pb2+初始质量浓度在50 mg·L-1以下时,该材料对Pb2+的吸附效果较好,去除率接近100%;当 Pb2+初始质量浓度达到 100 mg·L-1时,去除率降低至80%,之后随着Pb2+初始质量浓度的增加,去除率显著降低。

图6 FE对三种重金属离子的去除率随时间的变化Fig.6 Changes of removal efficiency for Cu2+, Cd2+ and Pb2+ with the reaction time
Freundlich方程是一个经验公式,是反映多层吸附的经典方程;Langmuir等温式是从动力学观点出发,通过一些假设推导出的单分子层吸附公式,它表示吸附剂表面是均匀的,各个点位的吸附能相同,且被吸附物之间互不影响,适于解释化学吸附的情况。将上述实验结果分别用Freundlich和Langmuir等温吸附线进行拟合,结果见式(3)、(4),其中R为相关系数。发现Langmuir等温吸附线的拟合度更好,间接说明该吸附反应是以单分子层为主的化学吸附。经计算得到:FE 对Pb2+的饱和吸附量为87.23 mg·g-1。文献[6]中碳化羟基磷灰石对Pb2+的饱和吸附量为 94.3 mg·g-1[6],文献[13]中钙化羟基磷灰石的饱和吸附量为85 mg·g-1,与本文所制备的铁改性蛋壳材料的吸附能力相近,但比较而言,铁改性法更简便。

由图7(c)中可知,在酸性环境中随着pH的增加,重金属离子的去除率和平衡吸附量均呈上升趋势:当pH = 4时,对重金属离子的去除率达到98%,继续增大pH,曲线缓慢上升;当pH = 6时,对重金属离子的去除率接近100%,之后再增加溶液pH,对重金属离子的去除率以及平衡吸附量均呈下降趋势。因此,利用该材料处理含铅废水的最佳pH应控制在5~6为宜。在吸附过程中,由于溶液pH变化导致Pb2+的存在形态、改性蛋壳表面电荷以及吸附位点均发生改变[14],从而影响材料对Pb2+的去除率及平衡吸附量。FE对Pb2+的吸附主要有两种方式,一种是Pb2+与改性蛋壳表面的Ca2+发生离子交换而被吸附,另一种是通过表面络合作用而被吸附。
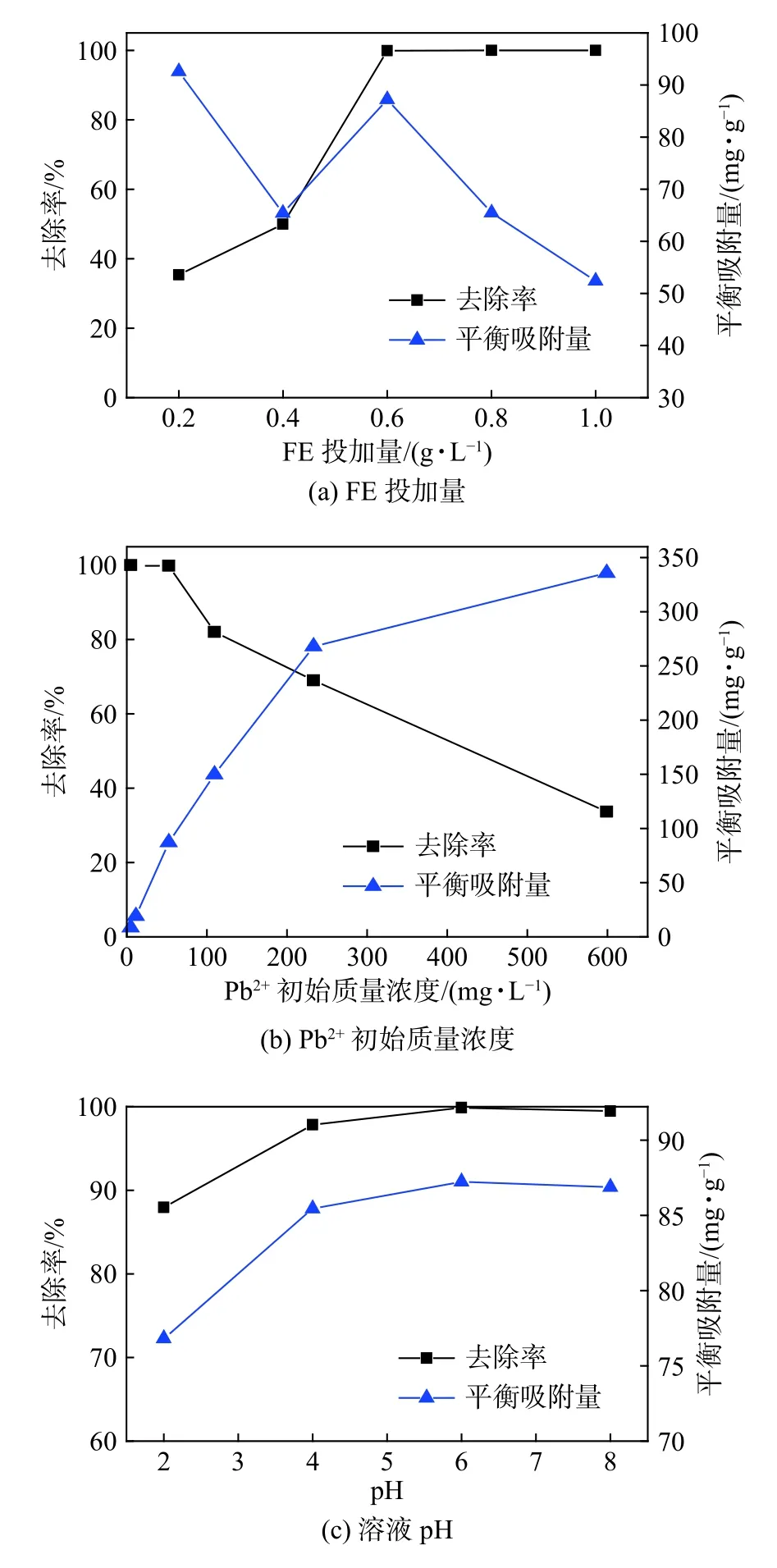
图7 FE 投加量、Pb2+初始质量浓度、溶液 pH 对FE吸附Pb2+及去除率的影响Fig.7 Effect of FE dosage, initial Pb2+ concentration and solution pH on Pb2+ and removal efficiency adsorption by FE
离子交换:
Ca10(PO4)6(OH)2+14H+→10Ca2++6H2PO-4+2H2O
10Pb2++6H2PO-4+2H2O→14H++Pb10(PO4)6(OH)2
表面络合:
HAp-OH+Pb2+→HAp-O-Pb++H+
2HAp-OH+Pb2+→(HAp-O)2-Pb+2H+
在强酸性条件下,溶液中含有大量的H+,这些H+占据改性蛋壳表面的吸附位点,使得蛋壳表面正电荷增加,抑制了金属阳离子的吸附和表面络合,从而导致其去除率降低。随着pH增加,溶液中H+浓度降低,改性蛋壳表面正电荷减少,有利于吸附金属阳离子,Pb2+的去除率和平衡吸附量随之升高;继续增加溶液的pH,Pb2+发生水解,部分Pb2+被Pb2(OH)3+和Pb(OH)2取代[15],影响了溶液中Pb2+的表面络合和离子交换反应的发生,从而导致Pb2+的去除率和平衡吸附量均呈下降趋势。FE在吸附重金属后,溶液中铁离子含量甚微。该吸附反应未有铁离子等析出,出水水质较好,说明该吸附反应中铁离子始终以水合氧化铁的形式存在,未参加反应。
3 结 论
本研究分别采用微波法、铁改性法对蛋壳原料进行处理得到两种材料ME和FE,其中:ME表面较为粗糙;FE表面有大量针状物质,比表面积更大。FE和ME的XRD图谱与羟基磷灰石的标准图谱部分重合,此外也有不同形态的Ca-P晶体。ME对Cu2+、Cd2+的去除率较高,在优化实验条件下对重金属离子的去除率均能达到98%以上。当pH > 4时,对重金属离子的去除率较高;在吸附完成后,溶液pH出现不同程度的上升,这可能与材料缓慢释放碱度有关。FE表面附着水合氧化铁等成分,有利于提升对Pb2+的去除率,FE 对 Pb2+饱和吸附量可达 87.23 mg·g-1。
