急性肺损伤模型制作及不同时间点伤情变化规律
2019-03-23孙剑会甘乐彬张安强文大林陈民佳陆红祥张华才蒋建新
胡 陈,孙剑会,甘乐彬,刘 迪,张安强,黄 宏,杜 娟,文大林,陈民佳,陆红祥,曾 灵,张华才,蒋建新
肺脏作为可行气体交换的器官,经常遭受外界环境中微生物和毒素的损伤[1]。受损伤肺脏需修复重建肺泡结构[2-3]。肺泡是机体气体交换的场所,同时也是肺脏呼吸系统的基本单位。肺泡主要由介导气体交换的扁平一型上皮细胞和分泌表面活性蛋白的立方二型上皮细胞构成[4]。极少数肺泡二型细胞具有肺泡干细胞的功能,目前肺泡二型细胞作为干细胞参与肺损伤修复的机制仍不清晰。其中肺泡一型上皮细胞占肺泡表面积>95%,有研究[5]表明一型上皮细胞在肺损伤后具有可塑性。急性肺损伤模型可模拟肺脏遭受损伤后的状态,为后续研究肺泡上皮细胞参与损伤修复提供良好条件[6]。该研究采用鼻饲法滴注脂多糖(lipopolysaccharides,LPS)直接对肺脏构成损伤,建立急性肺损伤动物模型,操作方法简便,对小鼠创伤小,并揭示肺损伤修复不同时间点的动态变化。
材料与方法
1 实验动物
10~12周龄C57BL/6雄鼠36只,体重23~26g,由北京中国科学院动物研究所[许可证号SYXK(京)2007-0004]提供。小鼠饲养1周左右以适应新环境,给予充足的饲料和饮水,按随机数字表法分为生理盐水组(6只)和LPS损伤组(30只),LPS损伤组又分为损伤后3d(LPS-d3)、5d(LPS-d5)、7d(LPS-d7)、9d(LPS-d9)、11d(LPS-d11)5组,每组6只小鼠。
2 主要试剂和仪器
手术器械(上海医疗器械,中国),移液器(200uL,Gilson,法国),注射器(1mL,上海金塔,中国),FES-2000B 电子秤(福州富日,中国),涡旋混匀仪(IKA,德国),倒置显微镜(Olympus公司),LPS(Lipopolysaccharides from Escherichia coli O55:B5,sigma,货号:L4005),肝素钠注射液(万邦医药,中国),戊巴比妥钠(上海医药,进口分装)。
3 实验方法
3.1鼻饲法滴注LPS建立急性肺损伤模型 小鼠腹腔注射60mg/kg 2%戊巴比妥钠溶液麻醉,麻醉深度为中度(昏迷但掐尾有反应);根据小鼠体重按10mg/kg的剂量,计算10mg/mL浓度的LPS的给药体积(总体积控制在30~50μL最佳);移液器精确吸取所需滴注液体的体积,右手拉住小鼠尾巴,左手拇指和食指抓住小鼠耳朵,控制住小鼠的头部,轻轻推移液器,枪头可见吸取的小液滴(约2μL/滴),轻轻靠向小鼠右鼻孔,左手立刻快速有力度的向上提30~40cm,再缓慢轻轻回到左手起始位置(小鼠始终保持鼻孔朝上),进行来回10次,然后同样的操作向小鼠左鼻孔滴加小液滴,左右鼻孔依次滴加,直至液体滴注完成,最后松开小鼠,将小鼠利用胶带固定于鼠板,腹部朝上、头部朝上倾斜的体位保持30min以上,待小鼠复苏,放回鼠笼饲养观察。
3.2小鼠肺大体改变、病理改变、病理评分 LPS滴注后,于3、5、7、9、11d各时间点进行肺组织取材,麻醉小鼠并肝素化后解剖小鼠,肉眼观察小鼠肺组织大体改变,并取0.3cm×0.3cm×0.5cm左肺组织进行苏木素-伊红染色(HE),光镜下观察肺组织病理结构的变化并对其进行病理评分[7]。
3.3小鼠肺组织肺指数(肺组织湿重/小鼠体重)的测定 LPS滴注后,于各个时间点进行测定,麻醉后电子天枰称取小鼠体重并记录,肝素化并解剖小鼠,游离肺组织,取右肺,滤纸吸干表面水分,电子天枰称取湿重,计算肺指数(肺组织湿重/小鼠体重)。
4 统计学分析
结 果
1 肺大体观察
LPS滴注3、5、7、9、11d后,与生理盐水组(图1a)相比,LPS-d3(图1b)左右肺均出现肺组织肝样变,区域占比为左肺面积40%~50%,右肺面积20%,该肝样变区域由肺门处往肺周边蔓延,具有明显的分界,肺边缘粉红色为正常肺组织;LPS-d5表现为双肺近肺门处肝样变出血,区域占比为左肺面积20%~30%,右肺面积10%~20%,比LPS-d3出血面积减小,出血部位的颜色稍减淡,提示伤后3~5d,肺损伤伤情表现为好转;LPS-d7双肺近肺门处有肝样变出血,出血区域占比为左肺面积<10%,右肺面积<5%,周围组织呈现正常的粉红色,与LPS-d5相比肺损伤区域面积显著缩小,且损伤区域颜色稍浅,肺损伤进一步修复;LPS-d9双肺块状肝样变出血基本消失,仅双肺肺门有红色块状充血;LPS-d11双肺未见明显出血改变,损伤恢复完全。
2 肺组织病理观察
生理盐水组,LPS组第3、5、7、9天可见肺泡腔炎性细胞浸润、肺泡间隔增厚、纤维蛋白渗出的典型病理表现(图2),且第3天炎性细胞渗出最严重,每个肺泡腔皆≥5个,第5、7、9天逐渐减少,第11天基本未见炎性细胞渗出;LPS损伤后第3天仅见少量纤维蛋白渗出,第5、7天可见肺泡腔内大量纤维蛋白渗出,第9天显著减少,第11天肺泡腔内基本未见纤维蛋白渗出。
3 肺组织病理评分及肺体指数变化
急性肺损伤后不同天数的肺体指数与生理盐水组相比,LPS-d3水肿最重(P<0.05),后逐渐减轻。肺组织病理评分在肺损伤后急剧升高,LPS-d3最高,后逐渐下降(LPS-d3、LPD-d5、LPS-d7与生理盐水组相比,P<0.05)(表1),伤情逐渐恢复。
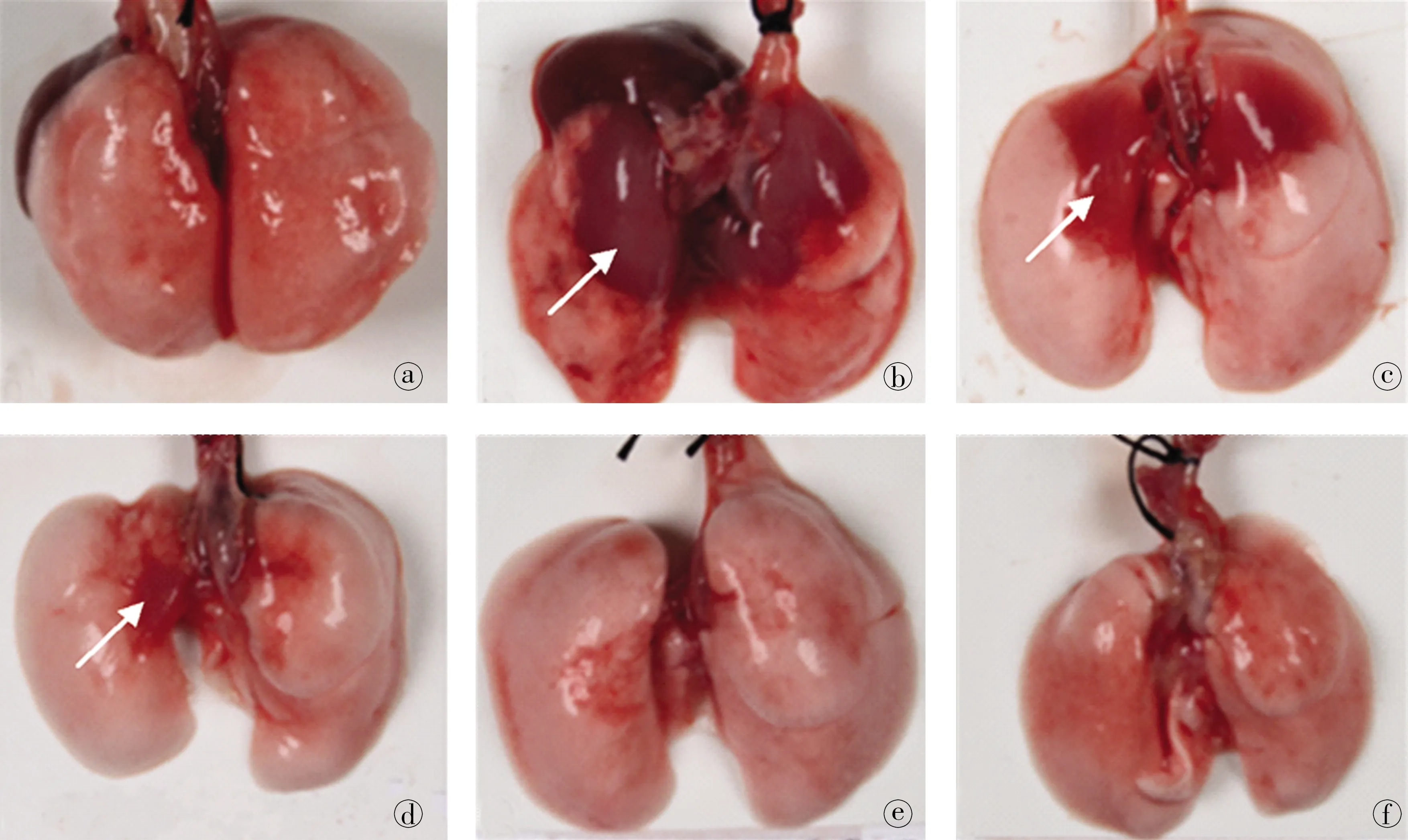
图1不同损伤天数肺大体观察图。a.生理盐水组;b~f分别对应LPS损伤后第3、5、7、9、11天。LPS损伤后第3天(b)伤情最重,表现为双肺肺门大面积出血(箭头所指),后损伤逐渐修复,出血面积逐渐缩小,在第9天(e)基本消失,第11天(f)恢复完全


图2不同损伤天数肺组织病理学改变。a.生理盐水组;b~f.分别对应LPS损伤后第3、5、7、9、11天。与生理盐水组相比,损伤后第3天伤情最重,主要表现为肺泡腔内大量炎症细胞渗出,第5、7天可见大量纤维蛋白渗出,第9天渗出逐渐减少,第11天基本恢复完全

表1 肺组织病理评分及肺体指数变化
讨 论
急性肺损伤模型的制作方法多,其中气管滴注是近年来开发的一种呼吸道给药方式,如何让造模操作简便、成本低廉、模型稳定且具有可重复性,一直未有最佳的解决方法。目前国内外气管滴注给药方式包括暴露式和非暴露式两种[8],暴露式主要指颈部切开直接暴露气管后注射器刺入给药,此种方法需要切开小鼠颈部皮肤,暴露气管,注射器刺入气管,对小鼠自身造成的创伤较大,且切开的皮肤易感染,影响LPS刺激后小鼠的炎症反应程度,易导致模型不稳定,可重复性差;非暴露式给药主要有经气管插管喷入法和鼻饲法滴入法,经气管插管喷入对操作技术要求较高,喷入仪器类别、喷入力度、速度、喷入插管的深度都直接影响肺部损伤程度,导致模型不稳定,且需配备小鼠专用喉镜、小鼠插管喷入专用仪器,成本较高。鼻饲法滴注给药方式,直接通过小鼠鼻孔滴注给药,利用重力,使药物经过气管,直达肺部,由于药物的刺激作用造成肺部损伤,无需有创暴露气管,对操作技术要求较低,无需配套实验专用仪器,操作简便,容易掌握,可重复性高,模型稳定。C57BL/6小鼠在肺组织发育、病理生理等方面与人类具有高度的同源性,且花费较为低廉,利用C57小鼠通过鼻饲法滴注LPS建立急性肺损伤模型,模型操作简便,实验具有一定的科学性和可行性。
LPS诱导的急性肺损伤模型伤情变化规律主要表现为损伤后第3天伤情最重,肺大体观察以双肺肺门处肝样变为主,颜色表现为深褐色,且与周围相对较为正常组织分界清楚,肺组织病理则表现为肺泡腔内大量炎症细胞渗出,以中性粒细胞为主,肺泡间隔增厚;第5、7天恢复,肝样变面积逐渐缩小、颜色逐渐变浅,肺组织病理表现为肺泡腔内炎症细胞显著减少,但肺泡腔内可见纤维蛋白渗出;第9、11天肺大体观未见肝样变表现,双肺肺门处呈现较为正常的粉色肺组织,肺组织病理表现为肺泡腔少量纤维蛋白渗出,未见炎症细胞渗出。此种损伤修复的变化规律特点是以炎症细胞渗出为主,肺泡间隔有增厚,但未见明显肺泡腔塌陷、上皮细胞脱落等征象[9]。该方法制作的急性肺损伤模型,伤情变化规律表现为LPS滴入后,出现急性肺损伤表现,肺泡水肿出血,损伤后第3天伤情至最重,后逐渐恢复,损伤后第11天基本恢复完全。
综上所述,利用操作简便、成本低廉的鼻饲法滴注LPS建立的急性肺损伤模型的伤情变化规律可为研究肺损伤修复提供重要实验基础。
