长期施氮对马铃薯田土壤剖面硝态氮积累及细菌群落结构的影响
2019-03-22张健董星晨张鹤邓德雷罗超越张春红邱慧珍
张健,董星晨,张鹤,邓德雷,罗超越,张春红,邱慧珍
(甘肃农业大学资源与环境学院,甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070)
地处甘肃省中部的定西市是我国重要的马铃薯种薯和商品薯生产及淀粉加工基地[1],有“中国马铃薯之乡”之称[2],是甘肃省最大的马铃薯主产区,马铃薯产业已成为带动农业和农村经济发展,促进农业增效、农民增收的战略性主导产业[3].然而农民为追求高产和高收益,在马铃薯种植过程中肥料投入、尤其是氮肥的投入量持续增加,盲目施肥现象十分严重[4].氮肥的过量投入,不仅没有达到预期的产量,反而降低了马铃薯块茎的品质、尤其是窖藏品质[1,3-4],更为重要的是,长期大量施氮在降低氮肥利用率的同时,导致土壤剖面中硝酸盐富集,造成严重的资源浪费以及环境污染[5-6],并且显著影响了土壤细菌的群落结构和多样性[7-10].土壤细菌作为主导农田土壤微生物的主要类群,可以敏感响应土壤养分含量及土壤肥力的变化.本研究设置长期定位试验研究,运用传统的土壤农化分析方法结合克隆测序以及实时荧光定量PCR等分子生态学研究手段,探讨连续4 a施氮对旱地马铃薯田土壤剖面中硝态氮的积累以及细菌群落结构的影响,旨在探明长期连续施氮对土壤剖面硝态氮含量的影响以及细菌群落结构和多样性对不同施氮量的响应机制.
1 材料与方法
1.1 试验区概况
田间定位试验始于2013年4月,试验地位于甘肃省定西市安定区香泉镇(N 35°27′7″,E 104°30′34″),海拔2 053~2 556 m,年均温度6.9 ℃,年降水量400 mm左右,多集中在7~9月.无霜期140 d,80%保证率≥10 ℃的积温为2 075.1 ℃,蒸发量1 400 mm以上,属中温带半干旱气候.
1.2 试验设计
田间试验设置6个不同施氮处理:N0对照;N75(施氮量75 kg/hm2);N150(施氮量150 kg/hm2);N225(施氮量225 kg/hm2);N300(施氮量300 kg/hm2);N375(施氮量375 kg/hm2).每个处理4次重复,随机区组排列,小区面积7.2×9=64.8 m2,采用宽垄双行覆膜种植模式,垄宽1.2 m,垄间距0.4 m,行距0.6 m,株距0.2 m,种植密度为8.34×104株/hm2.
每个处理肥底一致,施磷量:P2O5225 kg/hm2,施钾量:K2O 292.5 kg/hm2.N肥为尿素(N,46%),P肥为过磷酸钙(P2O5,16%),钾肥为硫酸钾镁(K2O,24%).
供试品种为马铃薯‘青薯九号’.田间试验于2016年5月1日播种,10月9日收获.按照当地常规方法进行田间管理.
1.3 土壤样品采集
在马铃薯收获期采集0~20、20~40、40~60、60~80、80~100 cm土壤样品,测定不同土层土壤硝态氮含量.同时,对0~20 cm表层土壤采用克隆测序以及实时定量PCR方法测定细菌的群落组成和结构.
1.4 测定指标及方法
土壤NO3--N和NH4+-N含量的测定:0.01 mol/L CaCl2溶液浸提,震荡1h,用流动分析仪测定.
土壤pH测定:水土比为5∶1,用pH计测定.
土壤有机质的测定:重铬酸钾外加热法.
DNA提取:利用Fast DNA Spin Kit for Soil试剂盒(MP Biomedicals,Santa Ana,CA,USA),按照其说明书中的步骤提取土壤总DNA.DNA提取后,分别采用微量紫外分光光度计(Nanodrop ND-1000 UV-Vis)测定土壤DNA的浓度和纯度(D260/D280和D260/D230).之后将其稀释10倍用于PCR模板.

实时荧光定量PCR:采用Bio-Rad CFX96 Optical Real-Time PCR System(Bio-Rad,Hercules,CA,USA)扩增仪进行实时荧光定量PCR分析.标线取自基因代表性克隆重组质粒的10倍稀释样,稀释梯度6到8个,空白样品的模板为水.然后根据标准曲线的浓度计算出样品中的基因拷贝数,最后以每克干土中的基因拷贝数为单位进行分析,每个样品3次重复.
定量PCR的反应体系为20 μL,包括1 μL DNA模板、10 μL SYBRPremixExTaq(TaKaRa,Dalian,China),正向和反向引物分别为0.25 μL(10 μmol/L)和8.5 μL的灭菌双蒸水.优化后的PCR程序如表1.
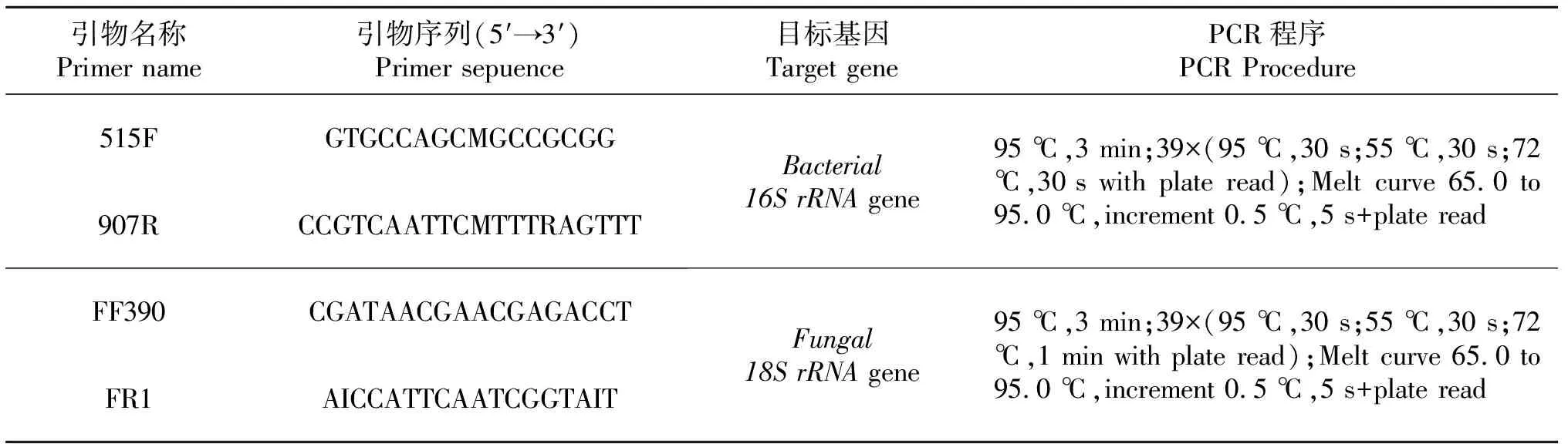
表1 本研究所用的引物和条件
2 结果与分析
2.1 长期施氮对土壤剖面中硝态氮NO3--N含量的影响
马铃薯收获期土壤剖面各土层中NO3--N含量的测定结果如表2所示:连续4 a施氮,导致0~100 cm内土壤剖面中NO3--N含量随着施氮量增加显著增加(P<0.05),尤其在0~20 cm土壤样品中,各处理土壤NO3--N含量分别为4.3、6.7、9.2、11.3、20.0、46.8 mg/kg,各施氮处理的NO3--N含量分别比对照N0增加了55.8%、113.9%、162.8%、365.1%和988.4%.;在各土壤剖面内NO3--N含量也不相同,随着土壤剖面深度增加,其
含量逐渐降低.
2.2 长期施氮对表层土壤理化性质的影响
连续5 a不同施氮量,随着施氮量增加,土壤pH表现为先增加后降低的趋势,在N75处理中达到最大值为8.36,在N375处理达到最低8.02,与N0相比降低了0.26,说明长期过量施氮会造成土壤pH降低.NH4+-N的含量并未随着施氮量增加而出现有规律的变化.通过对土壤OM含量的测定结果分析发现,各处理土壤OM含量均未达到统计学差异水平,但是N150处理的土壤OM含量为18.15 g/kg,明显要高于其他处理.因此,在合理的施氮范围内,长期施氮可以增加土壤OM的含量.
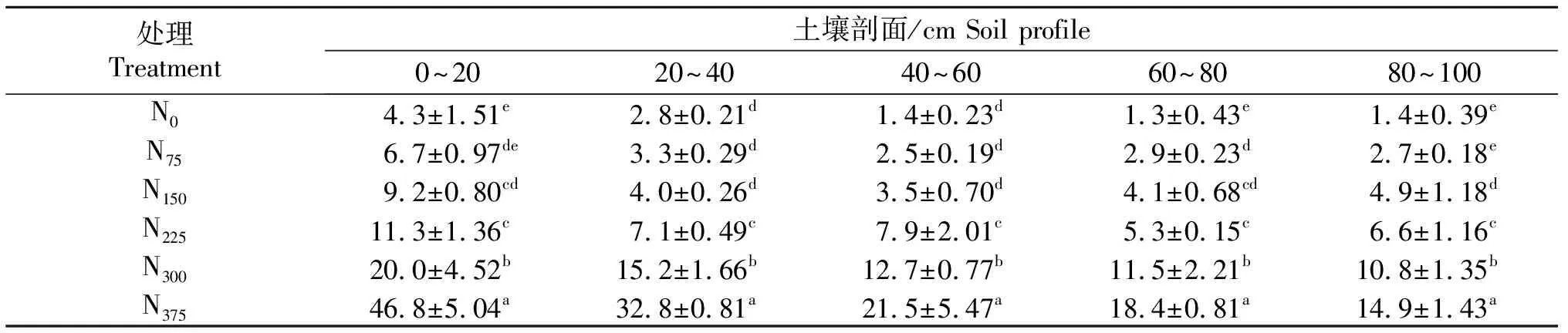
表2 不同施氮量土壤NO3--N含量

表3 不同施氮处理的部分表层土壤理化性质
2.3 长期施氮对细菌Alpha多样性的影响
根据高通量测序结果,表3中列出了各处理土壤样品中在相似性0.97条件下得到的Alpha多样性指数,其中OTU和Chao1指数是表征群落丰富度的指数,OTU越高,代表物种种类越多,Chao1值越大,物种丰度越高;Shannon和simpson指数是表征微生物多样性指数,shanon指数越大,物种多样性越高,simpson指数越大,物种多样性越低.随着施氮量增加,各处理仅在N375处理土壤样品中,shannon指数显著低于其他施氮处理,而simpson指数显著高于其他处理,虽然各处理OTU与Chao1指数虽没有显著性差异,但相比其他处理,N375处理的土壤样品OTU与Chao1值最低,这说明过量施氮可以降低细菌的多样性.
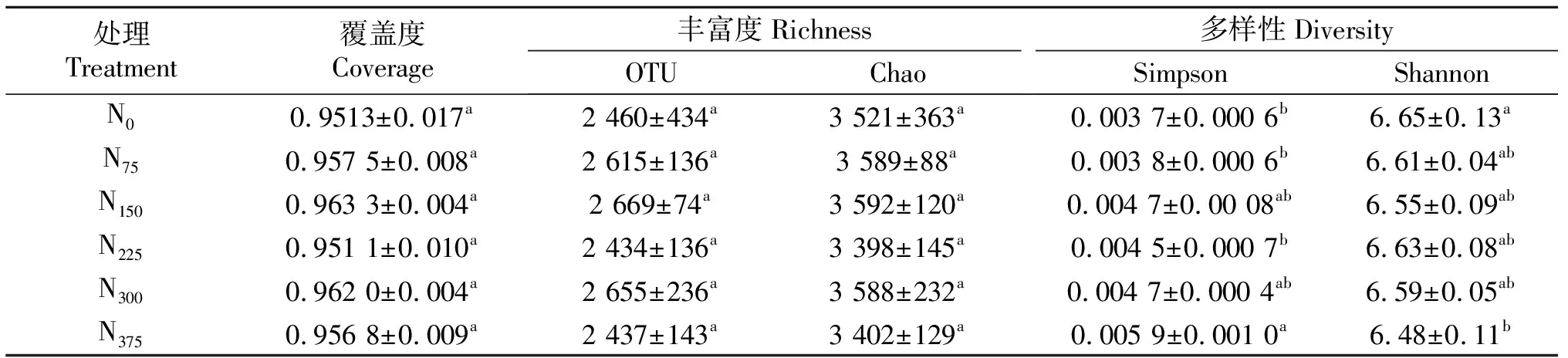
表4 不同施氮量处理的土壤细菌Alpha多样性指数
2.4 长期施氮对细菌群落组成的影响
2.4.1 长期施氮对土壤门水平细菌优势类群的影响 为分析长期连续施氮对土壤细菌群落结构的影响,利用meseq高通量测序及实时荧光定量PCR等微生物学研究方法对0~20 cm表层土壤细菌群落结构进行分析.结果如图1所示,在门水平上不同施氮处理土壤中排名前9的细菌优势类群中,Proteobacteria(变形菌门),Acidobacteria(酸杆菌门),Actinobacteria(放线菌门)有绝对的优势,在各处理中占60%左右.随着施氮量的增加各处理的门的绝对量发生了变化,在0~20 cm土样内Actinobacteria(放线菌门)和Bacteroidetes(拟杆菌门)的丰度显著提高,(Acidobacteria)酸杆菌门的丰度显著降低,相比于N0处理,各处理中Actinobacteria细菌数量增加6.1%~17.4%.Bacteroidetes中细菌数量增加了16.4%~46.8%.Acidobacteria中细菌数量减少7.8%~26.4%.
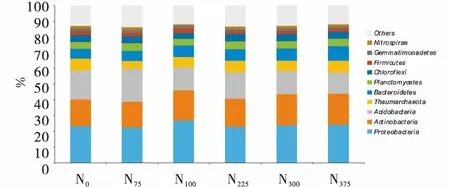
图1 不同施氮量处理土壤细菌优势门水平的分布特征Figure 1 Distribution characteristics of soil microorganisms at gate level under different nitrogen treatments
2.4.2 长期施氮对土壤优势纲细菌类群的影响 为了进一步分析长期施氮对土壤细菌群落结构的影响,对不同处理在纲水平上优势细菌类群进行统计分析,结果如图2所示,在纲水平上不同施氮处理土壤中前12个优势菌群中,放线菌门中的Actinobacter,酸杆菌门中的AcidobacterGp6以及变形菌纲中的Betaproteobacteria(β-变形菌纲)、Gammaproteobacteria(α-变形菌纲)和Alphaproteobacteria(α-变形菌纲)占绝对优势,在各处理中占总优势菌纲的40%左右.随着施氮量增加,拟杆菌门中的Bacteroidetesinceratesedis(拟杆菌纲)和Actinobacter(放线菌纲)细菌的丰度显著增加(P<0.05),与对照N0相比,随着施氮量增加,各处理拟杆菌纲细菌的丰度分别增加了33.8%、44.8%、83.3%、109.2%、173.3%.而AcidobacterGp4和Anaerolineae随着施氮量增加显著降低(P<0.05),较N0相比,随着施氮量增加,各处理AcidobacterGp4和Anaerolineae相对丰度分别降低16.3%~33.8%、8.1%~22.7%;Gemmatimonadetes(芽单胞菌纲)、AcidobacterGp6随着施氮量增加均呈现出先增加后将低的趋势,在各处理中的相对丰度分别为N0(1.48%,11.92%)、N75(1.80%,14.36%)、N150(1.43%,9.64%)、N225(1.45%,11.34%)、N300(1.50%,8.92%)、N375(1.19%,8.99%);AcidobacterGp6的丰度随着施氮量增加而逐渐降低,但各处理之间差异并不显著.

图2 不同施氮量处理优势纲水平的分布Figure 2 Distribution of dominant class levels under different nitrogen application rates
2.4.3 长期施氮对土壤细菌优势属类群的影响 对各处理中细菌的优势门和优势纲类群的群落组成分析发现,连续四年施氮显著影响了表层土壤细菌的群落结构,因此,对其进行深入研究发现,排名前12的优势属中,有6个优势属分别是Nocardioides(类诺卡氏菌属)、Gaiella、Arthrobacter(节杆菌属)、Streptomyces(链霉菌属)、Solirubrobacter(土壤红杆菌属)、Blastococcus等属于放线菌纲,2个优势属属Lysobacter(溶杆菌属)、Steroidobacter(甾杆菌属)属于变形菌门,Ohtaekwangia属于拟杆菌门,其中,大多数与硝化作用有关的微生物隶属于变形菌门[11],Nocardioides、Arthrobacter、Gemmatimonas中的大多数细菌已经被证实可以将硝酸盐还原为亚硝酸盐[12].而Ohtaekwangia是新发现的属属于拟杆菌门[13],而拟杆菌门中的细菌被证实与土壤反硝化作用有关[14].Gemmatimonas具有脱氮的功能[15].与N0处理相比,各施氮处理土壤中随着施氮量增加Ohtaekwangia、Streptomyces和Lysobacter的丰度显著增加,各处理中相对丰度为N0(1.19%,1.15%,0.93%)、N75(1.59%,1.01%,0.95%)、N150(1.72%,2.76%,1.26%)、N225(2.18%,1.23%,1.27%)、N300(2.49%,1.60%,1.63%)、N375(3.25%,1.98%,1.89%);各施氮处理的Ohtaekwangia和Streptomyces细菌的丰度分别比对照增加了33.6%~173.1%和3.4%~66.4%,而Gaiella和Solirubrobacter细菌的丰度分别比对照N0降低了6.9%~30.8%和4.5%~27.6%.Arthrobacter、Nocardioides的丰度随施氮量增加明显呈上升趋势,但各处理之间并没有明显差异,因此,可以确定连续施氮有选择性的改变了土壤的细菌群落结构.

图3 不同施氮处理土壤优势属的分布Figure 3 Distribution of dominant genera in different nitrogen treatments
2.5 长期施氮对细菌群落结果和多样性对不同施氮量的响应机制
为进一步揭示影响土壤细菌优势群落组成对不同施氮量的响应机制,对不同施氮量处理土壤优势细菌群落结构和部分土壤理化性质做冗余分析(RDA),可以明确得出长期不同施氮量引起的土壤环境因子的变化与微生物群落结构的相关性,结果如图4所示,土壤pH(P=0.008)和土壤NO3--N浓度(P=0.041)对微生物群落影响最为显著,2个序列轴分别解释了17.42%、5.15%的群落变化,因此,初步确定土壤pH和土壤NO3--N浓度的改变是影响细菌群落结构的主要土壤环境因子.
2.6 优势细菌群落结构的变化与土壤理化性质的相关性分析
为进一步确定影响细菌的优势菌群的环境因子,将土壤部分理化性质与土壤细菌群落结构的分布做相关性分析,结果表明,除了在门水平、纲水平以及属水平的相对丰度的变化与pH和NO3--N含量具有明显的相关性,其中与pH呈显著正相关但与NO3--N含量显著负相关的菌群有Acidobacte-ria、Gemmatimonadetes,AcidobacteriaGP6、AcidobacteriaGP4,Gemmatimonas、Solirubrobacter;与pH呈显著负相关同时与NO3--N含量呈显著正相关的细菌优势菌群有Bacteroidetes、Bacteroidetesincertaesedis、Ohtaekwangia、Streptomyces.尽管从RDA分析还是相关性分析结果来看,pH都是显著影响细菌优势菌群变化的因子,但是随着施氮量升高,土壤pH相比于其他处理仅在最高施氮量处理条件下降低了0.3个单位,然而,大多数细菌都生活在pH为4~9的环境中[11],且大多都能承受pH在0~1个单位之间的变化量,因此引起土壤细菌群落结构变化的最主要的环境因子是NO3--N含量,而并非土壤pH值.

图4 不同施氮量处理土壤优势细菌群落结构与土壤部分理化性质RDA分析Figure 4 RDA analysis of soil dominant bacteria community structure and soil physicochemical properties under different nitrogen application rates
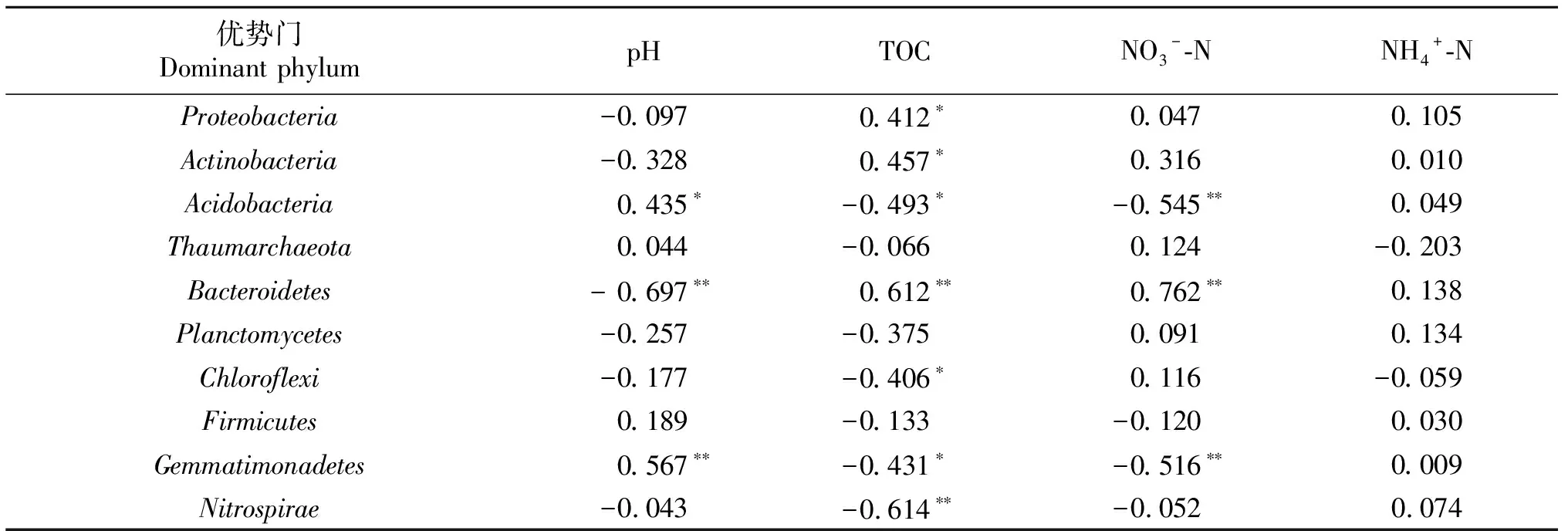
表5 细菌优势门与土壤部分理化性质的相关性分析
*表示P<0.05,**表示P<0.01.* meansP<0.05,** meansP<0.01.
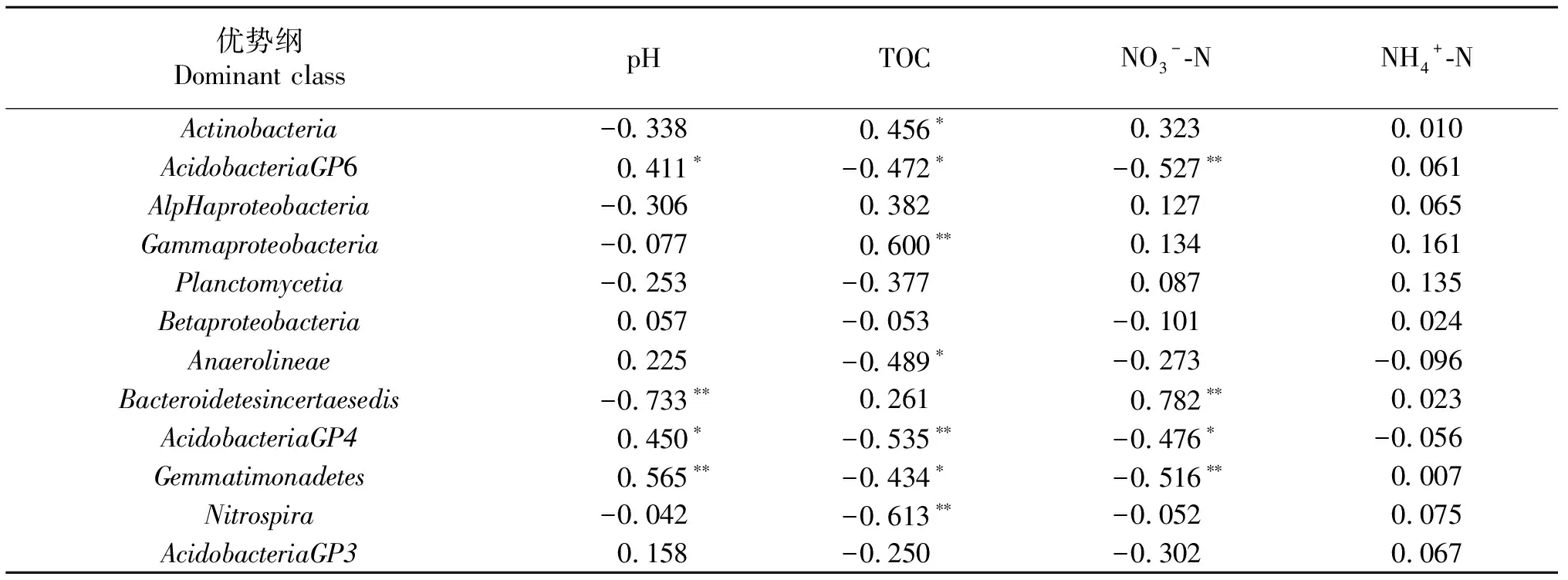
表6 细菌优势纲与部分土壤理化性质的相关性分析
*表示P<0.05,**表示P<0.01.* meansP<0.05,** meansP<0.01.
*表示P<0.05,**表示P<0.01.* meansP<0.05,** meansP<0.01.
3 讨论
3.1 长期施氮对土壤剖面NO3--N含量和土壤pH的影响
氮素是作物生长发育过程中的必需大量元素之一,在作物生命活动和产量形成中有着不可替代的作用[16],氮肥的施用量不足,造成作物产量较低且土壤氮肥肥力大量耗竭,而施氮量过高,不仅造成资源的浪费,同时因过量施氮而引起土壤硝酸盐富集,造成水体和大气环境的污染[5].土壤NO3--N是作物吸收氮素的主要形态之一,其丰缺程度能有效表征土壤供氮状况[17].尿素在施入土壤后,会先经过脲酶水解,产生氨,NH4+进一步硝化生成NO3--N,使得大量NO3--N在土壤中累积,同时在硝化过程中产生大量H+,使土壤pH下降[18].本研究结果表明,连续4 a施用尿素,导致土壤pH降低,尤其是高施氮肥处理N375,土壤pH值下降了0.3个单位,且随着施氮量增加,土壤剖面中NO3--N含量显著增加,造成土壤NO3--N大量累积,土壤硝酸盐富集,对地下水以及大气环境带来潜在风险.
3.2 长期施氮对细菌AlpHa多样性和群落结构的影响,
大量研究表明,过量使用氮肥会导致土壤细菌多样性降低[8,19],使得土壤细菌群落结构发生变化,在本研究中,连续4 a施氮,相比于其他处理,仅N375处理shannon指数显著低于其他施氮处理,而simpson指数显著高于其他处理,同时最高施氮量处理N375的土壤样品OTU与Chao1值最低,说明长期过量施氮可以降低土壤细菌多样性,该结果与前人的研究结果一致.有研究表明在美国的长期N投入试验中观察到,高N施入增加了丰富类群(变形菌门和拟杆菌门)的相对丰度,降低了贫瘠类群(酸杆菌门)的相对丰度[19].在土壤营养物质增加时,丰富类群能利用有效碳源快速生长,因此可以在较高氮含量的环境下较好的生长繁殖,而贫瘠类群在环境中生长速度较低,吸收营养物质的能力较弱,因此在营养物质较高时,这些贫瘠类群与丰富类群相比竞争力较弱,不能良好的生长繁殖[20],导致其数量下降.本研究结果表明,连续4 a施氮,各处理优势菌门的绝对量发生了变化,与N0相比,在0~20 cm土层内.土壤放线菌门和拟杆菌门的丰度随着施氮量增加显著提高,酸杆菌门的丰度显著降低,土壤变形菌门丰度随着施氮量增加虽整体呈上升趋势,但各处理之间并没有显著性差异.这与前人研究结果一致,由于长期施氮导致土壤硝态氮含量显著增加,土壤营养物质增加,从而促进了丰富类群的生长,抑制了贫瘠类群的生长.
有研究报道[21-22]变形菌门中许多细菌类群参与了土壤氮素循环,与硝化作用有关的细菌大多数属于变形菌门中的β-变形菌纲和r-变形菌纲,而许多不同种类的细菌都具有反硝化功能,如放线菌门,厚壁菌门,拟杆菌属以及变形菌门中的一些细菌[23],在本研究中,施氮明显促进了r-变形菌纲细菌类群的生长,且检测出来的两种优势属水平的菌群Lysobacter(溶杆菌属)、Steroidobacter(甾杆菌属)、均属于r-变形菌纲,Nitrospira(硝化螺菌属)的丰度随着施氮量增加而升高,值得注意的是,检测出来的Azotobacter(固氮菌属)虽说丰度较低,但是相比施氮处理,不施氮处理中Azotobacter的丰度是施氮处理的1.25~2.15倍.说明不施氮处理显著刺激了土壤Azotobacter的生长.氮素的添加能够促进土壤放线菌门细菌的生长[24],本研究发现排名前12的优势属中,有6个优势属分别是Nocardioides(类诺卡氏菌属)、Gaiella、Arthrobacter(节杆菌属)、Streptomyces(链霉菌属)、Solirubrobacter(土壤红杆菌属)、Blastococcus等属于放线菌纲,其丰度占整个优势属丰度的41.88%,其中Nocardioides,Arthrobacter都能将土壤中的硝酸盐还原为亚硝酸盐[12],且随着施氮量增加,其丰度显著升高.而拟杆菌门的丰度整体来说是随着施氮量下降的,但检测出来的优势纲Bacteroidetesincrete(拟杆菌纲)以及Ohtaekwangia的丰度均随着施氮量升高显著升高,Ohtaekwangia是新发现的属于拟杆菌门噬纤维菌科中的新属[13],其具体的生活习性鲜见报道,因此,推测拟杆菌门中的Bacteroidetesincrete以及Ohtaekwangia的细菌与反硝化作用密切相关.Gemmatimonadates(芽孢单菌门)中细菌类群具有很强的反硝化功能,Gemmatimonadates(芽单胞菌属)具有脱氮的功能[24].但本研究结果中与前人研究结果相悖[24-25]的是随着施氮量增加,Gemmatimonadates的丰度显著降低,前人研究结果表明,水氮一体的环境条件下Gemmatimonadates的丰度随着施氮量增加而显著增加,因此推测,Gemmatimonadates对土壤水分的敏感程度较高,而在旱地土壤中,由于水分不足导致Gemmatimonadates随着施氮量升高反而呈降低趋势.
值得注意的是,随着施氮量增加而增加的细菌优势属还有Lysobacter(溶杆菌属)和(Streptomyces)链霉菌属,而溶杆菌属细菌可以抑制一些土传真菌病害,如水稻白叶枯病、辣椒疫病,对立枯丝核菌具有明显的抑制作用[26];而链霉菌属细菌可以产生抗真菌活性,抗细菌活性以及抗病毒的毒素[12],在本研究中,可能是由于连作和长期施氮,导致一些对马铃薯生长有害的细菌或真菌大量繁殖,刺激了溶杆菌属和链霉菌属的生长.
3.3 细菌群落结构与部分土壤理化性质的相关性分析
长期施氮显著影响了土壤细菌群落组成结构,RDA分析表明,长期施氮引起的土壤硝态氮含量和土壤pH变化是影响土壤细菌群结构变化的主要环境因子,这与相关性分析结果一致,然而,大多数细菌都生活在pH为4~9的环境中,且大多都能承受pH在0~1个单位之间的变化量[11],而本研究发现随着施氮量升高,土壤pH相比于其他处理仅在最高施氮量处理条件下降低了0.3个单位,因此确定了引起土壤细菌群落结构变化的最主效土壤环境因子是NO3--N含量,而并非土壤pH值.
随着施氮量升高,土壤NO3--N含量显著升高,与NO3--N含量显著负相关的菌群有Acidobacteria(酸杆菌门)、Gemmatimonadetes(芽单胞菌门),AcidobacteriaGP6、AcidobacteriaGP4,Gemmatimonas(芽单胞菌属)、Solirubrobacter(土壤红杆菌属);这是由于酸杆菌门属于贫瘠类群[20],在较高的营养环境中生存竞争力不如像放线菌门,拟杆菌门这种富营养类群,所以在较高营养环境下反而不利于其生长繁殖.但是与前人研究结果不一致[24.25]的是Gemmatimonadetes及Gemmatimonas的丰度与土壤硝态氮含量显著负相关.与硝态氮含量显著正相关的细菌类群有Bacteroidetes(拟杆菌门)、Bacteroidetesincertaesedis(拟杆菌纲)、Arthobacter(节杆菌属)、Nocardioides(类诺卡氏属)、Ohtaekwangia、Streptomyces(链霉菌属),Lysobacter(溶杆菌属),其中Bacteroidetes、Bacteroidetesincertaesedis、Arthobacter、Nocardioides被证实均与反硝化作用有关,可以将硝酸盐还原为亚硝酸盐,因此长期施氮导致土壤硝态氮含量升高,进而影响了土壤细菌群落结构的变化,而Streptomyces,Lysobacter也随着施氮量的升高而升高,可能是因为长期施氮和连作引起的.
4 结论
连续4 a施氮显著提高了土壤剖面中硝态氮的含量,随着施氮量升高,土壤剖面中硝态氮含量显著增加,尤其在0~20 cm土壤中各施氮处理各处理土壤NO3--N含量分别为4.3,6.7,9.2,11.3,20.0,46.8 mg/kg,分别比对照增加了55.8%,113.9%,162.8%,365.1%和988.4%
连续施氮显著改变了表层土壤的细菌群落结构,降低了土壤细菌的群落多样性.连续四年施氮,随着施氮量的增加各处理的门的绝对量发生了变化,随着施氮量增加,各施氮处理土壤放线菌门和拟杆菌门的细菌的丰度分别比对照N0处理增加了6.1%~17.4%和16.4%~46.8%,酸杆菌门的丰度比对照降低了7.8%~26.4%.在纲水平上的土壤优势细菌类群中,与对照N0相比,随着施氮量增加,各处理拟杆菌纲细菌的丰度分别增加了33.8%、44.8%、83.3%、109.2%、173.3%.而AcidobacterGp4和Anaerolineae随着施氮量增加显著降低(P<0.05),较N0相比,随着施氮量增加,各处理AcidobacterGp4和Anaerolineae相对丰度分别降低16.3%~33.8%、8.1%~22.7%;在属水平上的土壤优势细菌类群中,各施氮处理的Ohtaekwangia和Streptomyces细菌的丰度分别比对照增加了33.6%~173.1%和3.4%~66.4%,而Gaiella和Solirubrobacter细菌的丰度分别比对照N0降低了6.9%~30.8%和4.5%~27.6%.连续过量施氮也显著降低了土壤细菌的群落多样性.RDA及相关性分析表明土壤硝态氮含量的变化是导致细菌群落结构发生改变的主要土壤环境因子.
