金属修饰的Mg-Al复合氧化物催化氨基甲酸甲酯和甲醇合成碳酸二甲酯
2019-03-22李雪莲尹鹏鹏蒋希希张学兰王登峰
柏 冬, 李雪莲, 尹鹏鹏, 蒋希希, 张学兰, 王登峰
(1.枣庄学院 化学化工与材料科学学院, 山东 枣庄 277160; 2.常州工程职业技术学院 化工学院, 江苏 常州 213164)
碳酸二甲酯(DMC)是一种重要的绿色化工原料,可替代光气、氯代甲烷、硫酸二甲酯和氯甲酸甲酯等用作甲基化、羰基化和酯化绿色试剂。此外,DMC还被广泛用于医药、燃料、合成材料、电子化学和食品添加剂等领域[1-3]。在众多合成DMC路线中,CO2羰基化法受到了广泛关注。然而,由于热力学限制,该工艺中CO2转化率和DMC收率极低[4]。当前,一种可替代上述绿色工艺的方法是从尿素和甲醇出发合成DMC。这是因为尿素可由CO2和该路线副产的NH3耦合反应制得,实现了CO2间接合成DMC。该方法为两步:首先尿素和甲醇合成中间物氨基甲酸甲酯(MC);然后MC继续和甲醇反应制得DMC。第一步反应不需催化剂即可实现,第二步是反应的决速步骤。同时,尿素在高温下易分解,导致DMC选择性降低[5-6]。因此,针对第二步反应进行催化剂的开发,既可简化反应路径,又能提高DMC选择性。
目前,可用于MC和甲醇合成DMC的催化剂包括均相和非均相催化剂两大类。ZnCl2和LaCl3具有较高活性,然而产品分离和催化剂再生较为困难,限制了其工业应用[7-8]。在前期工作中,笔者所在课题组发现ZnO-Fe2O3可实现49.3%的DMC收率[9]。但是,在反应过程中ZnO活性相容易流失,因而其并不是尿素醇解法合成DMC的理想多相催化剂[10]。因此,急需开发高效稳定的多相固体催化剂,促进尿素醇解法合成DMC的工业化。
除了催化剂组分,前驱体结构也对催化剂理化性质和催化性能有较大影响。Mg-Al水滑石(Mg6Al2(OH)16CO3·nH2O)是具有层状结构的催化剂前驱体。位于其主体层板的Mg2+和Al3+可被其他二价和三价金属阳离子分别取代,获得金属改性的类水滑石,再经煅烧可得到金属修饰的Mg-Al复合氧化物。这些氧化物具有比表面积大、结构稳定和金属分布均匀等优点。更为重要的是,经金属修饰后,样品的碱性会有明显提高,常用作碱催化反应催化剂[11-13]。然而,金属修饰的Mg-Al复合氧化物在MC和甲醇催化合成DMC的催化性能尚不明确。
笔者利用共沉淀法合成了多种金属(Mn、Ni、Zn、Y和La)改性的Mg-Al类水滑石前驱体(HT-0.3M),再经焙烧得到金属修饰的Mg-Al复合氧化物(CHT-0.3M-500)催化剂,用于催化MC和甲醇反应生成DMC,对比考察了各种金属对类水滑石材料和催化剂理化性质的影响。在此基础上,得到了催化剂表面碱性质对催化剂活性影响的规律。最后,研究了金属添加量、前驱体煅烧温度和反应条件对CHT-0.3Y-500催化性能的影响,并考察了其重复使用性。
1 实验部分
1.1 原料和试剂
MC、无水甲醇,国药集团化学试剂有限公司产品;Mg(NO3)2·6H2O、Al(NO3)3·9H2O、Ni(NO3)2·6H2O、Zn(NO3)2·6H2O、Y(NO3)3·6H2O、La(NO3)3·6H2O、Mn(NO3)2溶液(50%质量分数)、无水NaOH和Na2CO3,天津科密欧化学试剂有限公司产品。所用试剂和原料均为分析纯。
1.2 催化剂的制备
所有类水滑石前驱体起始原子摩尔比为n(Mg2+)∶n(Al3+)∶n(M)=3∶0.7∶0.3(M为Mn2+、Ni2+、Zn2+、Y3+或La3+)。典型的制备方法如下:按上述比例将各种硝酸盐配成50 mL混合盐溶液A,NaOH和Na2CO3(摩尔比为4∶1)溶于50 mL去离子水中,配成一定浓度的碱液B。然后,在剧烈搅拌下,将A和B同时滴入50 mL去离子水中,保持溶液pH值在10.0左右。滴加完毕后,将浆体转移到晶化釜于80 ℃老化12 h,再经洗涤、抽滤,100 ℃烘12 h后,即得各种金属改性的Mg-Al类水滑石(HT-0.3M)。最后,将制得的HT-0.3M在500 ℃煅烧7 h,得到上述金属修饰的Mg-Al复合氧化物(CHT-0.3M-500)催化剂。此外,Mg-Al水滑石(HT-0)和Mg-Al复合氧化物(CHT-0-500)的制备方法和上述过程一致,只是没有添加第3种金属,起始原子摩尔比n(Mg2+)∶n(Al3+)=3∶1。
具有不同Y含量的Mg-Al-Y类水滑石前驱体的合成原料和制备过程与上述前驱体的起始原料和制备过程一致。保持n(Mg2+)∶n(Al3++ Y3+)=3∶1,调变n(Al3+)∶n(Y3+)=0.9∶0.1、0.5∶0.5或0.3∶0.7。然后将制得的类水滑石样品在不同温度下(200、300、400、500和600 ℃)煅烧7 h,得到具有不同Y含量的Mg-Al-Y复合氧化物催化剂CHT-xY-m;其中x和m分别代表Y3+和(Al3++ Y3+)的摩尔比和煅烧温度。
1.3 样品的表征
催化剂晶相分析在日本理学D/max-r A型X射线衍射仪上进行,CuΚα辐射,Ni滤光片,管电压和管电流分别为40 kV和40 mA,扫描范围5°~75°。在美国Micromeritics公司Tristar型3000自动物理吸附仪上进行N2吸/脱附实验。测试前样品在300 ℃下进行真空处理,采用BET方程计算样品比表面积。样品形貌在美国FET公司XL30 S-FEG 型扫描电子显微镜上获得,测试过程中,加速电压为10.0 kV。采用美国TJA公司AtomScan16型电感耦合等离子体原子发射光谱仪(ICP-AES)测定样品的金属元素含量。催化剂的CO2程序升温脱附分析(CO2-TPD)实验在自制的装置上进行。将200 mg试样放入U形石英管,Ar气氛中,于500 ℃下预处理3 h除去试样的表面杂质,冷却至室温后脉冲吸附CO2至饱和,再用Ar气吹扫除去物理吸附,然后以10 ℃/min的升温速率升至600 ℃,在瑞士Balzer公司Omnistar-2000型质谱仪采集信号。
1.4 催化剂活性测试
催化剂活性评价在带有长冷凝管的100 mL不锈钢反应釜中进行。称取适量MC、甲醇和催化剂加入反应器中,加热到设定温度后开始计时。反应结束后,关闭搅拌器,待反应釜温度降至室温后,取出反应产物,离心分离除去固体催化剂。在带有PEG-20M分离柱和氢火焰检测器的上海海欣公司GC-950型气相色谱仪上测定液相产物组成。以MC的转化率(xMC)、DMC和氮甲基化的氨基甲酸甲酯(NMMC)的收率(分别记为yDMC和yNMMC)评价催化剂活性。
2 结果与讨论
2.1 金属改性前后Mg-Al类水滑石样品结构和织构表征
金属改性前后Mg-Al类水滑石前驱体材料的XRD谱图如图1(a)所示。由图1(a)看到,所有材料都呈现出类水滑石结构的特征峰,在2θ约为11°、22°和35°出现了3个强度较大的尖锐衍射峰,它们分别对应于层状结构的(003)、(006)和(009)晶面衍射;同时,在60°和62°出现了类水滑石化合物的(110)和(113)晶面的面内衍射峰[14]。由于Y3+(0.090 nm)和La3+(0.103 nm)的离子半径较大,当它们取代离子半径较小的Al3+(0.053 nm)进入类水滑石层状结构时,会导致层板发生较大程度的扭曲,材料结晶度下降[15]。因此,相对于过渡金属改性的前驱体,HT-0.3Y和HT-0.3La样品衍射峰强度明显降低。文献[15]报道,La3+具有较低的电负性,在制备前驱体材料的共沉淀过程中,La3+易生成氢氧化物和碳酸盐。因此,可在HT-La样品的2θ为16°、18°和19°处观察到属于镧氢氧化物和碳酸盐的衍射峰。同时,类水滑石材料属于六方晶系,可利用晶胞参数a(a=2d(110))和c(c=d(003)+2d(006)+3d(009))描述其结构特征,其中d(110)、d(003)、d(006)、d(009)分别为前驱体(110)、(003)、(006)、(009)的晶面距(nm)。表1为金属改性前后Mg-Al类水滑石前驱体材料的织构和化学性质。不难发现,所有样品参数的数值都和文献[11-15]报道范围一致。这说明已成功制备出各种金属改性的类水滑石。图1(b)为500 ℃煅烧后金属修饰前后Mg-Al复合氧化物的XRD谱图。可以看出,所有样品的水滑石结构均遭到了破坏。除了CHT-0.3La-500催化剂,其他材料在34°、43°和63°均出现了属于MgO(JCPDS 45-0946)的特征峰。但CHT-0.3Y-500和CHT-0.3La-500 样品的MgO峰强度明显降低。且对于CHT-0.3La-500来说,在22°、30°、45°和55°还出现了La2O2CO3的衍射峰。这是由于在前驱体热分解过程中材料会重新吸附CO2所造成的[15]。另外,所有催化剂都没有检测到其他金属氧化物的出现,说明它们可能以无定型或微晶状态存在。
图2为金属改性前后Mg-Al复合氧化物催化剂的N2吸/脱附等温线。表2为金属改性前后Mg-Al复合氧化物催化剂织构和碱性质。由图2可以看出,所有样品都显示Ⅳ型N2吸/脱附等温曲线,并有明显的滞后环产生。这说明在焙烧过程中,催化剂形成了较为规整的介孔结构。由表1和表2可知,与其相对应的类水滑石前驱体相比,这些复合氧化物催化剂都具有较大的比表面积。这是由于在焙烧含CO32-材料的过程中产生了大量CO2气体,有利于样品产生较大的比表面积[16]。需要注意的是,由于CHT-0.3La-500 样品表面有La2O2CO3晶相的生成,导致其比表面积最小。

图1 金属改性前后Mg-Al类水滑石、金属修饰前后Mg-Al复合氧化物的XRD谱图Fig.1 XRD patterns of HT-0 and HT-0.3M hydrotalcite-like compounds, CHT-0-500 andCHT-0.3M-500 (M=Mn, Ni, Zn, Y or La) mixed oxides(a) HT-0 and HT-0.3M; (b) CHT-0-500 and CHT-0.3M-500
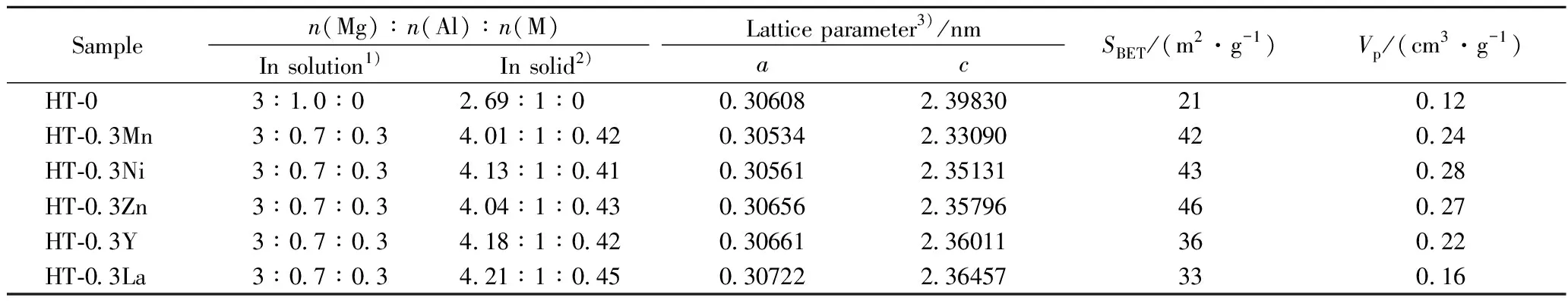
Samplen(Mg)∶n(Al)∶n(M)Lattice parameter3)/nmIn solution1)In solid2)acSBET/(m2·g-1)Vp/(cm3·g-1)HT-03∶1.0∶02.69∶1∶00.30608 2.39830210.12HT-0.3Mn3∶0.7∶0.34.01∶1∶0.420.305342.33090420.24HT-0.3Ni3∶0.7∶0.34.13∶1∶0.410.305612.35131430.28HT-0.3Zn3∶0.7∶0.34.04∶1∶0.430.306562.35796460.27HT-0.3Y3∶0.7∶0.34.18∶1∶0.420.306612.36011360.22HT-0.3La3∶0.7∶0.34.21∶1∶0.450.307222.36457330.16
1) Nominal atomic ratio in mother solution; 2) Measured by ICP-AES for precursors; 3) Determined by XRD,a=2d(110),c=d(003)+2d(006)+3d(009);d(110),d(003),d(006)andd(009)are the interplanar spacing of (110), (003), (006), (009) diffraction for the precursors, respectively

图2 金属改性前后Mg-Al复合氧化物催化剂的N2吸/脱附等温线Fig.2 N2 adsorption/desorption isotherms of CHT-0-500 andCHT-0.3M-500 (M=Mn, Ni, Zn, Y or La) catalysts
金属改性前后Mg-Al复合氧化物催化剂的扫描电镜照片如图3所示。由图3看到,在没有金属添加时,Mg-Al复合氧化物的层状形貌比较均匀,分散度较好[12]。添加其他金属后,虽然样品的形貌都发生了不同程度的改变,但样品仍然具有层状结构,晶粒尺寸为50~200 nm。另外,CHT-0.3Mn-500、CHT-0.3Ni-500和CHT-0.3Zn-500样品的分散性明显好于CHT-0.3Y-500和CHT-0.3La-500。尤其是CHT-0.3La-500催化剂,晶粒出现了明显的聚集,可能是由于材料前驱体表面氢氧化物和碳酸盐的形成所造成的。

表2 金属改性前后Mg-Al复合氧化物催化剂织构和碱性质Table 2 Textural and basic properties of CHT-0-500 and CHT-0.3M-500 (M=Mn, Ni, Zn, Y or La) catalysts
1) Values in parentheses are the contribution of single basic site to the number of total basic sites,%.

图3 金属改性前后Mg-Al复合氧化物SEM电镜照片Fig.3 SEM images of CHT-0-500 and CHT-0.3M-500(M=Mn, Ni, Zn, Y or La) mixed oxides(a) CHT-0-500; (b) CHT-0.3Mn-500; (c) CHT-0.3Ni-500;(d) CHT-0.3Zn-500; (e) CHT-0.3Y-500; (f) CHT-0.3La-500
2.2 金属改性前后Mg-Al复合氧化物催化剂表面碱性质
催化剂表面碱性质可通过CO2-TPD实验进行测定。CO2-TPD曲线中,较高的脱附温度代表催化剂具有较强的碱强度;CO2脱附量大说明催化剂具有大的表面碱量。图4为金属修饰前后Mg-Al复合氧化物催化剂的CO2-TPD曲线。所有曲线都可以分解为3个Gaussian峰,分别是催化剂的弱碱性位(<200 ℃)、中强碱性位(200~400 ℃)和强碱性位(>400 ℃)。文献[12,15-16]报道:复合氧化物的弱碱性位产生于表面OH-基团;中等碱性位是由金属-氧离子对(Mg-O、Al-O和M-O)产生的;而强碱性位是由不饱和的O2-离子产生。由图4可以看出,对于CHT-0.3M-500复合氧化物来说,尽管其弱碱性位右移不太明显,但它们的中强碱性位和强碱性位分别出现了不同程度的右移。这说明金属的改性有利于催化剂碱强度的提高。特别是CHT-0.3Mn-500和CHT-0.3La-500催化剂,它们的强碱性位脱附温度分别提高到480和460 ℃。从表2看出,金属改性后催化剂的碱量明显大于未改性的Mg-Al复合氧化物的碱量。同时,金属改性对催化剂表面碱性位分布的影响也很大。当没有金属改性时,Mg-Al复合氧化物的弱碱性位所占的比例较高;而CHT-0.3M-500 样品的中强碱位和强碱性所占比例明显增加。这归结于以下两个原因:首先,金属的加入,在Mg-Al复合氧化物中造成了许多“缺陷”,从整体上提高了催化剂碱密度;另外,金属的加入也会增加金属-氧离子对(M-O)数量,同时M-O也可部分裂解成不饱和的O2-离子[12,15-16],因此,催化剂总碱量、中强碱性位和强碱性位所占的比例都得到了明显改善。由此可见,金属的加入不但提高了催化剂碱强度,更有助于表面碱量的增加。
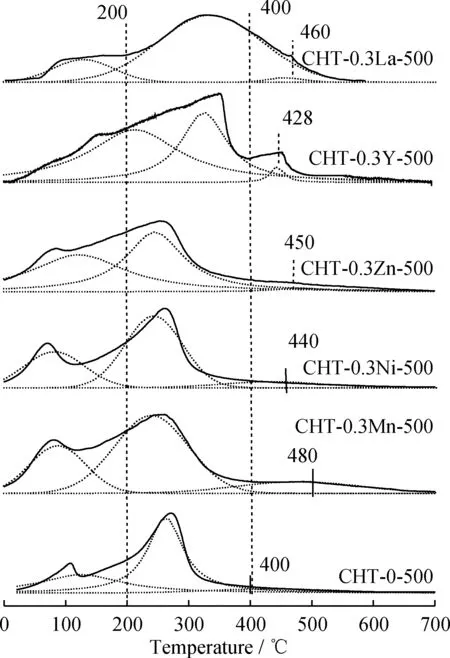
图4 金属改性前后Mg-Al复合氧化物催化剂的CO2-TPD曲线Fig.4 CO2-TPD profiles of CHT-0-500 andCHT-0.3M-500 (M=Mn, Ni, Zn, Y or La) catalysts
2.3 合成条件对CHT-M系列催化剂催化合成DMC性能的影响
2.3.1 金属助剂的影响
金属修饰前后的Mg-Al复合氧化物催化MC和甲醇反应合成DMC的性能结果如表3所示。由表3看到,无催化剂时,MC与甲醇合成DMC的收率只有2.6%。以CHT-0-500为催化剂时,DMC收率可达28.2%,说明MC和甲醇合成DMC可能是碱催化反应。Mg-Al复合氧化物掺杂金属后,催化剂的活性都明显提高,但它们的催化性能差别较大。CHT-0.3Zn-500的催化活性最低,DMC收率只有32.6%,与未改性的Mg-Al复合氧化物催化剂活性基本相当。CHT-0.3Y-500和CHT-0.3La-500样品可分别带来58.3%和50.9%的DMC收率。由此可知,与过渡金属相比,稀土金属的加入更有利于DMC的合成。上述几种样品催化活性由高到低的顺序依次为CHT-0.3Y-500、CHT-0.3La-500、CHT-0.3Mn-500、CHT-0.3Ni-500、CHT-0.3Zn-500、CHT-0-500。结合图4的CO2-TPD实验表征结果可知,当上述金属加入到Mg-Al复合氧化物后,催化剂表面碱性位数量明显增加;此时,催化剂的活性也相应提高,说明在DMC的合成中,催化剂活性可能与催化剂表面碱密度有关。为了验证上述结论,将反应开始2 h的CHT-0-500和CHT-0.3M-500催化剂上MC转化率对催化剂碱性位的数量进行作图,见图5。由图5可知,当以表面碱性位数目较低的CHT-0为催化剂时,MC转化率较低,只有16.3%;而以催化剂碱性数目较多的CHT-0.3Y-500为催化剂时,MC收率可达到38.2%。且MC转化率随催化剂表面碱位数目增加而增加,说明催化剂的催化能力取决于其表面碱性位数目,催化剂碱性位数目的增多,有利于其活性的提高。
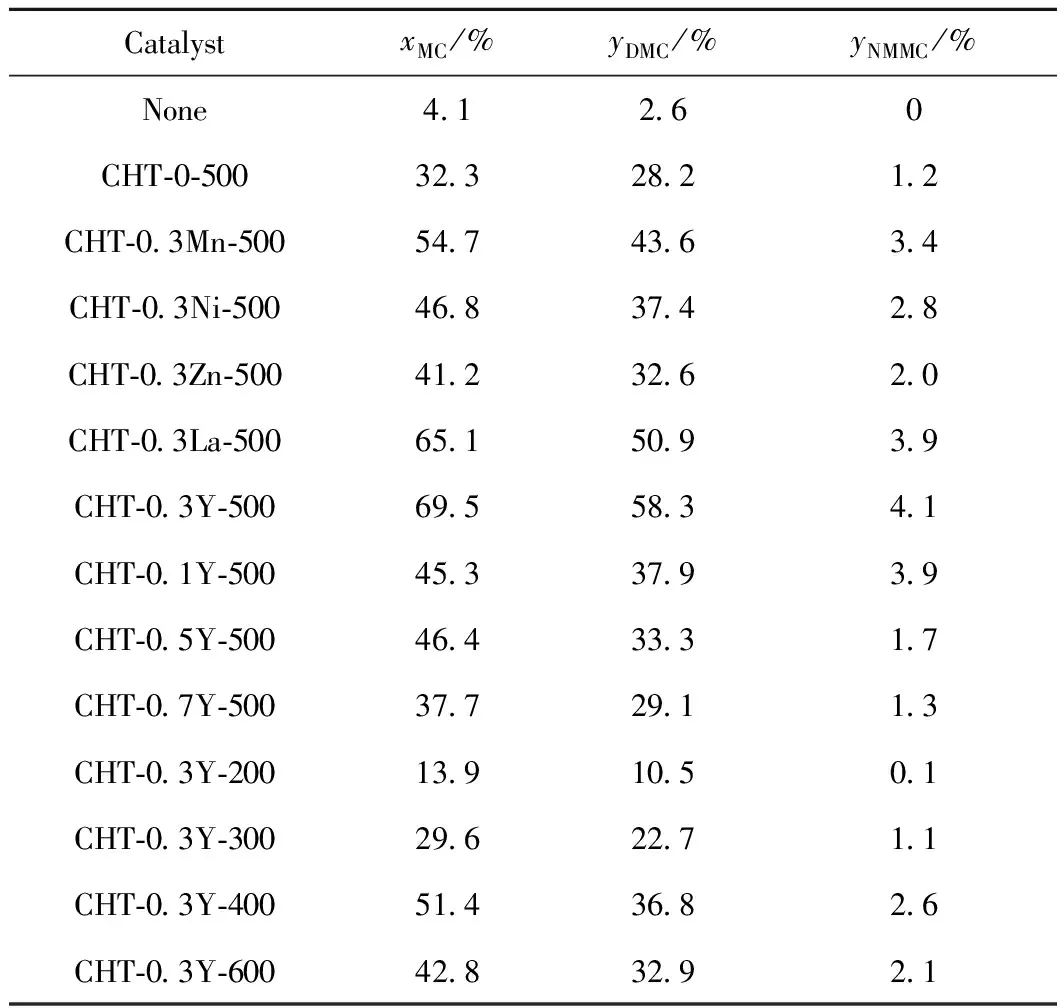
表3 金属改性前后Mg-Al复合氧化物催化剂上合成DMC的催化性能结果Table 3 Catalytic performances of various CHT-Mcatalysts for the DMC synthesis
Reaction conditions:T=200 ℃;t=6 h;m(Catalyst)=0.5 g;m(MC)=3.75 g;m(Methanol)=32 g
2.3.2 Y含量的影响
鉴于Y修饰的Mg-Al复合氧化物催化能力最高,笔者又着重考察了Y含量对Mg-Al复合氧化物催化性能的影响,结果如表3所示。不难发现,Y含量对Mg-Al复合氧化物的催化性能有较大的影响。当Y含量较少时,MC转化率和DMC收率较低。随着Y含量的增加,催化剂活性逐渐增加;当n(Y3+)∶n(Al3++Y3+)=0.3时,催化性能最好,MC转化率和DMC收率可分别达到69.5%和58.3%。然而当Y含量进一步增加,催化剂活性明显降低,尤其是CHT-0.7Y-500的催化性能最差,DMC收率只有29.1%。这说明过多Y的加入并不利于DMC的合成。
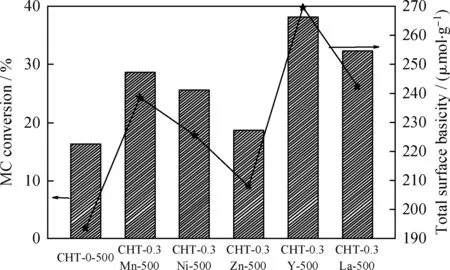
图5 MC转化率与金属改性前后Mg-Al复合氧化物催化剂表面碱度之间的关系Fig.5 Relationship between the MC conversion and thesurface basicity for CHT-0-500 and CHT-0.3M-500 catalystsReaction conditions: T=200 ℃; t=2 h;m(Catalyst)=0.5 g; m(MC)=3.75 g; m(Methanol)=32 g
2.3.3 煅烧温度的影响
为了获得水滑石煅烧温度对反应的影响,分别将HT-0.3Y前驱体在不同温度下煅烧得到多种复合氧化物催化剂,其催化合成DMC的结果如表3所示。由表3看到,当煅烧温度低于600 ℃时,催化剂活性随煅烧温度的升高而升高;前驱体材料在500 ℃煅烧,所获得的CHT-0.3Y-500催化剂具有最好的催化性能。当煅烧温度进一步升高,催化剂催化能力明显下降。这是由于在煅烧温度低于500 ℃ 时,随温度的升高,催化剂表面弱碱性位OH-、中强碱性位金属-氧离子对(M-O)以及强碱性位O2-的数量会不断增加;当煅烧温度进一步升高到600 ℃时,催化剂表面酸性位数量会大于其碱性位数量,不利于反应的进行[12]。因此,在500 ℃煅烧后的CHT-0.3Y-500催化剂其催化能力最强。
2.4 金属改性Mg-Al复合氧化物催化MC和甲醇合成DMC可能的催化机理
基于以上催化剂活性测试和催化剂表征,结合文献报道,提出金属改性Mg-Al复合氧化物催化MC和甲醇合成DMC可能的催化机理,如图6所示[17]。首先,MC通过分子中的NH2基氮原子与固体碱表面的金属原子(Mg、Al或M)络合形成中间物种。这样,MC中C—N键电子发生重排,出现了碳正离子和氮负离子。同时,甲醇分子吸附于固体碱碱性位点得到活化,在释放出氢质子的同时,转化为亲核的甲氧基负离子。然后,带负电的氧负离子亲核进攻活化后的MC碳正离子;同时,MC氮负离子与带正电的氢质子结合,导致C—N键和O—H键断裂的同时,生成新的C—O键和N—H键,得到DMC和NH3。所以,表面碱性位数量较多的催化剂有利于生成更多的CH3O-,从而降低了甲醇与MC反应的活化能,利于DMC的合成。因此,具有最多碱性位数目的CHT-0.3Y-500活性最高,而表面碱密度最小的CHT-0-500活性最低。这与表3的催化实验结果一致。

图6 金属改性Mg-Al复合氧化物催化MC和甲醇合成DMC可能的催化机理Fig.6 Possible reaction mechanism for the DMC synthesisfrom MC and methanol over CHT-0.3M-500(M=La, Y, Zn, Ni, Mn) catalysts
2.5 反应条件对CHT-0.3Y-500催化剂催化MC和甲醇合成DMC性能的影响
以催化活性最好的CHT-0.3Y-500为模板催化剂,考察了反应温度、反应时间和催化剂用量分别对MC和甲醇合成DMC的影响,结果见图7。
由图7(a)可以看出:在反应时间为6 h,反应温度为200 ℃的条件下,随CHT-0.3Y-500催化剂用量的增加,MC转化率和NMMC收率持续增加;当催化剂用量为0.5 g时,DMC的收率最高;当催化剂超过0.5 g时,DMC收率下降。这是因为过多的催化剂会促进MC甲基化副反应的发生,引起氮甲基化的NMMC收率大增[7]。
由图7(b)可以看出,由于MC和甲醇反应是吸热反应,温度的上升利于MC转化率的提高[18],但高温也会引起副反应剧烈发生,因此,DMC的收率随反应温度的升高呈现先增加后减小的趋势。当反应温度为200 ℃时达到峰值;当温度进一步增加,DMC收率显著降低。这是由于过高的温度会加剧MC甲基化反应的进行,也会促进DMC的热分解[19]。

图7 催化剂用量(m(Catalyst))、反应温度(T)和反应时间(t)对CHT-0.3Y-500催化MC和甲醇合成DMC反应的影响Fig.7 Effect of m(Catalyst), T and t on the synthesis ofDMC from MC and methanol over CHT-0.3M-500(a) m(Catalyst) vs xMC, yDMC or yNMMC;T=200 ℃, t=2 h, m(MC)=3.75 g, m(Methanol)=32 g;(b) T vs xMC, yDMC or yNMMC;t=2 h, m(Catalyst)=0.5 g, m(MC)=3.75 g; m(Methanol)=32 g;(c) t vs xMC, yDMC or yNMMC;T=200 ℃, m(Catalyst)=0.5 g, m(MC)=3.75 g,m(Methanol)=32 g
由图7(c)可以看出,随反应时间的延长,MC转化率和NMMC收率单调增加。然而,DMC收率在6 h时达到最大,进一步延长反应时间DMC的收率会明显降低。这是因为过长的反应时间会导致NMMC的生成和DMC分解等副反应的加剧,降低了DMC的选择性。
2.6 CHT-0.3Y-500催化剂稳定性考察
通过考察催化剂重复使用性和催化剂结构表征来评价催化剂的稳定性能。当催化反应完成后,将反应产物混合液过滤,经无水甲醇数次洗涤后,所回收的催化剂放入烘箱80 ℃干燥10 h,直接用于下一轮反应。如此反复使用4次,依据催化剂活性的变化情况,获得催化剂稳定性评价的最终结论。图8 为CHT-0.3Y-500催化剂催化MC和甲醇合成DMC的重复使用性。由图8可知,CHT-0.3Y-500样品在重复使用4次后,与新鲜催化剂相比,其催化活性基本没有下降。

图8 CHT-0.3Y-500催化剂催化MC和甲醇合成DMC的重复使用性Fig.8 Catalytic reusability of CHT-0.3Y-500 for thesynthesis of DMC from MC and methanolReaction conditions: T=200 ℃; t=6 h; m(Catalyst)=0.5 g;m(MC)=3.75 g; m(Methanol)=32 g
更为重要的是,将重复使用4次后的CHT-Y催化剂(CHT-Y-fourth)进行了XRD和SEM测试,并与新鲜的CHT-0.3Y-500样品的比较结果见图9。从图9可以看出,2种材料的衍射峰强度和数量基本没有区别;同时,SEM测试结果表明CHT-0.3Y-500-fourth 样品仍然具有典型的层状结构,所以其形貌没有发生改变。另外,CHT-0.3Y-500-fourth 的比表面积为97 m2/g,与新鲜催化剂相比,基本没有下降。说明Y改性的Mg-Al复合氧化物催化剂具有较高的催化稳定性,是合成DMC的理想多相催化剂。
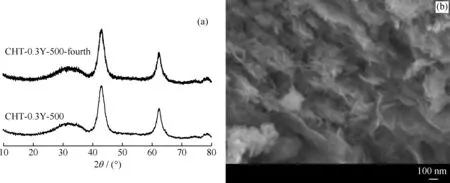
图9 CHT-0.3Y-500催化剂和CHT-0.3Y-500-fourth的XRD谱图和CHT-0.3Y-500-fourth的SEM照片Fig.9 XRD patterns of CHT-0.3Y-500 and CHT-0.3Y-500-fourth samples and SEM photo of CHT-0.3Y-500-fourth(a) XRD; (b) SEM of CHT-0.3Y-500-fourth
3 结 论
(1)以金属硝酸盐为原料,NaOH和Na2CO3为沉淀剂,通过共沉淀法制得了一系列金属改性的Mg-Al类水滑石,经适当热处理后,获得了各种金属改性的CHT-0.3M-500(M=Mn、Ni、Zn、Y或La)复合氧化物催化剂。研究表明,前驱体材料的物化性质决定于所添加金属的种类,且通过改变金属的种类可实现对Mg-Al复合氧化物表面碱性的调控。
(2)催化剂催化MC和甲醇生成DMC的能力取决于催化剂表面的碱性位数目。碱强度越强,催化活性越高。这是因为,催化剂表面碱性位可分别活化MC和甲醇生成活性中间体,降低了反应的活化能,利于DMC合成。在所有样品中,CHT-0.3Y-500具有最多的碱性位数目,因此,在相同的反应条件下,其催化活性最高。
(3)以Y修饰的Mg-Al复合氧化物为模板催化剂,考察了Y含量和前驱体煅烧温度对催化效果的影响,发现当n(Y3+)∶n(Y3++ Al3+)=0.3,前驱体煅烧温度为500 ℃时,所制备的催化剂催化性能最佳。
(4)优化了CHT-0.3Y-500样品反应条件,在反应温度为200 ℃、反应时间为6 h、催化剂用量为0.5 g时,DMC收率可达58.3%。此外,该催化剂在重复使用4次后,催化活性和催化剂结构基本保持不变,是合成DMC的理想多相固体催化剂。
