桂西北岩溶地区不同植被土壤养分及微生物生理类群数量的季节变化
2019-03-22覃勇荣白新高刘旭辉
覃勇荣,白新高,刘旭辉
(河池学院化学与生物工程学院,广西宜州 546300)
土壤微生物是生态系统的重要组成部分,其分布和活跃程度对土壤结构的形成和矿质元素的转化,增加土壤肥力均有重要的作用,土壤微生物的多样性可以促进植物的生长发育,从而加速植物群落演替的进程[1-2]。由于不同植被的生物学特性差异大,岩溶地区的空间差异也比较大,所以,不同植被对其群落内的土壤微生物种群及其结构产生不同的影响。相关研究表明,土壤微生物种群、群落结构及其生理类群、微生物量、酶活性等,不仅可以客观反映土壤质量的演变和植被的恢复演替,还可以作为植被对土壤环境适应和改良的过程和土壤环境变化与健康的监测指标[3-6]。土壤和植被在不断的发展演化中,对土壤结构和功能的改善及植物群落的演替有促进作用。土壤理化性质影响植物的生长发育、植被演替和土壤微生物数量的变化,而土壤微生物数量的增加,则有助于提高植被的抗逆性,可加快植被恢复的速度,从而增强和巩固岩溶地区植被恢复的效果[7-8]。土壤微生物数量受温度、水分、植物残体及植物生长发育的综合影响,随季节变化而呈周期性的波动[9-10]。相关研究结果表明,氨化细菌、固氮细菌和硝化细菌在土壤中的数量和分布受季节变化的影响,土壤微生物季节变化不仅能说明生态环境的演变,而且土壤微生物是土壤生态系统中重要的生命体,能敏感地反映土壤生态系统受人为干扰而产生的细微变化,因此被称为土壤生态系统变化的预警及敏感指标[11-12]。
由于人口增长及不合理的社会经济活动影响,我国西南喀斯特岩溶地区的植被破坏、水土流失问题比较严重,基岩大面积裸露,土地生产力下降,地表出现类似荒漠的景观,即所谓的石漠化现象[13-14]。广西是我国石漠化问题最严重的省区之一,石漠化已成为制约其区域经济发展的瓶颈。不同植被土壤的氮磷钾等营养物质含量与植被覆盖率、土地复垦率之间均显著相关,土壤有机质和氮磷钾含量对岩溶地区植被恢复影响极大[15-16]。虽然人们对石漠化的成因及相关问题进行了一些研究,但相关研究大多都集中在土壤理化性质、土壤酶活性变化、植被的生理生态以及土壤动物群落结构等方面[6,17-20],而对岩溶地区不同植被土壤微生物生理类群的研究较少,因此,笔者以桂西北岩溶地区不同植被样地为研究对象,分别对不同植被样地土壤微生物生理类群的数量进行测定,并对不同植被样地土壤理化特性进行比较,分析影响土壤微生物数量变化的主要因子,以便为桂西北岩溶地区植被恢复和石漠化治理提供科学依据。
1 材料与方法
1.1 调查区域自然概况
本研究调查样地选择在广西河池市宜州区庆远镇境内。宜州区地处桂西北,地理坐标为108°4′~109°2′E,24°12′~24°56′N,属亚热带季风气候区和典型的喀斯特地形地貌,光照充足,雨量充沛,年平均日照时数为1 696.9 h,年平均气温为19.6~20.2℃,极端最高温度为39.8℃,极端最低气温为-2.2℃,年均降水量为1 300~1 330 mm,无霜期为323 d。具体采样点位于宜州城北白龙公园及其附近区域,选择受人为极度破坏的类芦样地(废弃的采石场),以及优势种为阴香、阴香+青檀、青檀等代表性植被的样地进行采样,每个样地面积不小于400 m2,调查样地的基本情况见表1。
1.2 试剂与仪器
1.2.1 试剂 本研究所用试剂见表2。
1.2.2 仪器 本试验所用的主要仪器见表3。
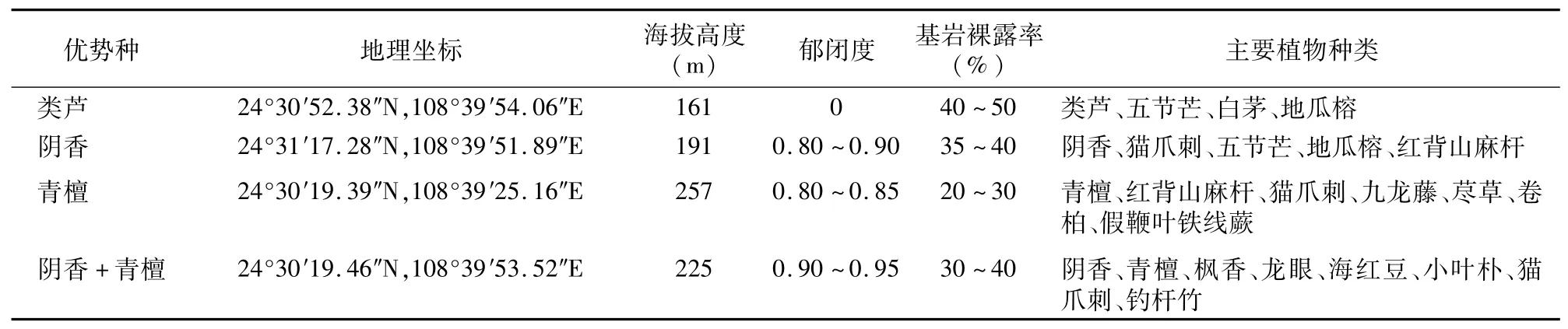
表1 调查样地基本情况

表2 试验试剂

表3 试验仪器
1.3 试验方法
1.3.1 样品采集及预处理 2014年9月至2015年8月,每月中旬(15日左右)到设定的调查样地进行采样,按蛇形采样法,在4种不同植被典型样地中,选择具有代表性的5个样点进行采样。采样时,清除地表的碎石和凋落物,取0~10 cm表层土,过2 mm标准筛,样品充分混匀后,用四分法随机选取1份,用无菌封口袋封装并放入冰壶中,带回实验室,置于3~5℃冰箱中保存。具体采样方法参考文献[21]。样品采回后,尽快测定土壤含水量并进行微生物的接种培养,避免因样品保存过久而造成土壤微生物数量的变化。
1.3.2 培养基的选择 氨化细菌培养采用蛋白胨琼脂培养基;固氮细菌培养采用瓦克斯曼77号培养基;硝化细菌培养采用改良的斯蒂芬森(Stephenson)培养基,培养基配备的具体方法参照文献[22]。
1.3.3 土壤微生物的分离计数 土壤微生物的分离接种、计数,分别采用稀释涂布平板法和稀释法[22-23],通过预试验确定合理的接种浓度,氨化细菌和固氮细菌用10-3稀释液,硝化细菌采用10-2~10-76个浓度梯度稀释液。氨化细菌和固氮细菌采用平板表面涂布法,硝化细菌采用稀释法(每个样品均做3次重复),接种后置于28℃培养箱培养3、7、14 d后统计菌落数量,然后,计算每克土壤中相关微生物的菌落形成单位(CFU),计算公式分别为:
每克干土中菌数=(同一稀释度3次重复的平均菌落数×稀释倍数×20)/干土质量×100%;
每克干土中菌数=近似值×数量指示第1位数稀释倍数/干土质量×100%,具体参考文献[23]。
1.3.4 土壤理化性质的测定 土壤中有机质含量的测定采用重铬酸钾-浓硫酸氧化比色法[24],土壤全磷含量的测定采用氢氧化钠碱熔-钼蓝比色法,土壤有效磷含量的测定采用碳酸氢钠浸提-钼锑抗比色法,土壤全氮含量测定采用浓酸-高氯酸消解半微量凯氏定氮法,土壤有效氮含量的测定采用碱解扩散法,土壤全钾含量的测定采用氢氧化钠碱熔-火焰光度计法,土壤速效钾含量的测定采用乙酸铵浸 提-火焰光度计法,土壤电导率和pH值的测定采用电位法,水分含量的测定采用质量法,具体参照鲍士旦的方法[25],计算公式为土壤含水量=[(鲜土质量-干土质量)/鲜土质量]×100%。
1.4 数据处理
试验数据用Office Excel 2010和Office Word进行处理,用SPSS 20.0软件对数据进行相关性分析,用Origin 7.5软件进行作图。
2 结果与分析
2.1 不同植被样地土壤养分的季节变化
有机质以及氮、磷、钾含量是土壤肥力和环境质量状况的指标,也是环境恢复过程中土壤微生物和植物生长发育的重要营养源,土壤养分含量的变化对喀斯特地区不同植被恢复及生态重建均有重要的影响[26-30]。
在本研究中,4种不同植被调查样地土壤有机质和氮磷钾含量的季节变化情况见表4至表7。如果从土壤有机质含量年均值比较,不同植被样地土壤有机质含量表现为阴 香>青檀>阴香+青檀>类芦,其中,青檀样地与阴 香+青檀混交样地的土壤有机质含量年均值差异很小。在不同月份土壤有机质含量的比较中,除类芦样地外,其他3种不同植被样地的土壤有机质含量均为5—8月较高。从表5可以看出,不同植被样地土壤氮含量差异明显,土壤全氮含量年均值表现为阴香+青檀>阴香>青檀>类芦;土壤碱解氮含量年均值表现为阴香>阴香+青檀>青檀>类芦;除类芦样地外,其他3种不同植被样地土壤夏秋季节的土壤含氮量较高(类芦样地春夏秋季节相对较高)。从表6可以看出,从土壤磷含量的年均值比较可知,4种不同植被样地土壤全磷和速效磷含量均表现为阴香+青檀>青檀>阴香>类芦,但不同季节土壤磷含量的变化规律不明显。从表7可以看出,不同植被样地土壤全钾和速效钾含量年均值表现为阴香+青檀>青檀>阴香>类芦,土壤钾含量在2014年的11月至2015年的4月相对较高。
从表4至表7可以看出,不同植被样地土壤养分季节变化特征比较相似,其月际之间的变化呈单峰型或双峰型,峰值大多出现在7—9月和12月;有机质和氮元素含量的变化差异较小,且均以阴香或阴香+青檀样地较高;磷和钾含量的季节变化比较复杂,且变化幅度较大,出现峰值的时间不一致。由此可见,不同植被样地土壤营养物质含量的变化比较复杂,其影响因素及作用机制有待进一步研究。
2.2 不同植被样地土壤氨化细菌数量的季节变化
4种不同植被样地土壤微生物生理类群数量的测定结果(图1)表明,土壤氨化细菌的季节变化差异明显,氨化细菌数量的季节变化与微生物生理类群总数变化趋势相似:10—12月呈上升趋势,12—2月有所下降;2—4月除了类芦样地呈现下降趋势外,其余3种样地均呈上升态势,之后的4—8月则有升有降,呈现一定的波动态势,但总的趋势是下降的。4种不同植被样地的氨化细菌数量,除类芦样地12月最大外,其余3个样地均为6月最大;8月青檀样地与阴香+青檀混交样地的氨化细菌数量最少,阴香样地及类芦样地的氨化细菌数量则以10月最少;不同植被样地的土壤氨化细菌数量差异比较明显,其中阴香样地的最多,阴香+青檀混交及青檀样地次之,类芦样地最少;总体表现为夏季多,秋季少;在季节变化中呈三峰型或多峰型,说明不同植被土壤环境给予土壤微生物不同的生长条件,从而导致不同植被土壤微生物数量的差异。

表4 不同植被土壤有机质含量的季节变化
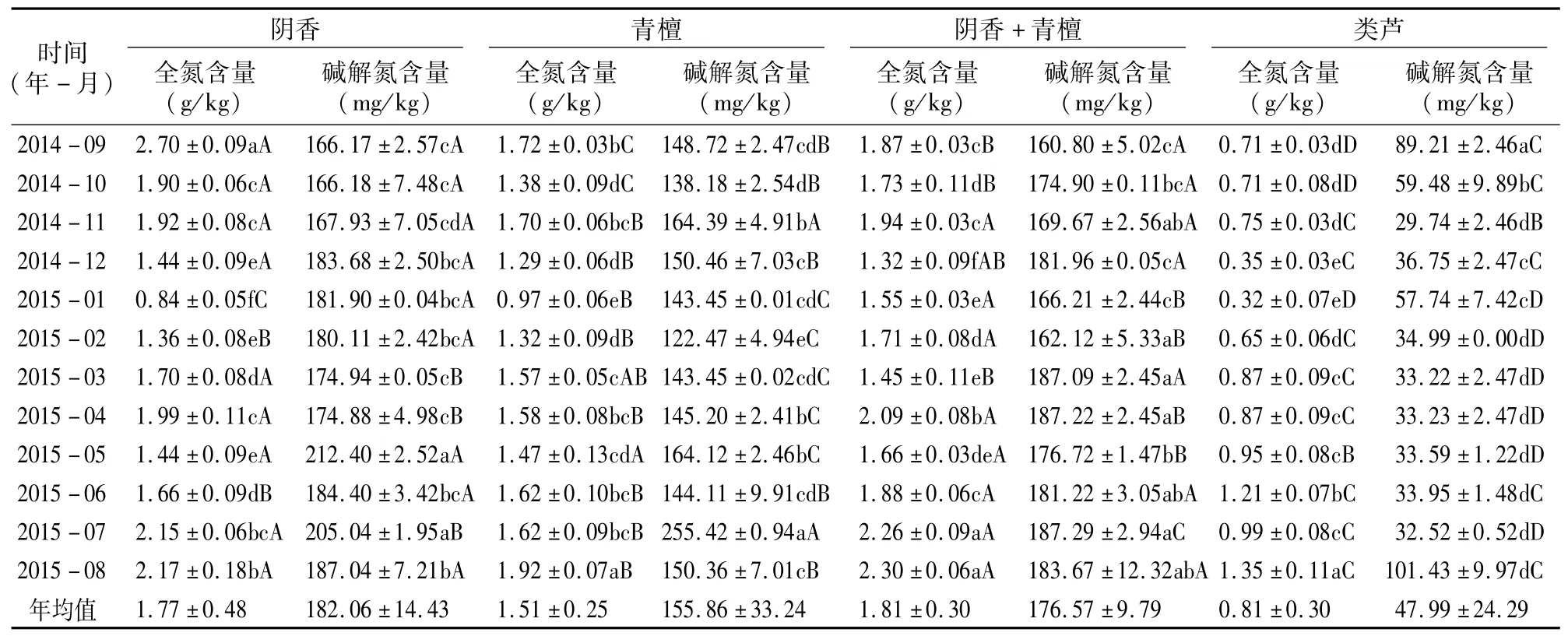
表5 不同植被样地土壤氮含量的季节变化
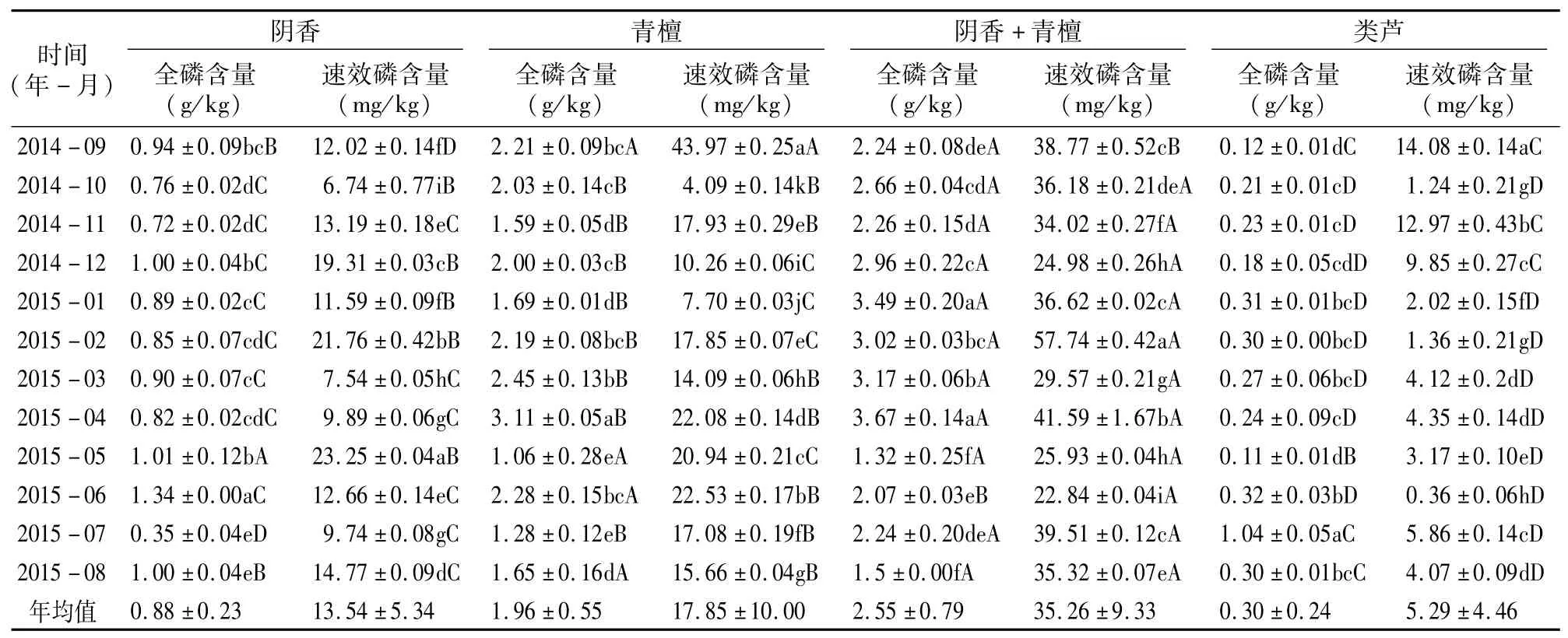
表6 不同植被样地土壤磷含量的季节变化

表7 不同植被样地土壤钾含量的季节变化
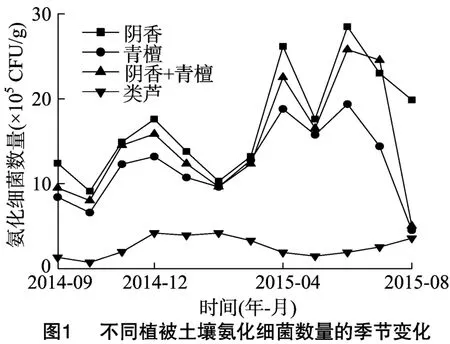
2.3 不同植被样地土壤固氮细菌数量的季节变化
在4种不同植被样地中,土壤固氮细菌数量季节变化的情况见图2。结果表明,固氮细菌数量的季节变化明显呈三峰型,峰值分别出现在12月、4月、7月。即10—12月数量上升,在12—2月数量下降,4月和7月随着气温升高而数量增加,7—8月数量又逐渐降至最低。在不同植被样地中,除阴香样地和阴香+青檀混交样地的固氮细菌数量在12月最高外,青檀样地和类芦样地在7月固氮细菌数量达到最大值,但各样地土壤固氮细菌数量的最小值都集中在8月;土壤固氮细菌数量在夏季和冬季较多,在春季和秋季较少;不同植被样地土壤固氮细菌数量表现为阴香>阴香+青檀>青檀>类芦;从土壤固氮细菌的数量来看,阴香是岩溶地区植被恢复的较好树种。
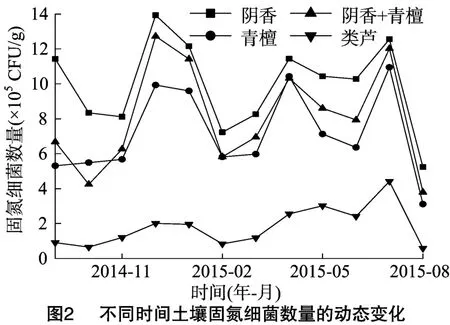
2.4 不同植被样地土壤硝化细菌数量的季节变化
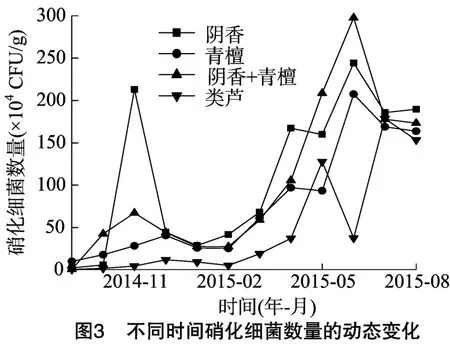
调查样地土壤硝化细菌数量季节变化的结果见图3。4种不同植被样地土壤硝化细菌数量的季节变化较明显,其变化趋势为先逐渐增加(9—11月)又逐渐下降(12—2月),后再增(3—6月)再降(7—9月)。除了优势种为类芦的样地外,土壤硝化细菌数量均在6月达到最大值(类芦样地土壤硝化细菌的数量在7月达到最大值),土壤硝化细菌数量的季节变化呈二峰型,最大峰值大多集中在6月,夏季硝化细菌数量较多,春秋季和冬季数量较少,除5月和6月之外,不同植被样地土壤硝化细菌数量大致情况表现为阴香>阴香+青檀>青檀>类芦。如果从硝化细菌的数量看,不同植被对土壤质量变化的影响,其结果为阴香的效果最好,阴香+青檀混交次之,青檀位列第3,类芦的效果最差。
2.5 土壤中微生物数量与土壤理化性质相关性分析
土壤微生物的数量变化与土壤理化性质关系密切,为了进一步说明不同植被样地土壤微生物生理类群与土壤理化性质的关系,有必要对其相关性进行比较分析。
2.5.1 阴香样地 从表8可以看出,在阴香样地中,除了氨化细菌数量与硝化细菌数量、速效钾含量与土壤含水量、碱解氮含量与土壤有机质含量均呈极显著正相关,以及土壤全钾含量与全氮含量呈显著负相关外,土壤固氮细菌数量和硝化细菌数量与其他土壤理化因子的相关性均不显著,其原因有待进一步分析。
2.5.2 青檀样地 从表9可以看出,在青檀样地中,氨化细菌数量与固氮细菌数量呈显著正相关;硝化细菌数量与土壤pH值、土壤电导率呈极显著负相关,与土壤有机质含量呈显著正相关;全磷含量与有机质含量呈显著负相关;速效钾含量、有机质含量与土壤pH值呈显著正相关或负相关,土壤有机质含量与电导率呈极显著负相关;全钾含量与速效钾含量、pH值与电导率呈极显著正相关,其他的相关性均不显著。
2.5.3 阴香+青檀样地 从表10可以看出,氨化细菌数量与固氮细菌数量、硝化细菌数量呈显著正相关,与电导率呈显著负相关;硝化细菌数量与土壤全磷含量、电导率呈显著负相关,与土壤有机质含量呈显著正相关,与土壤pH值呈极显著负相关;土壤全磷含量与pH值呈显著正相关,与土壤有机质含量呈显著负相关;速效钾含量与全磷含量、pH值均呈极显著正相关。值得注意的是,氨化细菌数量、固氮细菌数量、硝化细菌数量与其他土壤理化因子的相关性并不显著。
2.5.4 类芦样地 从表11可以看出,固氮细菌数量与土壤全磷含量呈显著正相关;硝化细菌数量与全氮含量、全磷含量呈显著正相关,与土壤有机质含量、pH值分别呈显著负相关或极显著负相关;土壤全氮含量与有机质含量、pH值均呈极显著负相关;土壤有机质含量与pH值呈显著正相关;其他土壤理化因子之间的相关性不显著。

表8 阴香样地土壤微生物数量与土壤理化性质的相关性分析结果

表9 青檀样地土壤微生物数量与土壤理化性质的相关性分析结果
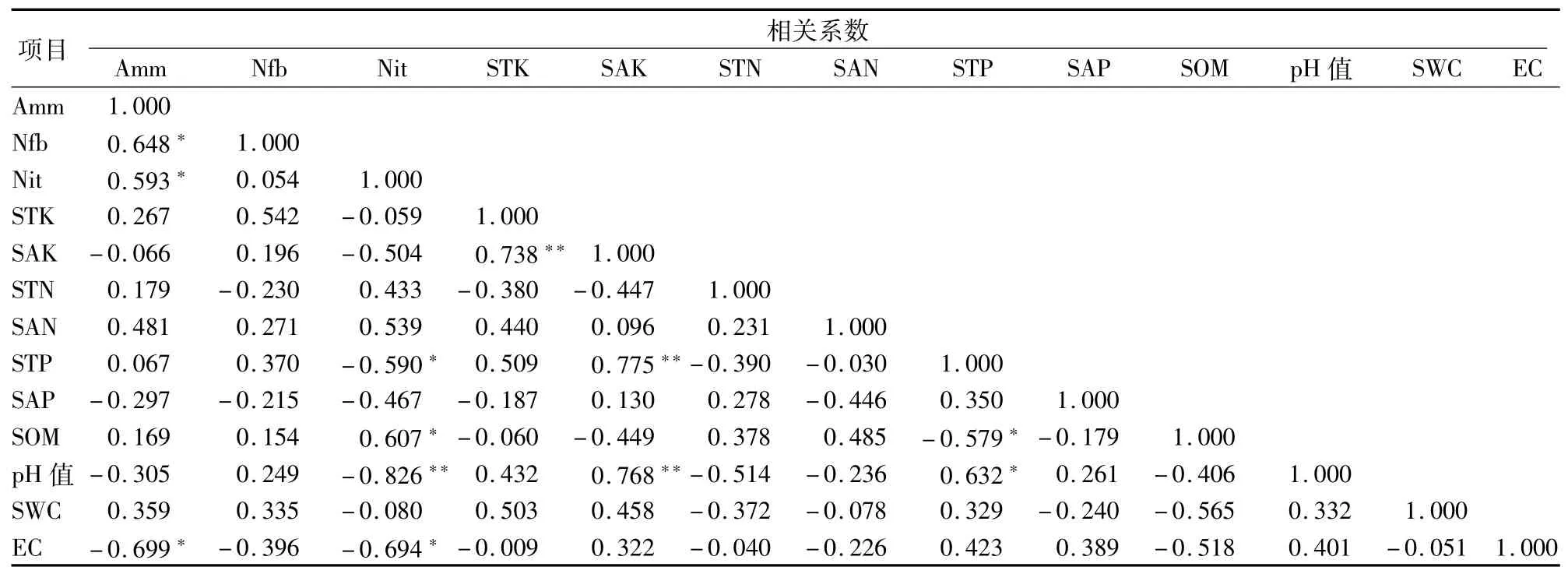
表10 阴香+青檀混交样地土壤微生物数量与土壤理化性质的相关性分析结果
2.6 主成分分析
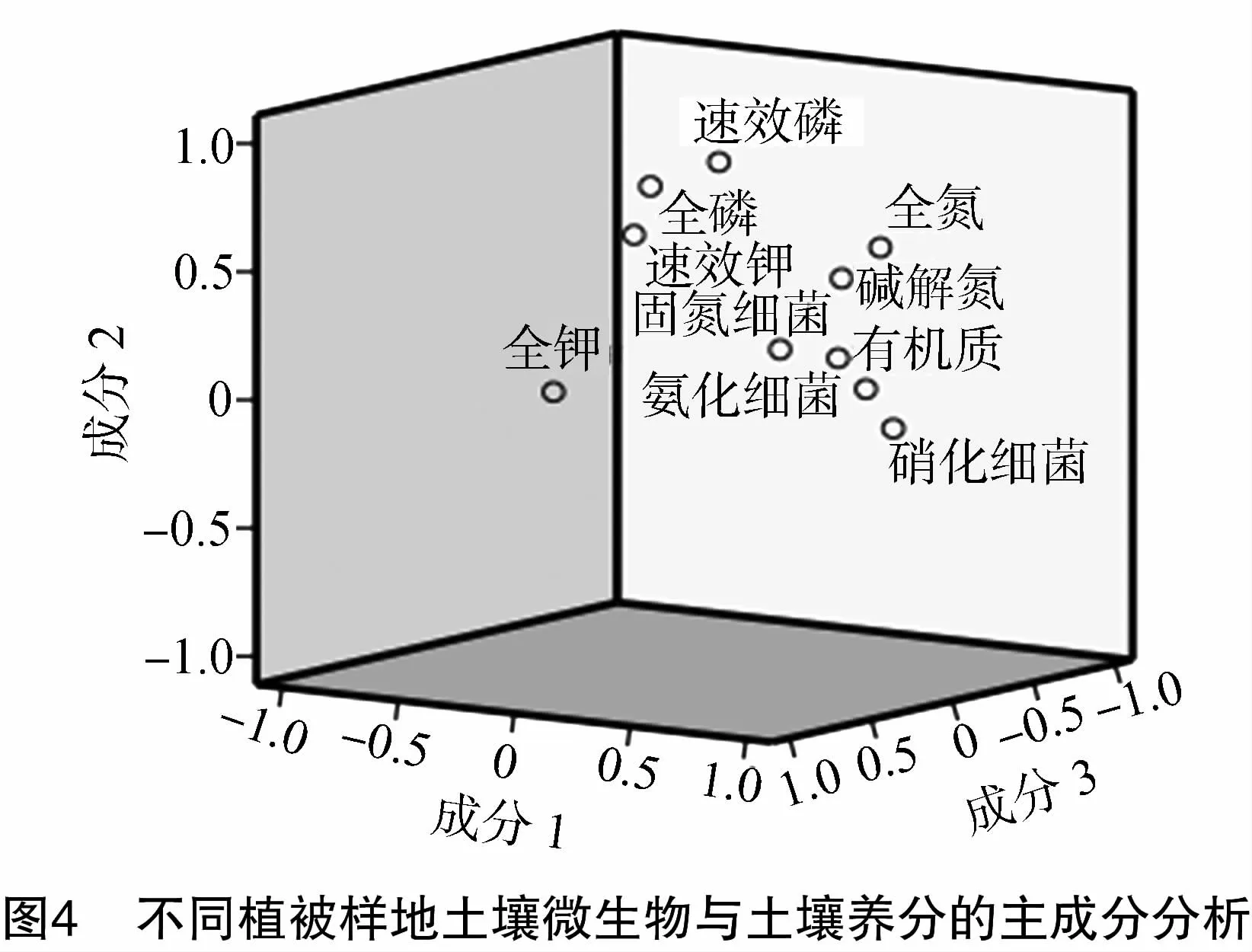
为进一步说明不同植被样地土壤微生物与土壤理化性质的关系,可以通过主成分分析的方法,根据不同植被样地土壤微生物生理类群的数据和土壤氮磷钾及有机质含量测定值在不同样地的得分情况,找出对土壤质量变化影响较大的理化因子,结果见表12。根据有关原则(特征值>1),提取出成分1(PC1)、成分2(PC2)、成分3(PC3)等3个主成分,其特征值分别为5.030,1.876,1.061,相应的方差贡献率分别为50.304%,18.756%,10.614%,总体方差贡献率为79.674%。从表12、表13可知,PC1由氨化细菌数量、固氮细菌数量、硝化细菌数量、全氮含量、碱解氮含量、有机质含量组成,贡献率达50.304%,PC2由全磷含量、速效磷含量、速效钾含量组成,贡献率为18.756%,PC3则由全钾含量组成,贡献率为10.614%。从图4可以看出,各样地散点的密集程度反映了各样地土壤微生物数量和理化性质的相似度。通过主成分分析可以得到调查样地土壤微生物和土壤理化性质对不同植被样地的贡献水平。
表11 类芦样地土壤微生物数量与土壤理化性质的相关性分析结果
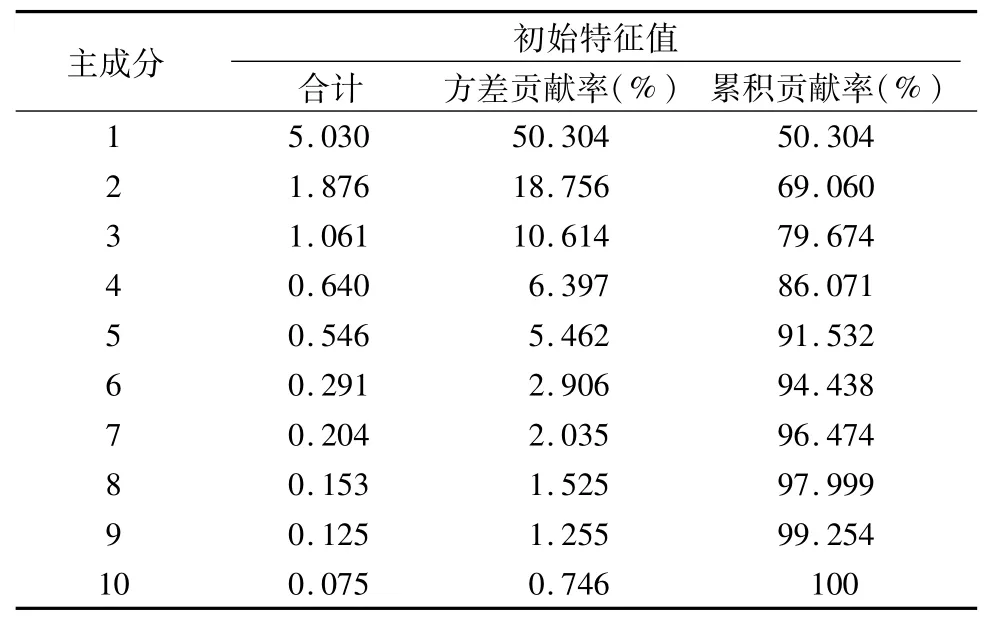
表12 主成分的特征值和贡献率
3 讨论与结论
在植物群落演替和土壤质量演变的过程中,植物与土壤相互作用,相互影响,土壤微生物是土壤肥力的重要构成要素,在土壤生态系统物质循环和能量流动中具有重要的作用。从不同植被土壤微生物生理类群数量的差异,土壤微生物数量与土壤有机质以及土壤氮、磷、钾含量的相关性等因素来看,土壤微生物数量的变化与土壤理化性质存在密切关系,也从侧面反映了不同植被对土壤质量变化的影响。
在不同植被调查样地中,土壤氨化细菌、固氮细菌和硝化细菌等3类微生物生理群虽然数量差异较大,季节变化明显,但变化趋势相似,不同植被样地的3种不同微生物生理类群数量均表现为阴香>阴香+青檀>青檀>类芦的分布特点;在同一样地中,3种不同微生物生理类群数量表现为氨化细菌>固氮细菌>硝化细菌;氨化细菌、硝化细菌数量峰值出现在6月、7月,即最高峰出现在夏季。因为盛夏季节的土壤温度较高,降水量较大,土壤含水量较高,因此是土壤微生物繁殖和植物生长最活跃的季节。由于水热状况的季节性变化,不同微生物生理类群数量的变化规律虽然不完全相同,但是,高温和湿润的季节,土壤微生物生物量通常有增高的趋势,这与胡延杰等研究结果[31]相似。固氮细菌数量的峰值出现在12月,可能是因为秋季有大量凋落物富集地表,经过土壤动物和微生物的作用,凋落物分解使各种营养元素逐渐回归土壤,土壤微生物获得较为丰富的营养物质供应,因而数量有所增加。春秋季节土壤微生物数量下降,可能是因为春秋季降水较少,土壤温度较低,所以不太适合土壤微生物的生长和繁殖,从而导致其数量有所减少。从相关性分析和主成分分析结果可知,土壤微生物生理类群数量的变化,不仅受到温度及大气降水的影响,与季节变化有一定的关系,还与植被类型、土壤理化特性、地形地貌等诸多因素有关。在不同植被调查样地中,3种土壤微生物生理群数量均表现为氨化细菌>固氮细菌>硝化细菌,这与邢肖毅等的研究结果[32-33]相似。土壤有机质中含有丰富的营养物质,能够为植物和土壤微生物的生长繁殖提供充足的能源;氮是构成蛋白质的重要元素,是生物蛋白质合成的重要物质基础;磷是生物细胞膜的重要组成成分,对物质运输也有重要作用,而且由于在全球生物地球化学循环中,磷的循环属于沉积型循环(不完全循环),所以地表中的磷含量通常都比较低,因而磷是植物和微生物生长繁殖的重要制约因子;钾离子对生物细胞之间的物质交流和信息传递具有重要作用,在桂西北岩溶地区,土壤全钾含量相对较高(2.60~8.99 g/kg),因此,土壤微生物生理群数量与土壤含氮、含磷、速效钾、有机质含量具有明显的相关性,而与土壤全钾含量的相关性不明显,这与主成分分析的结果是一致的。但在不同植被覆盖的喀斯特岩溶地区,土壤微环境如何影响土壤氨化细菌、固氮细菌、硝化细菌等氮素转化细菌的数量和组成比例,相关问题还有待深入研究。此外,由于本研究所选用的微生物培养方法比较传统,用不同方法对土壤微生物数量进行研究,所得结果可能有一些差异,相关问题仍需进一步研究阐明。
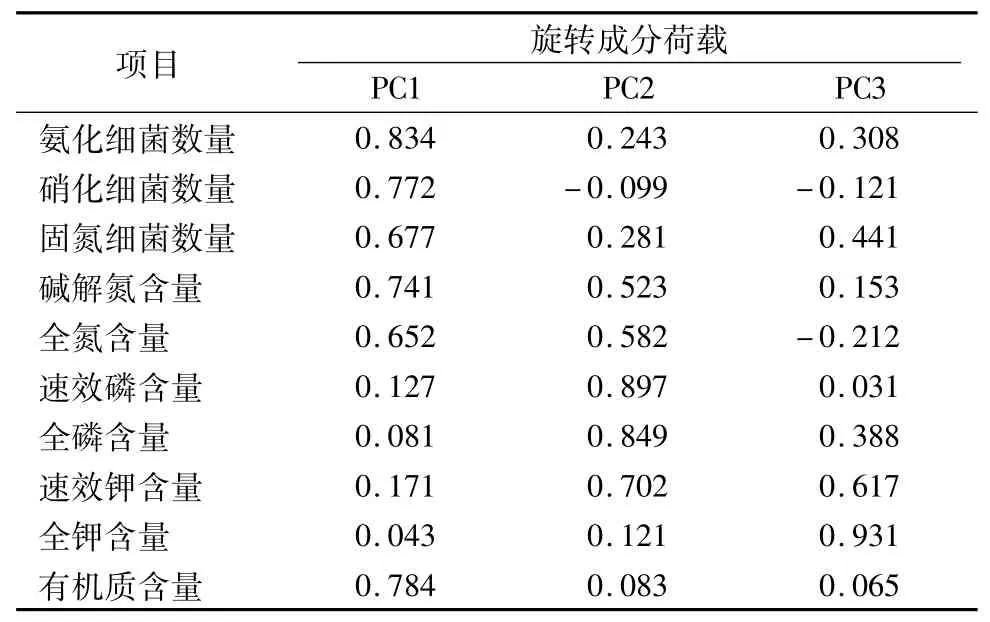
表13 主成分的旋转成分矩阵
不同植被调查样地土壤微生物生理群数量的季节差异明显,表现为双峰型、三峰型或单峰型,其中氨化细菌和硝化细菌的数量通常在夏季较多,而固氮细菌的数量则为冬季和夏季较多;土壤微生物生理群数量可以作为土壤质量变化的重要监测指标,综合考虑不同植被对土壤微生物的影响,以及土壤理化性质与土壤微生物生理类群数量的相关性,在桂西北岩溶地区进行植物恢复或石漠化治理时,应首先选择阴香(或阴香+青檀)作为先锋物种,其次可以考虑青檀,类芦是自然入侵的先锋种,可作为最后的选择。
