中国大鲵热激蛋白基因Hsp90的克隆及极端温度胁迫下的表达研究
2019-03-22李国勇许抗抗杨文佳骆建林
李国勇,许抗抗,杨文佳,骆建林,曹 宇,李 灿
(贵阳学院大学科技园/贵州省山地珍稀动物与经济昆虫重点实验室,贵州贵阳 550005)
热激蛋白(heat shock protein,简称Hsp)是细胞或生物体在受到外界环境的刺激(例如高温、干旱、饥饿、病原物侵入、重金属离子等)诱导后产生的一类应激性蛋白,它广泛存在于动物、植物和微生物体内[1-2]。Hsp可以促进蛋白质的正确折叠和组装,阻止变性蛋白聚体,从而将变性蛋白降解或重折叠,在维持生物体正常的生理代谢活动中起着重要作用。根据分子量大小、同源性和分子能可将热激蛋白分为6个家族,即 Hsp10、Hsp90、Hsp70、Hsp60、Hsp40和 分 子 量 小Hsp等[3]。
Hsp90蛋白的分子量约为82~90 ku,它是生物体内最丰富的蛋白质之一,在正常情况下约占胞质蛋白的1%~2%。Hsp90家族高度保守,其蛋白质包含3个结构域:N-端保守ATP(腺嘌呤核苷三磷酸)结合结构域、中间结构域和C-端多肽结合结构域。Hsp90具有多种生物学功能,它不仅参与热害、干旱、高盐等胁迫响应,还可以参与组装、稳定和激活转录因子、激素受体以及蛋白激酶等关键信号蛋白[4]。目前,关于HSP90基因的研究多集中于昆虫,已有多种昆虫的Hsp90基因被克隆鉴定。研究发现,这些基因在应对极端温度、重金属离子以及杀虫剂等各类非生物逆境胁迫中发挥着关键作用[5-11]。
中国大鲵(Andrias davidianus)俗称娃娃鱼,属于两栖纲(Amphibia)有尾目(Caudata)隐鳃鲵科(Cryptobranchidae)大鲵属(Andrias),是现存个体最大的两栖动物,为中国珍稀、濒危物种,是国家二级保护动物,已被列入濒危野生动植物种国际贸易公约(简称CITES公约)附录Ⅰ中[12-15]。由于大鲵具有极高的营养价值、经济价值和科研价值,其养殖在中国华中、西南及西北等地区迅速发展,并逐步形成了适度规模化的地方优势特色。但是受到近几年来全球气候变暖的影响,极端天气也频繁出现,对大鲵免疫系统的正常运行产生了严重影响,从而导致大鲵疾病的频发。
本研究以高温、低温2种极端温度胁迫下的大鲵为研究对象,分别克隆获得CgHsp901、CgHsp902这个2个基因的全长序列,分析不同组织中这2个基因的表达变化,试图了解该基因在大鲵应对极端温度胁迫中所发挥的作用,为深入开展大鲵繁殖与疾病预防研究奠定基础。
1 材料与方法
1.1 材料准备与高温处理
大鲵幼体来源于贵州省大鲵养殖基地,挑选平均体质量为250~300 g的幼体大鲵,用长25 cm、宽10 cm、高13 cm的塑料盆饲养在温度分别为0、5、15、20、25℃的人工培养箱中,每个温度梯度饲养1盆共4尾幼体大鲵,饲养时间分别为24、48 h。为了模拟大鲵的洞穴生存环境,培养箱内不开光照灯,试验重复3遍。处理完成后,统计各温度下大鲵幼体的存活率,对大鲵的心脏、肝脏、胃、脾、肌肉、皮肤和肠道7个不同组织进行取样。样品取出后马上放入液氮中冻存,然后置于-81℃冰箱中保存备用。
1.2 主要试剂
TRIzol试剂(TRIzol Regent,Invitrogen公司);反转录试剂盒(PrimeScript RT Reagent Kit,TaKaRa公 司);Taq酶(TaKaRa公司);胶回收试剂盒(Gel Extraction Kit,Omega公司);载体(pCEM-T EasyVector,Promega公司);感受态细胞DH5α(北京全式金公司);qPCR试剂(Go Taq qPCR Master Mix,Promega公司)。
1.3 试验方法
1.3.1 大鲵幼体组织总RNA的提取及第一链cDNA的合成根据TRIzol试剂盒说明书提取大鲵幼体组织的总RNA,用琼脂糖凝胶电泳和NanoDrop 2000核酸蛋白浓度测定仪检测总RNA的完整性和浓度。取1μg总RNA,按照反转录试剂盒的操作说明合成第一链cDNA,稀释2倍后保存于-20℃冰箱备用。
1.3.2 Hsp90基因全长cDNA的克隆 根据贵州省山地珍稀动物与经济昆虫省级重点实验室前期测定的大鲵转录组数据,利用NCBI(美国国立生物技术信息中心)站点的ORF(开放阅读框)Finder软件(http://www.ncbi.nlm.hih.gov/gorf/or-fig.cgi)对所获得的Hsp90基因进行分析,发现1个具有完整开放阅读框的cDNA序列,用Primer Premier 5.0软件设计特异性引物(表1)进行PCR扩增。RT-PCR反应体系如下:2.5μL 10×PCR缓冲液,2.5μLMgCl2,2μL dNTPs,各1μL上下游引物,1.0μL cDNA,0.25μL Taq酶以及15μL ddH2O。

表1 引物相关信息
扩增条件如下:95℃预变性5 min;95℃变性30 s,56℃退火30 s,72℃延伸2.5 min,35个循环;72℃延伸10 min。PCR产物经1.5% 琼脂糖凝胶电泳检测后,利用Gel Extraction Mini Kit回收目的条带并连接至pGEM-T Easy载体上,再将其转化到DH5α大肠杆菌感受态细胞中,经蓝白斑筛选和PCR鉴定后进行测序验证。本试验中所用引物和DNA测序由成都擎科生物技术有限公司完成。
1.3.3 序列分析 利用DNAMAN 6.0(Lynnon Biosoft)对测序结果进行编辑和分析,并采用BLAST(http://www.ncbi.nlm.gov/BLAST/)工具进行同源性比对分析。利用在线数据库Prosite(http://prosite.expasy.org/)分析保守区域。利用ProtParam(http://web.expasy.org/)和NetNGlyc 1.0 server(http://www.cbs.dtu.dk/services/NetNGlyc/)推测该氨基酸序列的理化性质和N-糖基化位点。
1.3.4 Hsp90基因在温度胁迫下的相对表达量 采用实时定量PCR技术检测不同温度胁迫后幼体大鲵Hsp90基因的相对表达量。根据“1.1”节的方法,用不同温度处理大鲵,分别取7个组织,提取总RNA并反转录合成cDNA用于实时定量PCR,每个处理设4次重复。使用在线软件Primer 3.0(http://frodo.wi.mit.edu/)设计定量PCR引物,内参基因选取EF1α基因,引物序列信息见表1。PCR反应体系如下:10μLGo Taq qPCR Master Mix、1μL cDNA、7μL nucleasefreewater(去核酸酶的水)和各1μL上下游引物,混匀,轻微离心,放入CFX96TM Real-Time System实时定量PCR仪(Bio-Rad)中进行扩增,反应条件如下:95℃预变性2 min;95℃变性15 s,60℃退火30 s,72℃延伸30 s,共40个循环;于60~95℃进行熔解曲线分析以保证反应的特异性。用2-ΔΔCT方法计算目的基因的相对表达量[16]。
1.4 数据分析
采用SPSS 17.0软件进行数据分析,应用单因素方差分析(ANOVA)对不同温度胁迫后大鲵幼体的存活率及其体内Hsp90基因的相对表达量进行差异显著性分析。
2 结果与分析
2.1 中国大鲵CgHsp901、CgHsp902基因的cDNA克隆及序列分析
采用RT-PCR技术,从中国大鲵体内克隆了热激蛋白90基因,命名为CgHsp901、CgHsp902。CgHsp901基因cDNA全长为2 619 bp,开放阅读框为2 388 bp,编码795个氨基酸;CgHsp902基因cDNA全长3 024 bp,开放阅读框为2 184 bp,编码727个氨基酸。2个基因都具有Hsp90家族特有的标签序列,与其他两栖动物等物种的Hsp90有较高的同源性。2个基因的理论分子量都为90 ku,等电点分别为4.81、5.32。由CgHsp901推导的氨基酸序列包含Hsp90家族的4个签名序列:第95~124位的NKEIFLRELISNSSDALDKIR、第161~169位的LGTIAKSGT、第403~412位的IKLYVRRVFI、第429~433位的GVVDSDDLPLNISRE(图1)。由CgHsp902推导的氨基酸序列包含Hsp90家族的5个签名序列:第39~59位 的 NKEIFLRELISNSSDALDKIR、第 106~114 位 的LGTIAKSGT、第129~145位的MIGQFGVGFYSAYLVAE、第336~345 位 的 IKLYVRRVFI、第 362~376 位 的GVVDSEDLPLNISRE,以及氨基酸C-端末尾基序MEEVD(图2)。利用NetNGlyc 1.0 server进行分析可知,CgHsp901存在5个N-糖基化位点,分别为N143、N253、N477、N543和N548;而CgHsp902存在4个N-糖基化位点,分别为N150、N386、N492和N717。
2.2 2个基因在不同温度胁迫下的应激表达

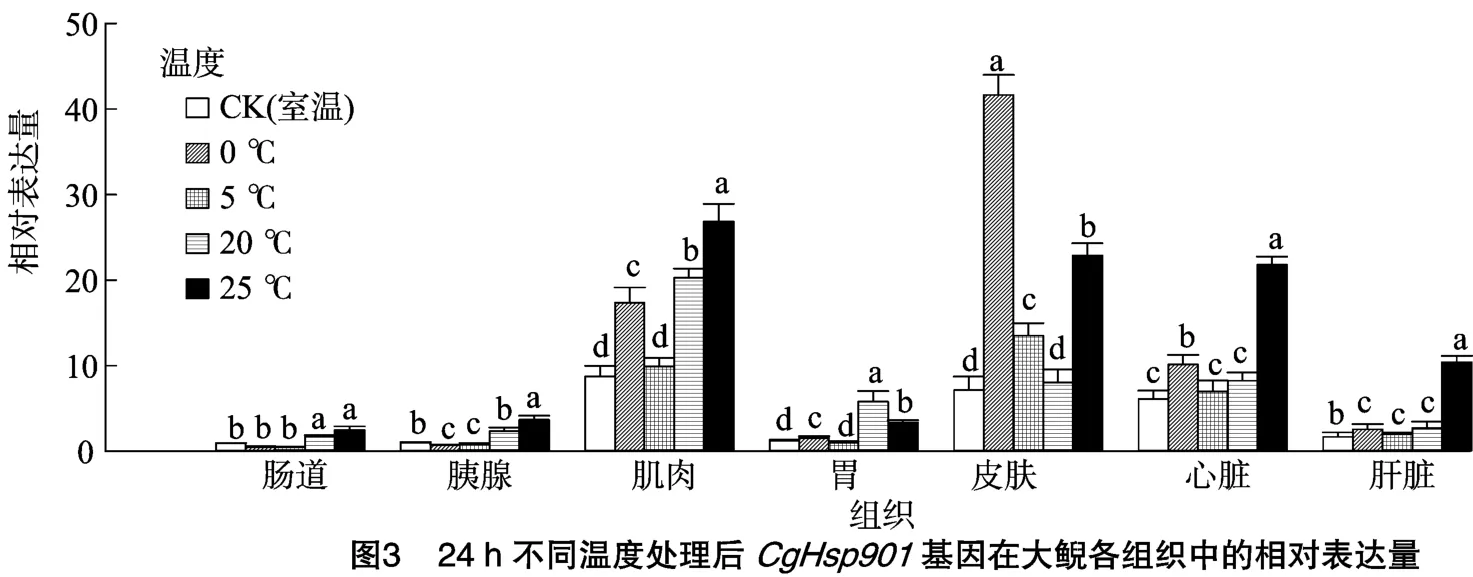
利用实时荧光定量PCR(RT-qPCR)检测这2个基因在中国大鲵心脏、肝脏、胃、胰腺、肌肉、皮肤和肠道7个不同组织中低温(0、5℃)和高温(20、25℃)胁迫下mRNA表达量的差异,结果显示,大鲵幼体经低温处理24、48 h后,CgHsp901 mRNA的相对表达量在肠道、胰腺、胃和肝脏中不高,甚至在胰腺和肝脏中的部分表达量显著下调(图3、图4)。但在皮肤、肌肉和心脏组织中,CgHsp901 mRNA的相对表达量整体上显著升高。0℃处理24 h后,CgHsp901 mRNA在皮肤中的相对表达量是同温度下肠道、胰腺中表达量的400倍,是肝脏组织中表达量的40倍;肌肉、心脏组织中CgHsp901 mRNA的相对表达量同样升高,但是只有对照组的1~2倍。当处理温度升高到5℃后,CgHspP901 mRNA在皮肤、肌肉和心脏组织中的表达量较0℃处理时显著下降。
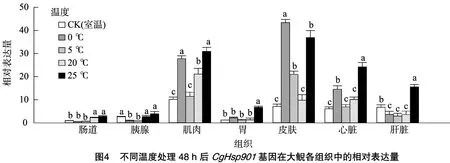
另外,当大鲵幼体处于20、25℃高温胁迫时,该基因在大部分组织中的mRNA相对表达量都上调。其中在25℃高温处理后,其在肌肉、胃、皮肤、心脏和肝脏中的表达量显著上调。另外,对图3、图4比较可以看出,随着处理时间的延长,CgHsp901基因的mRNA相对表达量没有明显升高,说明处理时间长短不影响CgHsp901基因的表达。以上结果说明,高温、低温胁迫能够显著诱导CgHsp901基因在大鲵体内表达,且mRNA表达量与胁迫程度成正比。
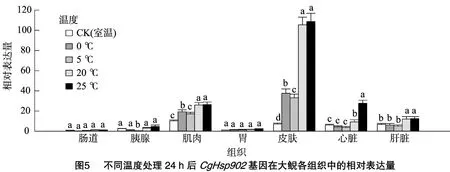
本研究对CgHsp902基因同样进行了低温(0、5℃)和高温(20、25℃)胁迫处理,结果显示,CgHsp902基因在肠道、胰腺和胃组织中的相对表达量明显低于其在肌肉、皮肤、心脏和肝脏组织中的表达量。与CgHsp901基因一样,CgHsp902基因在低温、高温胁迫下在皮肤、肌肉、心脏和肝脏中的mRNA相对表达量整体表现为显著升高,而且表达量比CgHsp901基因高(图5、图6)。这同样说明,高温、低温胁迫能够显著诱导CgHsp901基因在大鲵体内的表达,且mRNA表达量与胁迫程度成正比。
3 讨论
大鲵喜栖息于山涧水深、水质清凉、泥潭水流急湍及岩石空洞较多的山溪中,对温度变化非常敏感,栖息地气候温凉湿润,年平均气温为12~17℃,最冷月平均气温2℃以上,最热月平均气温在27℃以下,低温和高温暴露都可能造成其感染病菌,甚至死亡,从而影响种群发展[12]。本试验发现,在0、5℃的低温及20、25℃高温下分别处理24、48 h后,并未发现大鲵死亡。在温度胁迫下大鲵只是将胃中内容物吐出,低温时不吃不动,高温时则到处游荡。从这个结果可以看出,大鲵对短时低温或高温环境有较强的适应性。
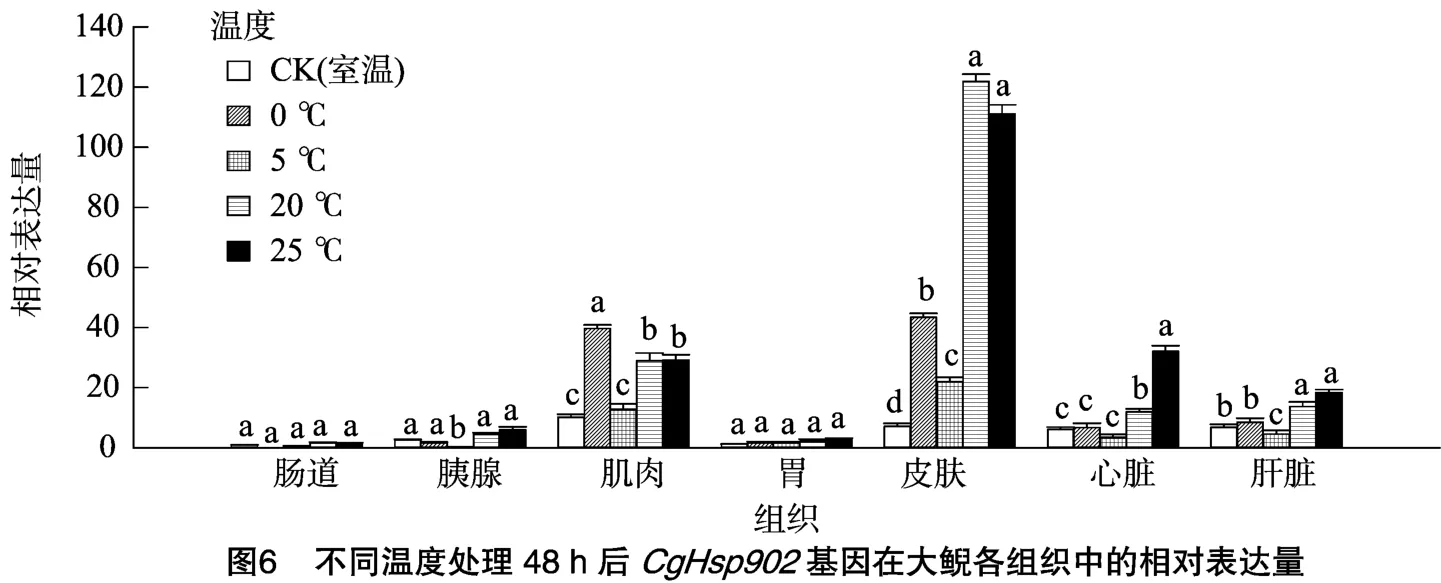
热激蛋白可以分为组成型热激蛋白和诱导型热激蛋白。组成型热激蛋白在正常生理条件下的细胞中就大量存在,高温等刺激不会诱导其大量表达,大多与维持细胞基本生理功能和形态建成密切相关,而诱导型热激蛋白在正常生理条件下不存在或表达量低,但在高温等逆境刺激下能被强烈诱导表达,具有保护细胞的功能。热激蛋白90在海洋鱼类适应海水温度变化以及体内外渗透压变化等不利条件方面起着重要的作用。热激蛋白不仅是热胁迫时大量表达的蛋白,也是其他环境胁迫时大量表达的蛋白,如低温、干旱、高渗透压及重金属等环境因素都能促使生物体表达热激蛋白。在很多昆虫种类中,Hsp90得到了大量的研究。然而有关大鲵热激蛋白方面的研究很少,关于大鲵Hsp90的热激蛋白基因家族中Hsp90B1、Hsp90AA1基因的研究几乎未见报道。本试验利用RT-PCR技术克隆了大鲵的Hsp90 cDNA片段,为进一步明确低温和高温胁迫与Hsp90基因表达量之间的相互关系奠定了基础。本试验克隆出的CgHsp901、CgHsp902在正常条件下检测到少量存在于肌肉、皮肤、心脏和肝脏中,而当大鲵在0℃或25℃下胁迫24、48 h后,2个基因在皮肤中的表达量与对照组相比分别上升了5、20倍,说明这2个基因诱导表达的都是诱导型热激蛋白。而大鲵在低温、高温的长时间胁迫下能够全部存活,很可能是皮肤中CgHsp901、CgHsp902基因上调,在抵抗低温和高温胁迫过程中发挥了重要作用,也可以说明在遇到温度胁迫时皮肤是抵御其影响的第一道屏障。另外肌肉、心脏和肝脏组织在低温和高温胁迫下CgHsp901、CgHsp902基因的相对表达量也高于对照组,并且它们的平均值都显著高于肠道、胃和胰腺组织中的相对表达量。这说明前三者在应对温度胁迫的时候也发挥了一定的作用,而后面3个组织则不起作用。
