不同超声处理时间对鸡血血浆蛋白物化性质和结构的影响
2019-03-22张新笑李鹏鹏王道营徐为民
杨 恒,盛 伟,张新笑,李鹏鹏,王道营,邹 烨,徐为民
(1.南京财经大学食品科学与工程学院,江苏南京 210023;2.江苏省农业科学院农产品加工研究所,江苏南京 210014)
动物血浆年产量大,营养丰富,血浆中含有纤维蛋白、白蛋白、球蛋白以及其他少量脂蛋白、糖蛋白等[1-3],而血浆中的蛋白质总称为血浆蛋白[4]。血浆蛋白中含有人体所需的18种氨基酸,其中包括8种必需氨基酸,其中赖氨酸(Lys)可达6.50%以上[5],血浆蛋白中含有丰富的矿物质,磷含量约占血浆蛋白粉总量的1.78%,钙含量达到0.20%,铁含量达到78 mg/kg[6],另外,血浆蛋白中还含有较多的促生长因子、干扰素、激素、溶菌酶等其他功能成分[7]。
我国每年的肉鸡屠宰量达10亿多羽,鸡血来源丰富。鸡血中含大量蛋白质、氨基酸、微量元素、维生素、酶类和其他生物活性物质,而脂肪和糖类含量较低,其中含干物质17.90%、矿物质5.90%(大部分为铁)、必要元素2.30%、磷0.56%[8-9],而鸡血细胞中必需氨基酸含量在畜禽动物中最高,但目前对鸡血的研究较少,而且大量的鸡血作为废弃物排放,造成资源浪费和环境污染。
本研究旨在通过测定不同超声处理时间下鸡血浆蛋白的多种理化特性,全面分析超声作用对血浆蛋白性质和结构的影响,为血浆蛋白的应用提供理论基础,使其在医药工业、食品工业和饲料工业等方面有更广阔的前景。
1 材料与方法
1.1 试剂与仪器
1.1.1 材料 鸡血浆蛋白冻干品:实验室自制。主要操作:取少量柠檬酸三钠饱和溶液加入现取鸡血血浆并搅拌均匀,后采用60 mL离心管分装,以3 000~3 500 r/min离心15 min,取上清液装入表面皿,用保鲜膜、橡皮筋封存,放入-40℃冰箱保藏。待样品完全冻结后放入冻干机42~45 h后取出即得到试验用血浆蛋白粉。
1.1.2 主要试剂 1-苯氨基-8萘横酸盐(ANS)、β-巯基乙醇(购自美国Sigma公司);Marker(购自上海源叶生物科技有限公司);磷酸氢二钠、磷酸二氢钠、氢氧化钠(购自西陇化工股份有限公司);考马斯亮蓝(购自南京建成生物科技有限公司);Tris、甘氨酸、十二烷基硫酸钠(购自南京荣胜达实验仪器有限公司);盐酸(购自扬州沪宝化学试剂有限公司)。
1.1.3 主要仪器 FL-4600荧光分光光度计,购自日本日立高新技术公司;UV-6100紫外/可见光分光光度计,购自上海元析仪器有限公司;T-25型数显匀浆机,购自德国IKA公司;M124A电子天平,购自意大利Bel公司;便携式pH计,购自美国奥豪斯公司;HJ-8(DF-1)集热式磁力搅拌器,购自常州国华电器有限公司;Jasco-715圆二色谱仪,购自日本Jasco公司;真空冷冻干燥机,购自德国Christ公司;Uni Cen MR冷冻离心机,购自德国Herolab公司;超声波细胞破碎仪,购自宁波新芝生物科技股份有限公司;多功能微孔板检测仪,购自美国Bio Tek公司;激光粒度分析仪(Nano-ZS 90),购自英国Malvern公司;超纯水机(Milli-Q),购自美国Millipore公司;Q20差式量热扫描仪,购自美国TA公司;JS-680C全自动凝胶成像分析仪,购自上海培清科技有限公司。
1.2 试验方法
1.2.1 不同超声时间试验用血浆蛋白粉制取 将未经超声处理的血浆蛋白粉20 g溶于400 mL双蒸水中获得5%溶液,分别将溶液经超声波细胞破碎仪用固定频率150 W 超声处理0、5、10、20、30 min,得到5种不同处理的样品。对不同超声时间的溶液表面皿封存,冻干得到蛋白粉备用。
1.2.2 血浆蛋白物化性质的测定
1.2.2.1 SDS-PAGE凝胶电泳测蛋白分子量及蛋白质种类
上样前处理:取20μL蛋白样品,加入5μL上样缓冲液(pH值8.8的0.06 mol/L Tris-HCl缓冲液、2.0% SDS、5.0% β-巯基乙醇、25.0%甘油、0.1%溴酚蓝)混合,于95℃条件下反应5 min,12 000 r/min离心5 min,取15~20μL处理后样品上样,同时制备12%分离胶和5%浓缩胶。采用分子量蛋白Marker(11~135 ku)作为对照。电泳缓冲液为0.025 mol/L Tris-HCl、0.192 mol/L甘氨酸、0.1% SDS,电泳先在电压80 V进行20~30 min,后在120 V电泳至条带与胶底面平行。电泳结束后,采用考马斯亮蓝R-250染色20~30 min,然后用脱色液(甲醇∶乙酸∶水=1∶1∶8)脱色,直至可清楚地辨别条带。
1.2.2.2 圆二色谱测蛋白质二级结构 采用圆二色谱仪测定样品溶液的近紫外圆二光谱变化。将制备的样品配制成浓度为0.5 mg/mL蛋白溶液,注入1 mm厚的样品池。设定圆二色谱仪参数为:扫描范围190~250 nm,扫描速度50 nm/min,光谱间隔1.0 nm。得到CD数据以平均椭圆率表示,采用CDPro软件进行二级结构分析。
1.2.2.3 荧光光谱 采用10 mmol/L磷酸盐缓冲液(pH值7.0)将样品溶液配制成蛋白浓度为0.2mg/mL。荧光光谱采用激发波长为290 nm扫描,测定的发射波长范围为300~460 nm,狭缝宽度均为2.5 nm。每个样品测定重复3次。
1.2.2.4 表面疏水性的测定 将样品配制成10 mg/mL的蛋白溶液,后采用0.01mol/L PBS缓冲溶液(pH值7.0)将样品液稀释1、2、4倍。取4.0 mL稀释后的蛋白溶液与20μL 80 mmol/L ANS磷酸盐缓冲液(0.1 mol/L,pH值为7.0)混匀,室温下放置2 min后测定荧光强度。设置参数为:激发波长371 nm,发射波长467 nm,扫描速率240 nm/min,狭缝宽度10 nm。得到数据以蛋白质质量浓度(mg/mL)对荧光强度作图,采用线性回归分析进行曲线拟合,直线斜率即是蛋白质的表面疏水性(H0)指数。
1.2.2.5 自由巯基含量测定 准确量取0.5 mL质量浓度为10 mg/mL的蛋白液样品,后加入2.50 mL Tris-Gly-8M Urea溶液和0.02 mL 4 mg/mL的DTNB溶液,迅速混合后于25℃反应25 min,波长412 nm下测定吸光度(D412nm),并以蒸馏水作空白对照。每个样品做3次平行试验,最终结果取其平均值,并按公式(1)进行计算:
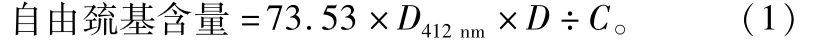
式中:73.53=106/(1.36×104),1.36×104为Ellman试剂的摩尔消光系数;D412nm为波长412 nm下所测得的吸光值;C为蛋白质样品的质量浓度,单位为mg/mL;D为稀释因子,在游离巯基测定中D值取为6.04。
1.2.2.6 差式扫描量热 取样品3~6 mg用差示量热扫描仪(DSC)进行扫描,扫描温度为室温至20℃,扫描速度为5℃/min(程序升温),所有的测定都要在氮气环境下进行。最大变性温度(Tmax)用Ver 1.2 N Software(TA Instruments)分析。
1.2.2.7 粒径分布 超声处理和未超声的血浆蛋白粒度分布采用Nano-ZS90激光粒度仪进行测定,介质为蒸馏水,折射率为1.361,测定时以蒸馏水为背景。设置物质折射率为1.52,加入样品至遮光率达10%~20%后,进行信息采集。每个样品平行采集3次,取平均图谱。
1.2.2.8 Zeta电位分析 Zeta-电位(ζ,mV)也用Nano-ZS90激光粒度仪来测定。采用超纯水将蛋白质溶液稀释成0.5%(质量分数),加入样品电位测量池测量。ζ是通过电导迁移率(UE)采用激光多普勒测速技术结合相分析光散射来计算。
1.2.2.9 扫描电镜 将超声处理和未超声的蛋白冷冻干燥后进行扫描电子显微镜观测。操作流程:将样品置于样品台,经离子溅射仪真空干燥、金粉喷镀后,调节电镜加速电压为20 kV,对样品进行观测摄图。
1.3 数据统计
上述所有试验均3次重复,结果表示为“平均值±标准差”。采用SPSS 18.0统计软件进行处理,Origin 9.0作图,采用组间ANOVA进行统计分析,Turkey检验用于组间数据分析,P<0.05表示两组间差异显著。
2 结果与分析
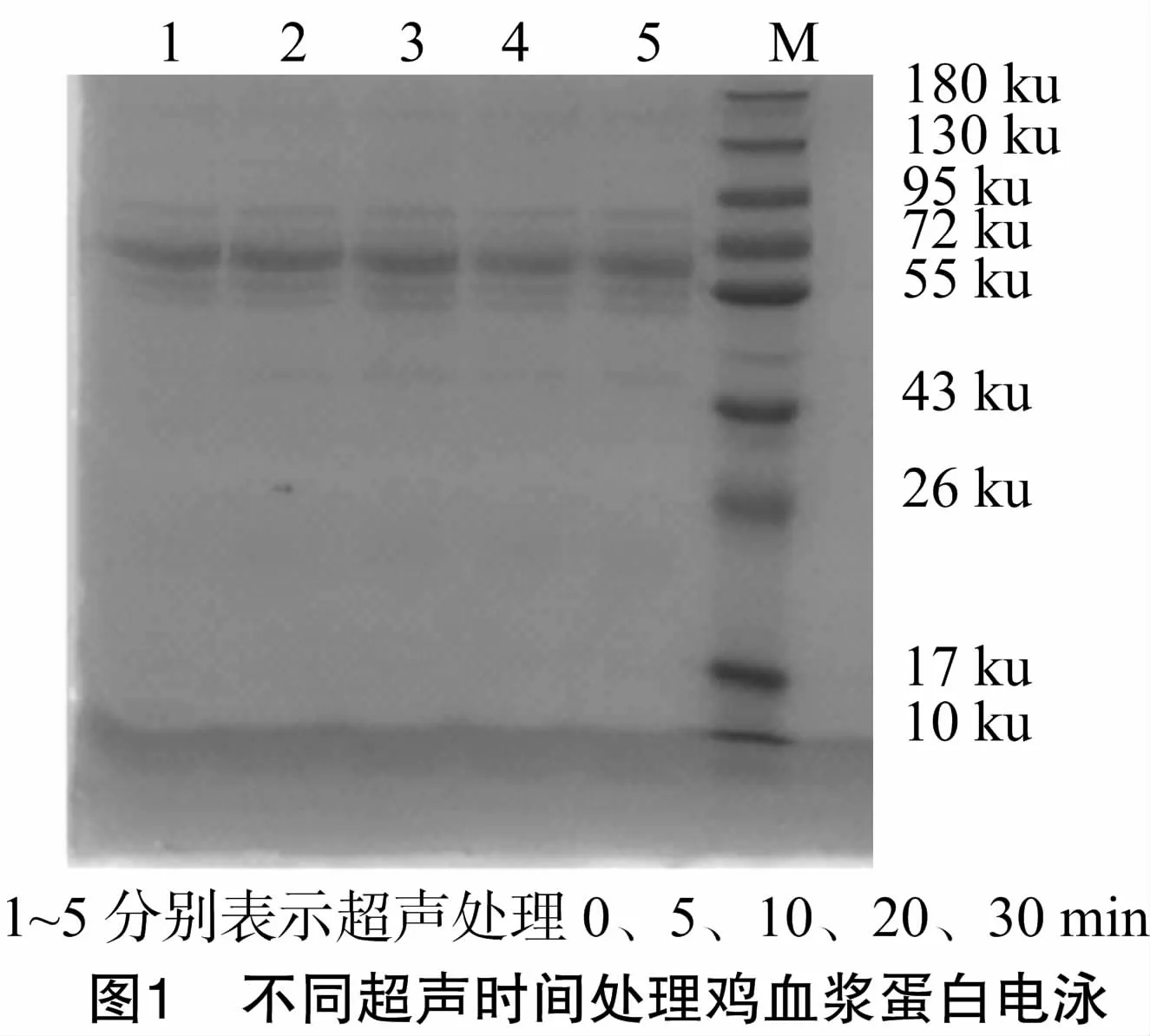
2.1 血浆蛋白凝胶电泳分析
将不同超声处理时间的鸡血血浆蛋白样品上样进行SDS-PAGE分析,检测并比较不同超声处理时间鸡对血浆蛋白亚基组成的影响。由图1可知,不同超声时间的鸡血浆蛋白条带其清晰度和数目均无明显差异[10],各鸡血浆蛋白的亚基分子量主要集中在43~95 ku,蛋白条带完整,无杂碎条带,该结果表明不同超声时间处理并未改变鸡血血浆蛋白的亚基组成[11]。
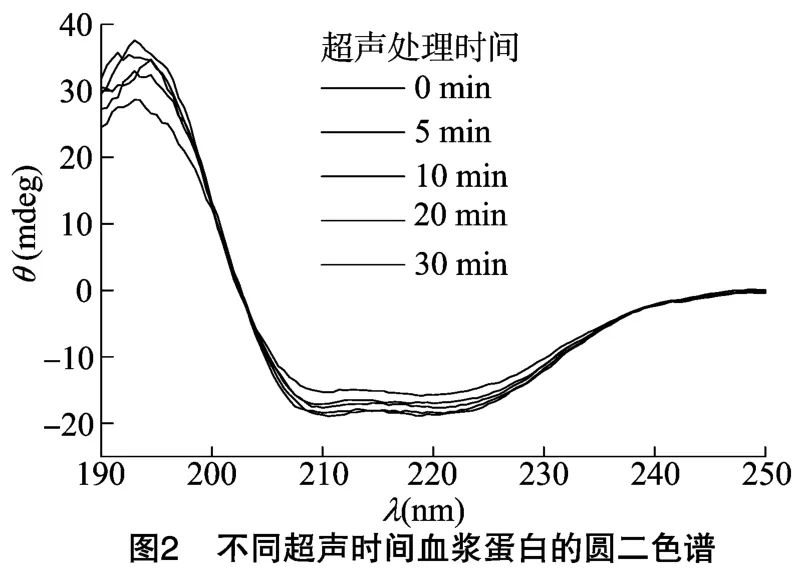
2.2 圆二光谱
圆二色性主要由肽键的电子跃迁引起,因此圆二色谱可反映蛋白质主链肽键的构象,其远紫外(190~250 nm)能够提供蛋白质二级结构(α-螺旋,β-折叠,β-转角和无规卷曲)含量信息[12-13],是检测蛋白质结构变化的重要指标,可根据远紫外圆二光谱来分析蛋白质的二级结构。由图2可知,鸡血浆蛋白在超声功率150W 下处理0、5、10、20、30 min,鸡血浆蛋白在209 nm和222 nm处有2个负峰,在193 nm处有1个正峰,这是典型的α-螺旋结构特征峰[14]。不同超声时间处理的蛋白其图谱几乎无改变,且α-螺旋含量大致相同,此结果与表1数据相符,说明本试验中不同的超声处理时间并没有破坏血浆蛋白的二级结构,这与王金梅等的结论[15]一致。β-折叠含量高则α-螺旋和β-转角含量低,β-折叠含量低则α-螺旋和β-转角含量高,而无规则卷曲几乎不变,这说明α-螺旋、β-转角和β-折叠之间存在着一种相互转化关系,维持一种动态平衡。
2.3 荧光光谱
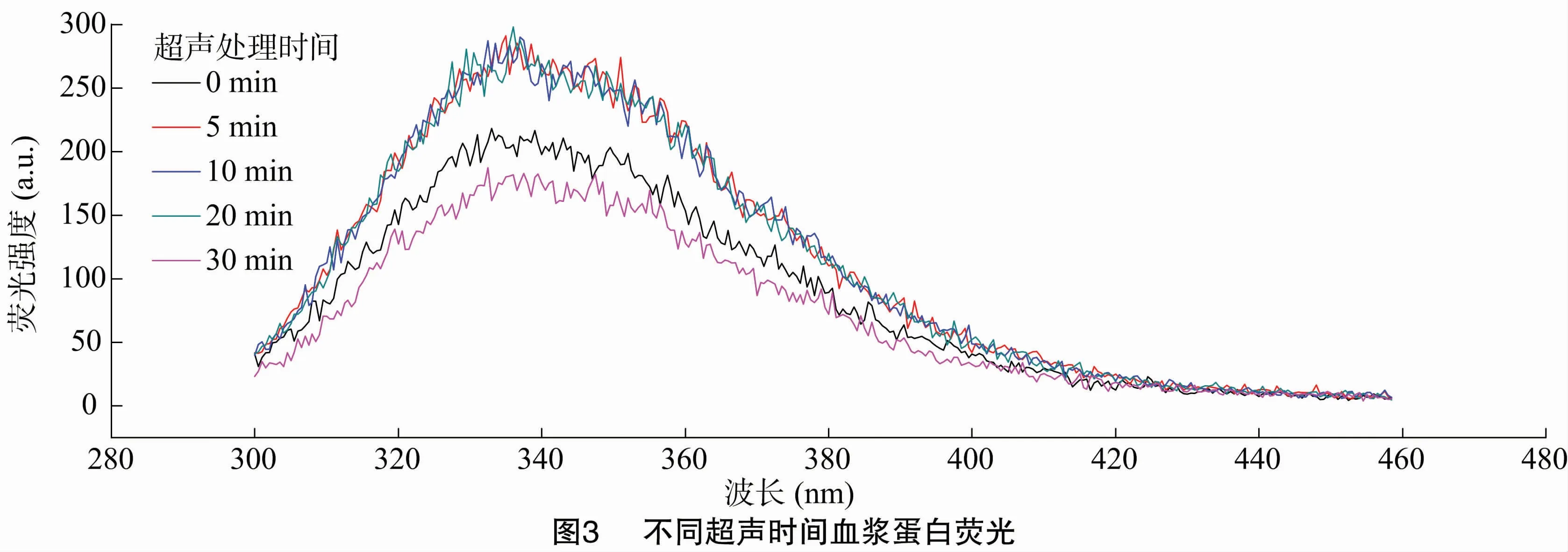
荧光光谱通过测定样品蛋白质中部分能产生荧光的氨基酸残基(色氨酸、酪氨酸、苯丙氨酸)可推测其蛋白构象的变化趋势,这是表征蛋白质分子构象发生变化的一种常用手段[16],通过荧光强度和峰位变化可反映蛋白质局部三级结构的变化[17]。由图3可知,鸡血浆蛋白的最大发射荧光强度在335 nm处改变,但不同处理时间鸡血浆蛋白的最大发射荧光强度波长位置基本不变,但是超声处理5、10、20 min的血浆蛋白荧光强度高于超声0 min血浆蛋白,这可能是由于鸡血浆蛋白经超声处理后,超声波产生的机械效应和空化效应使蛋白内部肽链伸展程度变大,暴露出部分掩埋于分子内部的疏水基团,从而荧光强度发生了增强[18]。贾俊强等通过超声处理麦胚清蛋白后其荧光强度发生明显增强[19],本结果与之一致。而超声30 min鸡血浆蛋白荧光强度明显下降且最大发射峰强峰位较对照组有较小程度的红移,这可能是由于蛋白质分子间作用力而发生了荧光猝灭作用[20]。该结果还说明不同超声处理时间可改变鸡血浆蛋白分子的高级构象[21]。
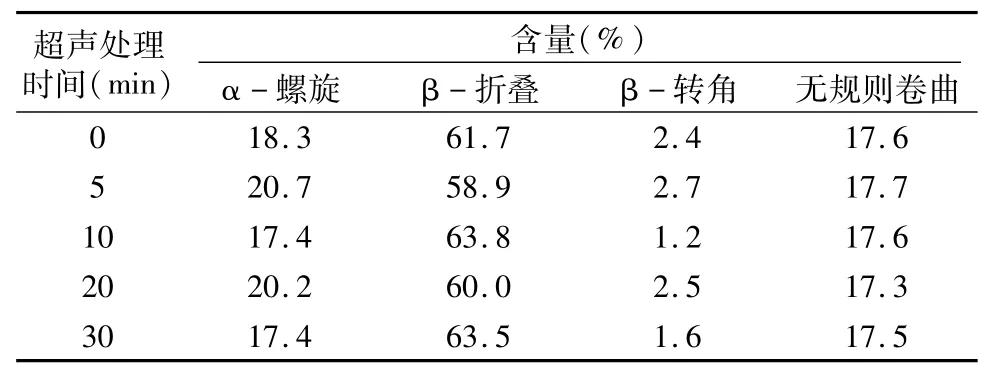
表1 蛋白质二级结构含量信息
2.4 鸡血浆蛋白表面疏水性测定
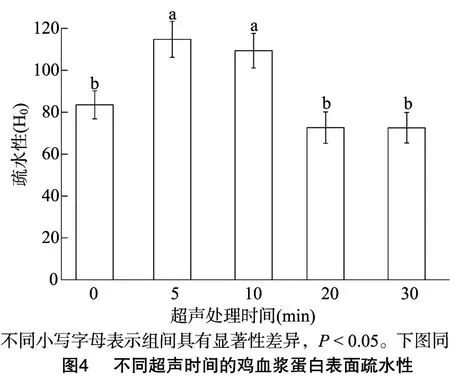
表面疏水性是蛋白质重要的表面性质,研究表明表面疏水性是影响蛋白质功能特性的重要因素,对保持蛋白质稳定构象和生物活性具有重要作用[22]。荧光探针法是测定蛋白质疏水性最广泛的方法,其优点是蛋白用量少,操作简单便捷[23]。ANS探针荧光在水溶液中单独存在时,荧光量子产量较低,随着ANS与蛋白质结合,荧光强度显著增强,通过这一特性可以表征鸡血浆蛋白的表面疏水性[24]。由图4可知,经过不同超声时间处理的鸡血浆蛋白表面疏水性显著提高,这可能是由于超声波的空穴效应,导致鸡血浆蛋白质相互碰撞后发生卷曲、折叠,蛋白结构被破坏,在水溶液中暴露出疏水性氨基酸残基,更多的血浆蛋白与ANS相结合,荧光强度增强,其表面疏水性显著提高[25]。贾俊强等发现通过超声频率为1 800W 的超声波处理后小麦胚芽球蛋白溶液的表面疏水性提高了[26]。超声10 min鸡血浆蛋白与超声5 min鸡血浆蛋白相比表面疏水性下降了,但是其差值不及超声20 min与超声10 min的差值。表面疏水性下降可能是因为随着超声处理时间的提高,蛋白质间相互作用加强,蛋白质的表面疏水性增加,当表面疏水相互作用达到一定程度时蛋白质的亚基聚集形成共价键及氢键等结构,使得一部分疏水基团被包埋,疏水相互作用减弱,疏水性降低[27-28]。超声处理20 min和30 min的血浆蛋白疏水性显著低于超声处理10 min的蛋白样品,这可能是超声处理使鸡血浆蛋白间的相互作用达到稳定状态,疏水性保持稳定。
2.5 自由巯基
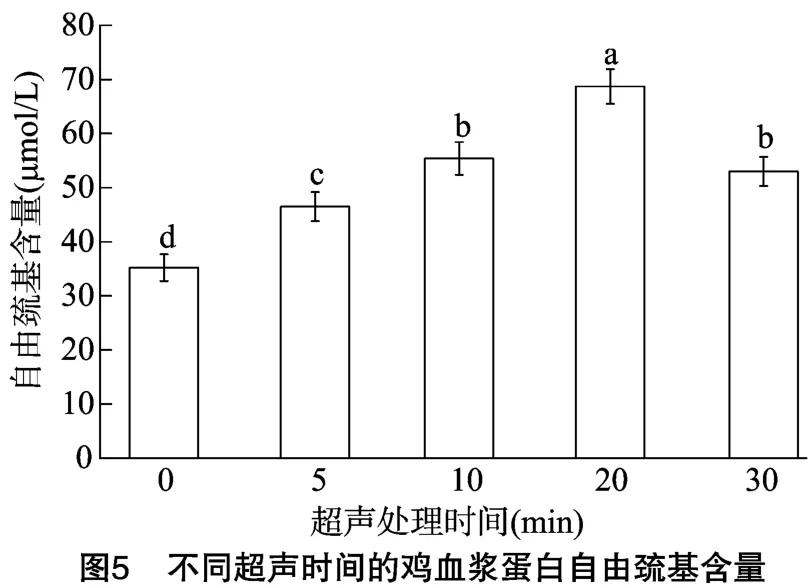
巯基基团含量变化可反映蛋白质变性程度,对探究蛋白的功能性质利用有重要作用[29]。由图5可知,在超声5 min、超声10 min、超声20 min组别中,经过超声处理的血浆蛋白其自由巯基含量提高,这可能是由于超声处理破坏了蛋白分子间的二硫键和巯基互相转化[30],使埋藏在蛋白分子内的巯基暴露出来,蛋白分子空间结构得到伸展[31]。Hu等发现,超声处理增加了大豆分离蛋白的游离疏基含量[32],本试验结果与之一致。在超声处理30 min组自由巯基含量出现明显下降,这可能是由于长时间超声处理使得蛋白质中部分—SH被重新氧化成S—S[33],使巯基基团被重新包埋。蛋白质自由巯基含量还受到其他因素影响,试验操作中温度的改变或样品溶液的复杂性都会改变自由巯基含量[27,34]。同时,不同超声处理时间下鸡血浆蛋白样品的巯基变化趋势与疏水性相似,这可能是由于超声时间增加,蛋白质变性程度增加,同时蛋白质分子间相互作用形成更多的蛋白质聚集体。
2.6 差式扫描量热
由表2可知,鸡血浆蛋白热扫描出现2组温度数据,这是血浆蛋白中2种主要蛋白(白蛋白和球蛋白)的变性温度及热焓变,与Dergez等研究[35]一致。经过超声处理的血浆蛋白变性温度较对照组均有所下降,且大致呈逐步下降趋势,鸡血浆蛋白对热的敏感性增强。这可能是超声处理影响了血浆蛋白的热稳定性,使血浆蛋白的三级结构发生了改变,空间立体性增加,蛋白与蛋白之间的交联发生改变,这与史培磊等的试验结果[36]相类似。
2.7 粒径分布
不同超声处理时间(0、5、10、20、30 min)对鸡血浆蛋白粒径的影响见图6。由图6可知,经过超声处理的血浆蛋白明显平均粒径均低于未超声处理的样品[37]。但还可以看到粒径并没有随着超声时间的增加而持续减小,超声30 min鸡血浆蛋白粒径大于超声20 min组,同时超声5 min的血浆蛋白粒径跨度即粒径图宽度显著变大,而其他超声时间下蛋白粒径又存在减小现象,说明可能蛋白分子一部分发生了分解作用,一部分发生了聚集作用。这一结果与叶钰等的研究结果[38]一致,而出现这一现象的本质原因可能是超声过程中的空化作用产生极强的剪切力,破坏了蛋白质分子间的共价或非共价作用[39],使粒径分布较大的血浆蛋白分子分解成较小的蛋白质分子。
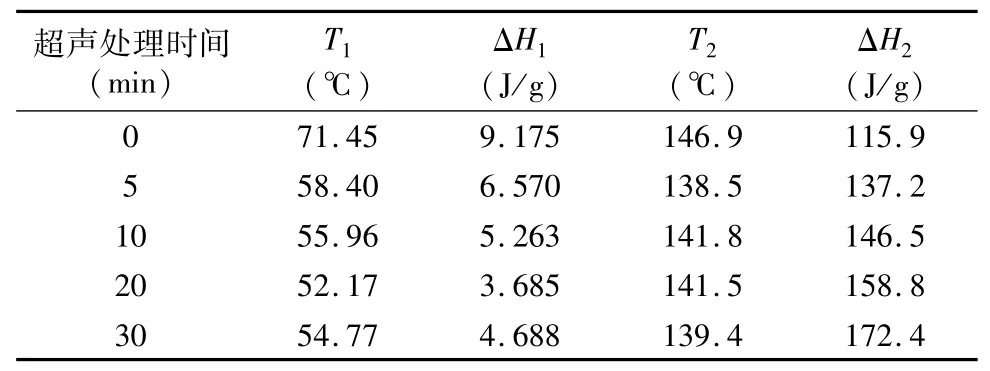
表2 血浆蛋白的差式量热扫描数据

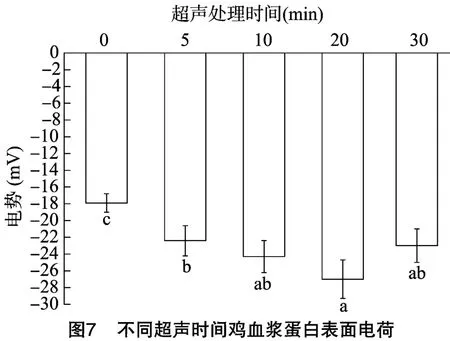
2.8 蛋白表面电荷
Zeta电位是表征胶体分散系稳定性的重要指标,可近似用来表示表面电荷。Zeta电位的绝对值越大,说明胶体的体系越稳定;反之,Zeta电位绝对值越小,蛋白质分子排斥力会小于吸引力,分子会有吸引聚集的趋势[40]。由图7可知,经过固定频率超声处理的血浆蛋白其Zeta电位绝对值都大于未超声处理组,这与Ryan等的研究结果[41]一致。Schmitt等认为Zeta电位绝对值大于20 mV,胶体较稳定[42],所以经过超声处理的血浆蛋白稳定性增强。本研究中经过超声处理的血浆蛋白稳定性增强明显。
2.9 扫描电镜
由图8可知,随着超声时间的增加,蛋白质的结构出现孔隙,变得疏松甚至分离,表面结构发生改变,这符合超声处理产生的剪切力破坏了分子间氢键和范德华力,使蛋白质发生分散,形成更加宽松的层状结构[43]。这与冯景丽等采用超声处理酪蛋白表面微观结构变得片层化和“空洞”化[44]是一致的。

3 结论
试验结果表明,超声处理不会破坏鸡血浆蛋白的亚基组成和二级结构,但会显著影响蛋白的三级结构、表面性质、粒径分布和表面微观形态。在超声频率不变时,改变超声时间对血浆蛋白的作用效果不是呈现相关性增长,而是一种不确定的改变,并不是超声时间越长达到的效果越好,根据实际需要达到的效果可选择最适超声时间。而本研究证明超声对改变蛋白质功能结构的有效性,为超声处理蛋白质改善蛋白质的功能特性利于其应用于生活中提供了理论基础。
