过表达细胞因子信号传导抑制蛋白1的树突状细胞过继免疫对COPD模型中T细胞相关因子的影响
2019-03-21郑相如刘茂茂顾延会张兰英欧阳瑶
郑相如,刘茂茂,袁 媛,顾延会,张兰英,陈 杰,欧阳瑶
0 引 言
慢性阻塞性肺疾病(chronic obstructive pulmo⁃nary disease,COPD)是世界上高患病率和高死亡率疾病,发病机制至今尚不明确[1]。研究表明,免疫系统调节紊乱可能是COPD的重要发病机制之一[2]。课题组前期发现COPD患者及COPD小鼠外周血、BALF及肺组织中辅助性T细胞17(T helper 17 cells,Th17)分泌细胞因子IL⁃17增多,存在Th17/调节性T 细胞(regulatory T cells,Treg)失衡,失衡与疾病严重程度有关,且树突状细胞(Dendritic cells,DCs)参与Th17与Treg的失衡[3⁃4]。未成熟DCs(im⁃mature DCs,imDCs)具有典型的致耐受性,通过调节T细胞反应可诱导免疫耐受,使机体保持平衡健康的状态[5]。细胞因子信号传导抑制蛋白(suppressor of cytokine signaling,SOCS)1是酪氨酸激酶(Janus kinase,JAK)信号传导及转录激活因子(signal trans⁃ducer and activator of transcription,STAT)通路的负向调控因子,参与DCs的分化、活化、成熟,SOCS1过表达时可使DCs维持在imDCs状态[6]。近来研究发现SOCS1参与COPD的发病过程且与COPD的发病时间有关[7];但过表达的SOCS1调控的DCs在COPD发病机制中对Th17、Treg失衡的影响作用尚不明确。因此,本研究以过表达SOCS1的DCs过继免疫法,观察对COPD小鼠BALF中Th17、Treg相关细胞因子的影响,为COPD治疗带来新思路。
1 材料与方法
1.1 材料8周龄SPF级C57BL/6雄性小鼠42只,由第三军医大学动物实验中心提供,体重(22±2)g,实验动物许可证号:SCXK(渝)2017⁃0001。将小鼠放置在SPF室内适应性喂养1周,温度(25±1)℃,相对湿度(35±5)%,每12小时明暗交替。过表达SOCS1的DCs系本实验室构建,朝天门牌香烟(重庆烟草工业有限责任公司),小鼠IL⁃17、IL⁃23、IL⁃10及TGF⁃β试剂盒购自中国北京丽科公司。
1.2 方法
1.2.1 动物模型建立及取材 随机数字法分为5组:健康对照组,模型组、imDCs组、DCs⁃SOCS1低浓度组 、DCs⁃SOCS1高浓度组,其中 imDCs组、DCs⁃SOCS1低浓度组、DCs⁃SOCS1高浓度组又分成第1天和第7天2个观察点,每个观察点各6只。健康对照组暴露于空气中,正常饲养,其余各组小鼠使用前期研究小组制备小鼠COPD模型方法改良法造模[10]。小鼠全身置于自制烟熏箱(45 cm×30 cm×30 cm)中,使用朝天门牌香烟(焦油量:11mg;烟气烟碱量:1.1 mg;烟气一氧化碳:12 mg)被动吸烟。3支/次,h/次,4次/d,时间点分别为9:30、11:00、14:00、15:30,共烟熏4周。模型组于烟熏造模第1天用等量等渗盐水0.5 mL/只尾静脉注射,imDCs组于第1、7天尾静脉分别注射imDCs 1×106个,4个DCs⁃SOCS1组分别于第1、7天尾静脉注射过表达SOCS1的DCs 1×106、2×106个。健康对照组继续正常饲养,余各组小鼠继续烟熏至28 d。待最后1次烟熏结束,各组小鼠使用7%的水合氯醛(5mL/kg)腹腔注射麻醉动物,暴露腹腔,剪断腹主动脉处死小鼠后打开胸腔,结扎左肺,切开颈部正中皮肤,钝性分离暴露气管,予等渗盐水灌洗气管和肺泡(0.6 mL/次,连续3次),收集5组支气管肺泡灌洗液(broncho al⁃veolar larage fluid,BALF)至冰块中离心管内,待检测。取健康组和模型组左上肺,于多聚甲醛中固定,待石蜡包埋、切片,行HE染色。
1.2.2 肺组织标本病理学HE染色 肺组织于24 h内经梯度浓度乙醇脱水,二甲苯以透明、浸蜡、包埋再切片,制备肺组织切片。通过脱蜡水化⁃洗片⁃HE染色⁃洗片⁃分化⁃脱水、干燥、封固等。使用光学显微镜观察HE染色切片,应用IPWin32软件采集各切片图片。
1.2.3 ELISA法检测指标 将收集的BALF予以离心(离心半径22.5cm,1500r/min,10min,4℃),取上清液用于ELISA检测IL⁃17、IL⁃23、IL⁃10及TGF⁃β,操作步骤按照ELISA试剂盒说明书进行。
1.3 统计学分析采用SPSS18.0软件进行统计分析,定量资料以均数±标准差(xˉ±s)表示。多组间差异采用方差分析,多组样本均数两两比较,方差齐采用LSD法,方差不齐采用Dunnett′s T3法,以P≤0.05为差异有统计学意义。
2 结 果
2.1 光镜观察小鼠肺组织病理特征HE病理切片镜下见健康对照组小鼠肺组织肺泡壁结构完相对连续、完整,肺泡间隔可见少量炎症细胞浸润。模型组组小鼠肺组织正常肺泡结构破坏,多个肺泡融合形成较大的肺泡腔,肺泡壁增厚,肺泡间隔有大量炎症细胞浸润,可见中性粒细胞、单核细胞及淋巴细胞等,符合人类COPD肺组织的病理改变,造模成功。见图1。
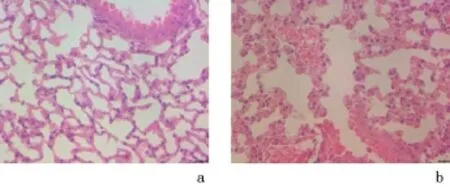
图1 镜下观察小鼠肺组织形态(HE×400)Figure 1 Histomorphology of the lung tissues of the mice in the healthy control and COPD model groups(HE ×400)
2.2 第1天、第7天尾静脉注射对Th17、Treg细胞因子的影响与模型组相比,imDCs、DCs⁃SOCS1低浓度组和DCs⁃SOCS1高浓度组BALF中IL⁃17、IL⁃23均含量降低(P<0.05),IL⁃10、TGF⁃β含量均增高(P<0.05);与imDCs组对应时间相比,DCs⁃SOCS1低浓度组和DCs⁃SOCS1高浓度组BALF中IL⁃17、IL⁃23含量降低(P<0.05),IL⁃10、TGF⁃β含量增高(P<0.05);与DCs⁃SOCS1 低浓度组对应时间相比,DCs⁃SOCS1高浓度组BALF中IL⁃17、IL⁃23含量降低(P<0.05),IL⁃10、TGF⁃β含量增高(P<0.05)。见表1。
2.3 不同时间尾静脉注射过表达SOCS1的DCs对Th17、Treg细胞因子的影响与DCs⁃SOCS1低浓度组第1天相比,DCs⁃SOCS1低浓度组第7天 IL⁃23含量增高,IL⁃10、TGF⁃β含量降低(P<0.05),IL⁃17含量变化差异无统计学意义(P>0.05);与DCs⁃SOCS1高浓度组第1天相比,DCs⁃SOCS1高浓度组第7天IL⁃17、IL⁃23含量增高,IL⁃10、TGF⁃β 含量降低(P<0.05)。见表1。
表1 不同时间尾静脉注射过表达SOCS1的DCs对Th17、Treg细胞因子的影响(ˉ±s,pg/mL)Table1 Contents of Th17 and Treg cytokines on the first and seventh day of modeling(xˉ±s,pg/mL)
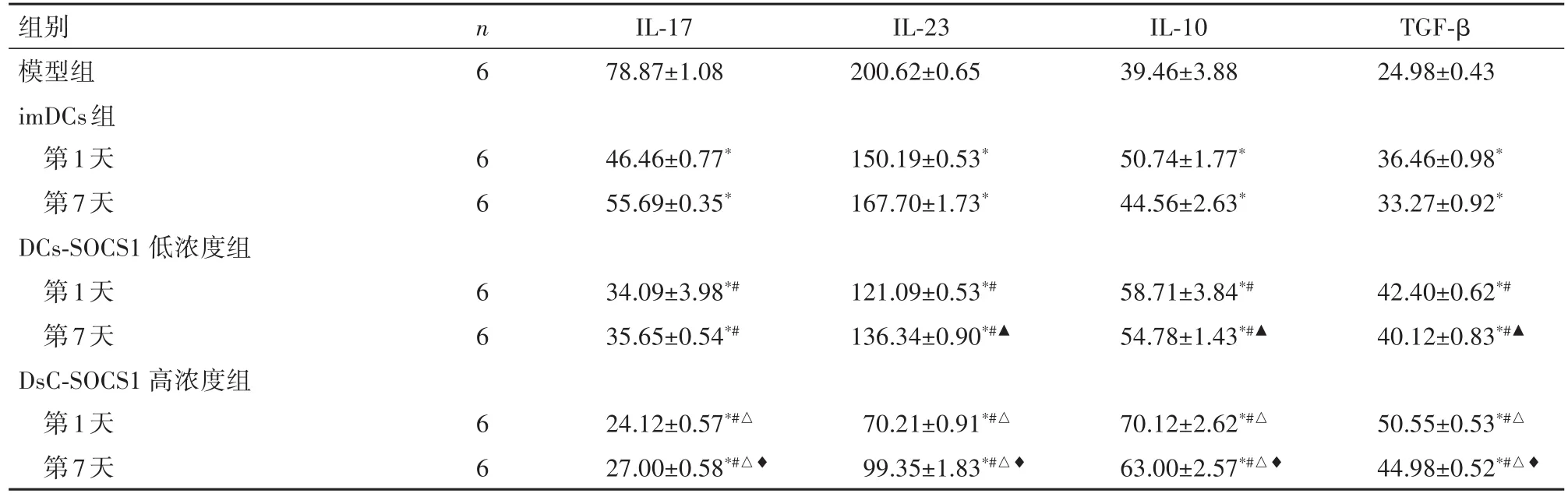
表1 不同时间尾静脉注射过表达SOCS1的DCs对Th17、Treg细胞因子的影响(ˉ±s,pg/mL)Table1 Contents of Th17 and Treg cytokines on the first and seventh day of modeling(xˉ±s,pg/mL)
与模型组相比,*P<0.05,与imDCs组相比,#P<0.05;与DC⁃SOCS1低浓度组相比,△P<0.05;与DC⁃SOCS1低浓度组第1天相比,▲P<0.05;与DC⁃SOCS1高浓度组第1天相比,♦P<0.05
模型组imDCs组第1天第7天DCs⁃SOCS1 低浓度组第1天第7天DsC⁃SOCS1 高浓度组第1天第7天78.87±1.08200.62±0.65 6 6 6 6 6 6 6 39.46±3.8824.98±0.43 46.46±0.77*55.69±0.35*150.19±0.53*167.70±1.73*50.74±1.77*44.56±2.63*36.46±0.98*33.27±0.92*34.09±3.98*#35.65±0.54*#121.09±0.53*#136.34±0.90*#▲58.71±3.84*#54.78±1.43*#▲42.40±0.62*#40.12±0.83*#▲50.55±0.53*#△44.98±0.52*#△♦24.12±0.57*#△27.00±0.58*#△♦70.21±0.91*#△99.35±1.83*#△♦70.12±2.62*#△63.00±2.57*#△♦
3 讨 论
目前对于COPD的治疗原则主要是缓解症状,对于COPD的预防尚无有效方法。近年来关于Th17和Treg在COPD的发病过程中的作用研究成为热点[9⁃10]。Th17细胞主要通过分泌IL⁃17、IL⁃21等在炎症及自身免疫性反应中起重要作用,其中,IL⁃23是Th17细胞增殖的必要条件[11]。IL⁃17在正常生理状态下不会持续表达,炎症状态下通过提高胶原蛋白的聚集、抑制细胞外基质分解及刺激成纤维细胞增殖等途径促进纤维结缔组织形成和平滑肌增生,进而导致气道重塑。IL⁃17或其受体可导致中性粒细胞活化、分化和增加细菌增殖,与多种细胞因子产生协同作用而放大炎症反应[12]。Treg主要通过分泌抗炎性因子IL⁃10等抑制炎性反应及维持免疫耐受作用,与Th17共同参与机体免疫反应并维持平衡状态[13⁃14]。
T细胞介导的免疫反应需DCs的参与,课题组前期实验发现COPD患者小气道中mDCs减少,而imDCs增多[15]。近来,研究也发现COPD发病与DCs成熟程度有关[16]。imDCs具有典型的致耐受性,通过调节T细胞反应可诱导免疫耐受,维持机体平衡[17]。本研究显示,尾静脉注射imDCs可使Treg分泌的IL⁃10、TGF⁃β增多,Th17相关细胞因子IL⁃17、IL⁃23减少,提示imDCs可抑制IL⁃17、IL⁃23分泌,减轻COPD炎症。
SOCS1是JAK/STAT通路的负向调控因子,可通过抑制DCs细胞内的JAK⁃STAT信号通路或上调Toll样受体信号、抑制粒细胞、巨噬细胞集落刺激因子信号来抑制DCs成熟,使DCs稳定维持在imDCs状态[18]。本研究发现,SOCS1过表达的DCs尾静脉注射小鼠体内后,与模型组及imDCs组相比,小鼠BALF中Th17细胞因子IL⁃17、IL⁃23分泌减少,Treg细胞因子 IL⁃10、TGF⁃β 分泌增多。与 Takahashi等[19]发现一致:SOCS1可以抑制Treg细胞转化成产生IL⁃17的Th17细胞,可能与T细胞抗原受体介导的IkB激酶复合体⁃核因子kB信号通路信号通路或IL⁃12受体信号有关。因此,过表达SOCS1的DCs可抑制COPD中Th17相关细胞因子IL⁃17等分泌,且效果优于单纯imDCs。其可能一方面是过度表达SOCS1的DCs可使DCs稳定维持在imDCs状态,增强其抗原吞噬功能,产生IL⁃10增多,抑制IL⁃17分泌;另一方面是过表达SOCS1的DCs尾静脉注射体内保护或增强了香烟烟雾持续暴露下功能受损或数量减少的Treg的功能,抑制IL⁃17分泌[18]。
本研究还发现同时间(第1天和第7天)尾静脉注射情况下,DCs⁃SOCS1高浓度组IL⁃17、IL⁃23含量均显著低于DCs⁃SOCS1低浓度组,而Treg分泌的细胞因子IL⁃10、TGF⁃β增多,提示与尾静脉注射的浓度有关。研究进一步发现,DCs⁃SOCS1组第7天IL⁃17、IL⁃23的含量高于第1天,IL⁃10、TGF⁃β的含量降低,提示与干预时间有关。分析原因:IL⁃10参与调节性DCs的生成,SOCS1过度表达可促使DCs表面表达IL⁃10,当DCs产生大量IL⁃10时可转化为调节性 DCs[19]。SOCS1过表达的DCs特征与调节性 DCs相似。第1天尾静脉注射较第7天尾静脉注射由于早干预更早地产生调节性DCs功能,分泌IL⁃10等因子增高,抑制IL⁃17等细胞因子分泌,且IL⁃10增加更有效促使Treg生成,更早保护了Treg功能,从而使抑制作用进一步扩大[20]。
约有 15% 的COPD患者为频发加重表型[21]。而研究证实,不同表型的COPD患者IL⁃17等炎性细胞因子水平均存在着显著差异,频发急性加重表型中最高[22]。本实验中发现过表达SOCS1的DCs尾静脉注射后抑制IL⁃17分泌,提示过表达SOCS1的DCs可能减缓或抑制COPD频发急性加重、降低死亡风险。
综上所述,本研究证实过表达SOCS1的DCs尾静脉注射小鼠体内后可抑制COPD中IL⁃17等细胞因子分泌,且与浓度、时间有关,提示提前干预、合适浓度可抑制COPD炎症反应,为COPD治疗开辟新的思路,尤其是减缓或抑制频繁急性加重表型COPD。但关于过表达SOCS1的DCs尾静脉注射抑制COPD炎症反应的最佳浓度及COPD小鼠肺组织病理改善情况需进一步实验。