长白落叶松愈伤组织及不定芽的诱导
2019-03-21张莉
张 莉
(山东现代学院 山东 济南 250104)
长白落叶松(Larixolgensis),落叶松属,落叶乔木,分布以长白山为中心,北至北纬45°20′处的穆棱与鸡西桦木林场,南至北纬40°30′的辽宁省宽甸县,西至东经124°30′,东至国境[1],其具有生长快、干形好、适应性强及综合利用价值高等特点[2]。
长白落叶松生长周期长,采用常规育种技术选育新品种耗时长、见效慢,且后代性状难以定向改良,因此,采用离体组织培养进行快繁颇为重要。目前,日本落叶松、华北落叶松及兴安落叶松等树种已建立了离体快繁体系[3~6],而关于长白落叶松组织培养的研究较少,本研究从外植体消毒方式及愈伤组织与不定芽诱导的适宜培养基、激素组合和配比的选取等方面着手,筛选出更加高效的消毒方式及更适宜于愈伤组织与不定芽诱导的培养基类型及激素组合与配比,旨在为长白落叶松组织离体培养提供一定的参考。
1 材料与方法
1.1 试验材料
试验所用长白落叶松种子为2016年9月采自于黑龙江省牡丹江市林口县青山国家落叶松良种基地落叶松种子园。采集后放入-20℃冰箱中冷冻保存备用。
1.2 试验方法
1.2.1 外植体处理与消毒
将成熟且饱满的种子去皮,流水冲洗2 d,用70% 酒精消毒1 min,用4%NaClO分别消毒10 min、15 min、20 min、25 min,剥去胚乳,将合子胚接种至培养基上,再用0.5%NaClO消毒合子胚2 min(此步骤设置空白对照),吸干胚上水分,接种培养。3 d后,统计污染率;7 d后,统计存活率。以上涉及使用试剂的步骤皆用无菌水洗净后再处理。
1.2.2 愈伤组织的诱导
选取MS、BM及DCR 3种培养基,激素组合及配比为:
MS培养基上:2,4-D(0.5 mg·L-1,1.0 mg·L-1,2.0 mg·L-1)+6-BA(0.05 mg·L-1,0.5 mg·L-1,1.0 mg·L-1)共9种处理,6-BA(0.05 mg·L-1,0.5 mg·L-1)+NAA(0.5 mg·L-1,1.0 mg·L-1,2.0 mg·L-1)共6种处理;
BM培养基上:6-BA(0.1 mg·L-1,1.0 mg·L-1,2.0 mg·L-1)+NAA(0.5 mg·l-1,1.0 mg·l-1,2.0 mg·l-1)共9种处理,TDZ(1.0 mg·L-1,1.5 mg·L-1,2.0 mg·L-1,2.5 mg·L-1)共4种处理;
DCR培养基上:2,4-D(0.5 mg·L-1,1.0 mg·L-1,2.0 mg·L-1)+6-BA(0.5 mg·L-1,1.0 mg·L-1)+KT(0.5 mg·L-1,1.0 mg·L-1)共12种处理。
2,4-D为吲哚乙酸,6-BA为6-苄氨基腺嘌呤,NAA为萘乙酸,TDZ为噻苯隆,KT为激动素。以上每个处理上至少接种30个合子胚,重复3次,置于温度23 ℃~25 ℃,光照培养。28 d后,观察愈伤组织生长状况并统计愈伤率。
1.2.3 不定芽的诱导
选取1/2MS、MS、1/2BM、BM、1/2DCR、DCR 6种培养基,添加1.5 mg·L-1TDZ,筛选最适培养基;在BM上设置TDZ(1.0 mg·L-1,1.5 mg·L-1,2.0 mg·L-1)+NAA(0,0.1 mg·L-1,0.5 mg·L-1)共9种处理组合,筛选最佳激素组合。上述每种处理接种30个外植体(愈伤组织),重复3次,培养4周,统计不定芽的诱导率。
1.2.4 数据分析方法
Rj= 100%*Rs/Js
Ch= 100%*Cs/(Js-Rs)
Yy= 100%*Ys/Js
By= 100%*Bs/Js
式中:Rj为染菌率(%);Rs为染菌数(个);Js为接种外植体数(个);Ch为存活率(%);Cs为存活数(个);Yy为愈伤组织诱导率,简称愈伤率(%);Ys为诱导出愈伤组织的外植体数(个);By为不定芽诱导率(%);Bs为诱导出不定芽的外植体数(个)。
数据分析采用T检验、方差分析及多重比较等方式,使用Excel 2016、Spss17.0及Minitab16.0 等软件对数据进行处理分析。百分率指标在进行T检验及方差分析时进行反正弦转化后再分析。
2 结果与分析
2.1 不同消毒处理对消毒效果的影响
不同消毒处理对消毒效果的影响具体见图1。

图1 不同消毒处理的染菌率及存活率散点折线图
图中左侧为染菌率,右侧为存活率,两者的横标从左至右依次代表8种处理,每种处理都以“4%NaClO消毒去皮种子时间+0.5%NaClO消毒胚时间”作为标注。
从图1中可知,染菌率随消毒去皮种子的时间的增加而下降,同时消毒种子和胚的效果比仅消毒种子的效果好,因此,对外植体消毒时,不仅要消毒去皮种子,还须消毒胚。存活率随消毒去皮种子时间的增加出现了先上升后下降的规律,只消毒种子时拐点出现在消毒种子20 min时,同时消毒种子和胚时拐点出现在消毒种子15 min及消毒胚2 min时,这说明消毒时间过长会影响外植体活力。结合染菌率和存活率,最终确定最佳的消毒方式为消毒去皮种子15 min及消毒胚2 min。
2.2 愈伤组织诱导
为研究培养基对愈伤组织诱导率的影响,对3种培养基上的愈伤率做了双样本T检验,具体见表1。从表中可以看出,MS与BM上的愈伤率差异显著,MS与DCR上的愈伤率差异极显著,BM与DCR上的愈伤率差异极显著。在3种培养基上愈伤率表现为BM>MS>DCR,因此,BM为愈伤组织诱导的最适培养基,愈伤率达到近50%。
为研究不同激素组合对愈伤组织诱导的影响,对不同培养上的激素组合进行了双样本T检验,具体结果见表1。由表1可知,MS+2,4-D+6-BA与DCR+2,4-D+6-BA+KT上的愈伤率差异极显著,与其他组合差异不显著;MS+6-BA+NAA与BM+6-BA+NAA及BM+TDZ上的愈伤率差异显著,与DCR+2,4-D+6-BA+KT差异极显著;BM+6-BA+NAA与BM+TDZ差异不显著,与DCR+2,4-D+6-BA+KT差异极显著;BM+TDZ与DCR+2,4-D+6-BA+KT差异极显著。在5种组合中愈伤率表现为BM+TDZ>BM+6-BA+NAA>MS+2,4-D+6-BA>MS+6-BA+NAA>DCR+2,4-D+6-BA+KT,因此,BM+TDZ为愈伤组织诱导的最适培养基及激素组合,愈伤率达到65%。
BM+TDZ组合中,胚接种3d,胚的根部变紫红色,1 w子叶变绿,且子叶及胚轴增粗,形成愈伤组织。3 w~4 w,可观察到生长良好的愈伤组织(见图2)。同时,愈伤率为BM+TDZ(2.0 mg·L-1)>BM+TDZ(1.5 mg·L-1)>BM+TDZ(1.0 mg·L-1)>BM+TDZ(2.5 mg·L-1),因此,BM+TDZ(2.0 mg·L-1) 为愈伤组织诱导的最适培养基及激素组合与配比,愈伤率达到89%。
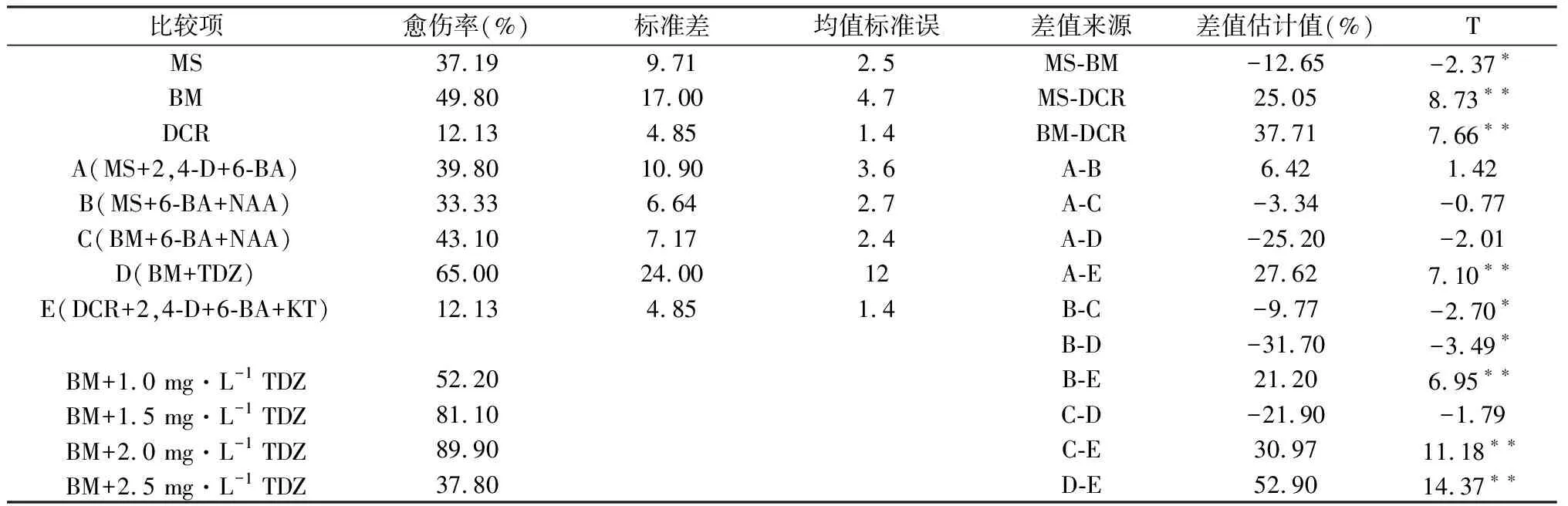
表1 不同培养基及激素组合对愈伤组织诱导的影响
注:*代表差异显著,**代表差异极显著
2.3 不定芽的诱导
不同培养基及激素组合与配比对不定芽诱导影响的具体结果见表2。
不同培养基上不定芽诱导率的均值比较结果为BM>DCR>1/2MS>1/2BM>1/2 DCR>MS,在BM培养基上诱导率达到约79%。同时,经过后续观察发现BM上的愈伤组织表面出现了绿色颗粒状芽点(见图3),并长出生长好的不定芽;在MS上的愈伤组织表面出现了黄绿色凸起的芽原基,但最后变黄并逐渐死亡。不同激素组合及配比中不定芽诱导率的均值比较结果为TDZ(1.5 mg·L-1)+NAA(0.0 mg·L-1)>TDZ(1.0 mg·L-1)+NAA(0.1 mg·L-1)>TDZ(1.5 mg·L-1)+NAA(0.1 mg·L-1)>TDZ(1.0 mg·L-1)+NAA(0.0 mg·L-1)>TDZ(1.5 mg·L-1)+NAA(0.5 mg·L-1)>TDZ(2.0 mg·L-1)+NAA(0.5 mg·L-1)>TDZ(1.0 mg·L-1)+NAA(0.5 mg·L-1)> TDZ(2.0 mg·L-1)+NAA(0.1 mg·L-1)>TDZ(2.0 mg·L-1)+NAA(0.0 mg·L-1),在TDZ(1.5 mg·L-1)+NAA(0.0 mg·L-1)处理时诱导率达到80%。
为研究不同培养基及激素组合与配比对不定芽诱导影响的稳定性,进行了稳定性分析,以变差系数(100%*标准差/平均数)作为衡量稳定性的指标,变差系数越大,说明越不稳定(见表2)。不同培养基上不定芽诱导率的变差系数比较结果为BM<1/2BM<1/2MS 表2 不同培养基及激素组合与配比对不定芽诱导的影响 注:**代表差异极显著;同列不共享字母间差异极显著。 图2 BM+2.0 mg·L-1TDZ诱导的愈伤组织 图3 BM培养基上诱导出的不定芽 不同处理对不定芽诱导的影响结果做了方差分析,旨在检验不同处理的结果是否达到统计学上显著差异水平。由表2可知,不同培养基对不定芽诱导的效果差异极显著,其F值为79.08;不同激素组合与配比对不定芽诱导的效果为:不同浓度的TDZ、不同浓度NAA及TDZ与NAA的交互作用对不定芽的诱导效果差异极显著,但从多重比较结果可以看出,TDZ对不定芽诱导影响更大。 总之,结合均值比较、稳定分析、方差分析及多重比较得出:BM培养基为不定芽诱导的最适培养基,TDZ(1.5 mg·l-1) 单独处理愈伤组织时不定芽的诱导效果最好。 外植体的选择是离体快繁的关键,目前,针叶树离体培养大多采用合子胚、子叶、下胚轴及嫩芽等幼嫩组织作外植体[7]。赵健[8]等人利用成熟合子胚为外植体进行华北落叶松离体培养取得较好的效果。唐巍[9]等人在研究火炬松时发现,成熟合子胚较其他器官离体发生更有效。本试验采用成熟合子胚为外植体,获得了较高的愈伤组织及不定芽的诱导率。 外植体无菌是植物组织培养的前提,因此,对长白落叶松成熟种子表面及内部消毒灭菌是必不可少的。王伟达[10]等用1%NaClO消毒去皮种子50 min+0.5%NaClO浸泡胚2 s获得了最佳的消毒效果。赵健[8]等发现用75% 酒精消毒3 min种子后,再在0.1%升汞中浸泡10 min为最佳消毒方法。朱晓丹[11]等研究云南松成熟胚离体培养时,发现最佳的消毒效果为先用75%的酒精浸种40 s,再用l%的升汞消毒2 min,重蒸馏水冲洗4~5次。本研究采用70% 酒精消毒去皮种子1 min,再用4%NaClO消毒种子15 min,最后用0.5%NaClO消毒胚2 min,既显著降低了胚的污染率,又保证了胚的存活率。 有研究表明,培养基中TDZ的浓度能明显影响愈伤组织诱导率。曹焱[12]等在研究植物激素对成熟红松合子胚诱导愈伤组织时,发现在LM培养基中添加0.5 mg·L-1TDZ可显著提高愈伤率,且愈伤率为75.7%。秦静远[13]等以杜鹃叶片为外植体利用TDZ亦成功地诱导出愈伤组织。使用TDZ进行月季叶片[14]及葡萄芽切段[15]诱导愈伤组织也获得了很好的效果。本试验在BM培养基上添加2.0 mg·L-1TDZ,诱导出质量优良的愈伤组织,BM培养基上添加1.5 mg·L-1TDZ,得到了很高的不定芽诱导率。 本研究以长白落叶松成熟合子胚为外植体,经过脱分化形成愈伤组织,再分化出不定芽,为长白落叶松无性扩繁及转基因新品种培育奠定了基础。


3 结论与讨论
