磁共振Mapping技术诊断兔进展期椎间盘退变
2019-03-21胡莹莹应金威赵琪雯王庆军
胡莹莹,应金威,赵琪雯,王庆军
1.海军总医院,a.放射科;b.骨科;c.病理科,北京市100048
椎间盘退变程度与脊柱相关的临床症状密切相关[1]。基于多个反转角、多个回波时间的磁共振mapping成像技术能够评估活体椎间盘退变情况[2-3]。本研究探讨磁共振mapping成像技术用于椎间盘退变的分期,以期动态量化评估椎间盘退变。
1 材料与方法
1.1 实验动物
健康成年新西兰兔10只,由海军总医院医学动物实验中心提供,实验动物许可证号SCXK(京)2017-0002。雄雌不限,年龄(3±0.25)个月,平均体质量(3.2±0.21)kg。所有动物实验均严格遵照《关于善待实验动物的指导性意见》处理。
1.2 分组及检查
动物造模前行X线平片检查,排除有脊椎侧弯、骨关节炎、脊柱炎症等疾病以及Pfirrmann分级Ⅰ级以上的自发椎间盘退变情况。
1.3 造模方法[4]
动物术前禁食水12 h,建立耳缘静脉通道。3%戊巴比妥钠溶液1 ml/kg腹腔注射麻醉,头孢唑啉钠0.5 g静滴维持。术区备皮,左侧卧位,固定四肢,消毒、铺巾。取腹部后外侧纵行切口10 cm,腹外斜肌与背部肌肉间钝性分离,腹膜外入路进入,到达椎体侧前方,必要时咬除横突以增加手术野。以髂嵴最高点为标志(平L6椎体),暴露L1~S1椎间隙。平行终板方向,21 G穿刺针(美国COOK医疗器械公司)套5 ml注射器刺入椎间盘约5 mm,将注射器抽至5 ml处维持5 s,抽吸髓核组织,可感觉到明显的阻力并完全回弹,髓核充填到针头内,将针头内容物推出,可见胶冻状髓核组织。冲洗后逐层缝合切口。术后禁食1 d,头孢唑啉钠0.5 g肌注预防感染,碘伏消毒切口。
1.4 数据采集及后处理
每只新西兰兔分别于造模前、造模后1个月和3个月行腰椎磁共振检查。使用西门子3.0 T磁共振扫描仪,20通道头颈联合线圈,足先进仰卧位,定位扫描后行常规矢状位T2WⅠ和T1WⅠ。T2WⅠ扫描参数:TR 3500 ms,TE 103 ms,FOV 26×26 cm,层厚 3 mm,层间距0 mm。T1WⅠ扫描参数:TR 550 ms,TE 9 ms,FOV 26×26 cm,层厚3 mm,层间距0 mm。然后行矢状位多TE回波序列T2mapping扫描及多个反转角的T1mapping扫描,两个mapping图像定位平面同T2WⅠ和T1WⅠ保持一致。T2mapping扫描参数:TR 2000 ms,TE 10.5 ms、21.0 ms、 31.5 ms、 42.0 ms、52.5 ms、63.0 ms,FOV 125×250 mm,层厚 3 mm,层间距0 mm,矩阵256×256。T1mapping扫描参数:翻转角 5°、26°,TR 15 ms,TE 1.92 ms,FOV 120×240 mm,层厚3 mm,层间距0 mm,矩阵256×256。
T2WⅠ、T1WⅠ及mapping图像均导入后处理工作站Syngo。由3名工作5年以上有经验的影像科医生对新西兰兔L1~S1共6个椎间盘进行定性和定量评估,这三名影像科医生均不知道椎间盘病理情况。Pfirrmann分级[5]:由2名影像科医生根据T2WⅠ椎间盘信号和形态,进行独立分级,若意见不统一,则由第3名医生参与,意见统一后定级。mapping图像测量:在正中矢状面T2WⅠ上,由2名影像科医生协商勾画感兴趣区(region of interest,ROⅠ),包含髓核和纤维环,约0.3 cm2。然后将ROⅠ拷贝到同层面T2mapping和T1mapping图像中(图1),分别获取T2值和T1值。重复测量3次,取均值。
1.5 病理分析
造模后3个月完成MRⅠ检查后,空气栓塞法处死动物,迅速游离并取出6个节段椎间盘,生理盐水反复冲洗,4%多聚甲醛固定24 h,15%EDTA脱钙2周,梯度酒精脱水,二甲苯透明,石蜡包埋,切片厚5μm,分别行HE和番红O染色。镜下观察椎间盘形态、髓核细胞和胶原变化。由2名病理科医师协商决定是否为进展期退变,以及进展期退变分级[6]。非进展期退变:纤维化与髓核分界轻度不清,髓核少量染色减少,髓核中有裂隙,细胞簇>50%。进展期退变:纤维化与髓核分界明显不清,髓核大量染色减少或无染色,髓核中裂隙延伸到髓核边缘并累及纤维环,细胞簇<50%。见图2。
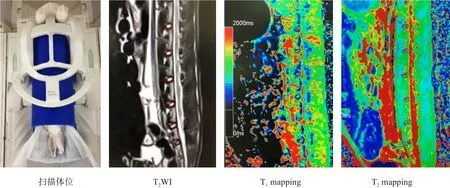
图1 腰椎间盘影像

图2 兔腰椎间盘退变病理
1.6 统计学分析
采用Medcalc软件处理数据。计数资料用频数表示。计量资料用(ˉ±s)表示,造模前、后不同时间点间采用单因素方差检验,两两比较采用配对t检验。以病理结果为依据,用接受者操作特征(receiver operating characteristic,ROC)曲线分析各诊断指标对于判断进展期椎间盘退变的诊断效能。显著性水平α=0.05。
2 结果
实验过程中因麻醉过量死亡3只,最终7只42个椎间盘纳入统计分析。
2.1 Pfirrmann分级
造模前,椎间盘大部分处于PfirrmannⅠ级,随时间推移,椎间盘退变程度逐渐加重,分级升高。见表1。
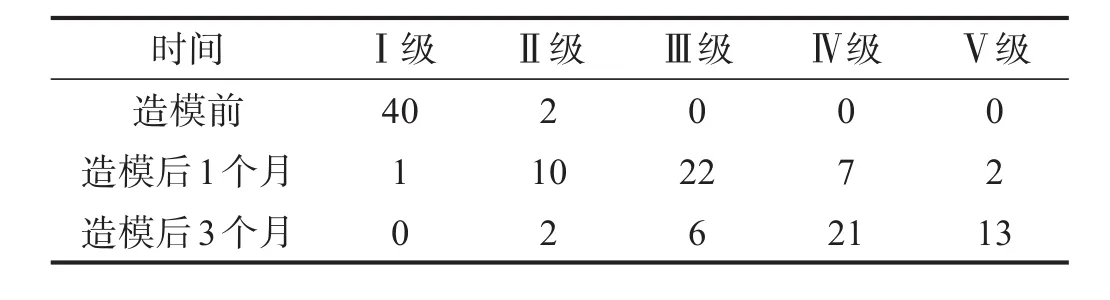
表1 椎间盘造模前后Pfirrmann分级(n)
2.2 T1值
造模前后,T1值总体上未见显著性差异(P>0.05)。两两比较显示,L6~S1间盘T1值造模前与造模后3个月间存在显著性差异(P<0.05)。造模后3个月时,L2-3、L4-5、L5-6间盘T1值较造模后1个月有降低趋势。见表2。
2.3 T2值
造模后,椎间盘T2值下降(P<0.05);造模后1个月与3个月比较,仅L6~S1间盘T2值升高(P<0.05),其余椎间盘T2均呈降低趋势,但无显著性差异(P>0.05)。见表3。
2.4 病理分期
造模后3个月,34个椎间盘为进展期退变,8个为非进展期。
2.5 ROC曲线分析
诊断进展期椎间盘退变的能力从高到低依次为:T2mapping+T1mapping=T2mapping>T1mapping>Pfirrmann分级。单独应用T2mapping鉴别诊断进展期椎间盘退变时,曲线下面积、敏感性和特异性最高。见图3、表4。
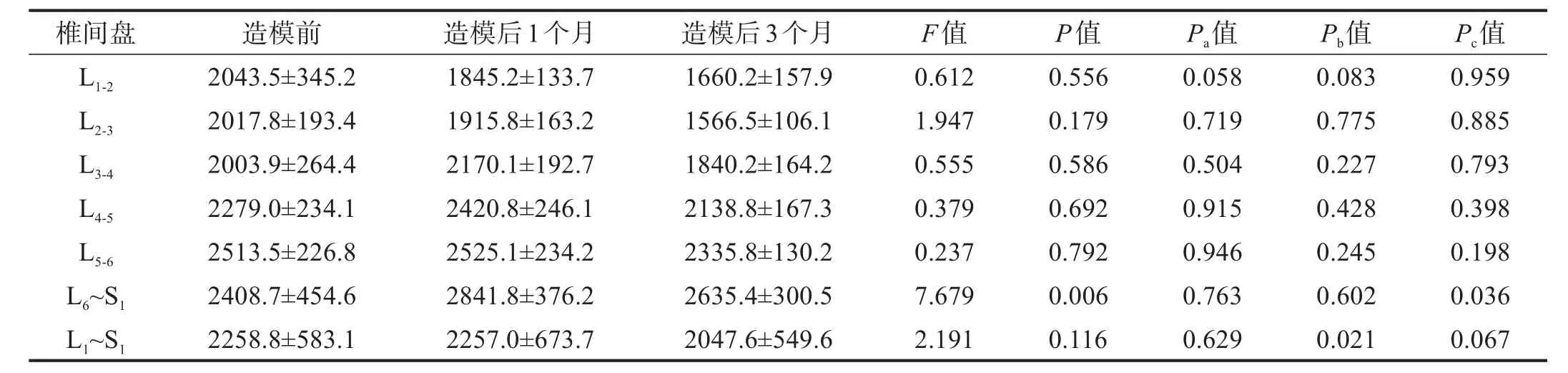
表2 造模前后椎间盘T 1值比较(ms)
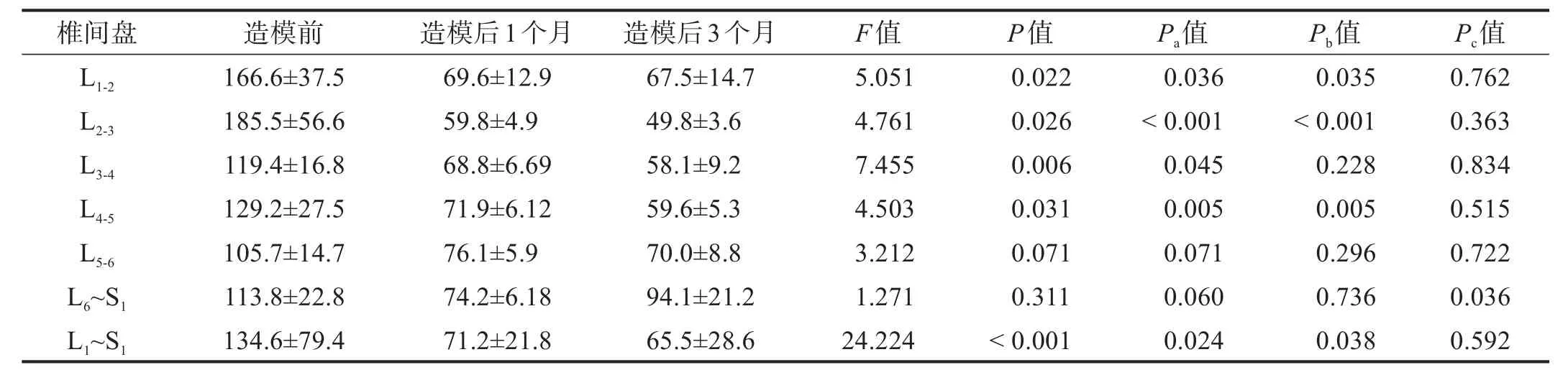
表3 造模前后椎间盘T 2值比较(ms)
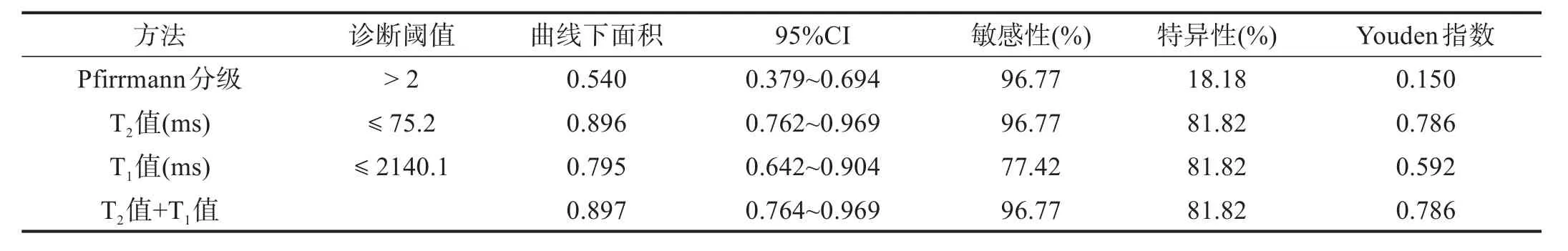
表4 各项指标诊断进展期椎间盘退变ROC曲线诊断效能比较
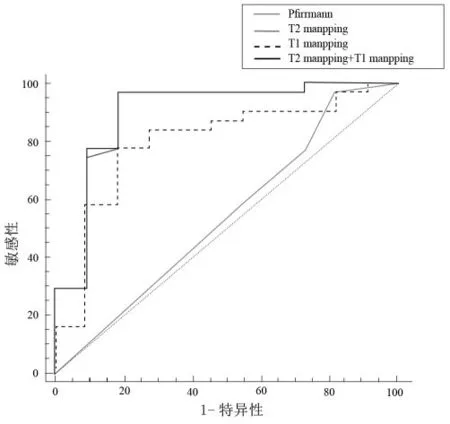
图3 各项指标诊断进展期椎间盘退变的ROC曲线
3 讨论
本研究显示,相对于临床常用的Pfirrmann分级,磁共振mapping技术,特别是T2mapping测量可更准确地判断进展期椎间盘退变;相对而言,T1mapping的鉴别诊断能力略差。
椎间盘由软骨板、纤维环和髓核组成。软骨板分上下两块,上下软骨板中间包括由多层纤维软骨环按同心圆排列而成的纤维环和位于中央的富含弹性胶状物质的髓核。髓核中含有黏多糖蛋白复合体、硫酸软骨素和大量水分,纤维环主要由Ⅰ型胶原蛋白组成。椎间盘的结构、代谢和营养状况变化,导致髓核和纤维环组织改变,最为显著的是水分和黏多糖蛋白复合体丢失,导致椎间盘能承受的负荷逐渐下降,发生退行性病变。
在活体状态下,椎间盘退变是一个逐步发展的过程。退变发展到一定程度,出现纤维化与髓核分界明显不清、髓核大量染色减少或无染色、髓核中裂隙延伸到髓核边缘并累及纤维环等,临床保守治疗通常效果不佳,宜进行手术干预[1,7]。基于T2WⅠ椎间盘形态和信号变化,Pfirrmann分级可以初步判断椎间盘退变程度,但主观性强、准确性差[5]。本研究显示,Pfirrmann分级诊断进展期椎间盘退变敏感性较高,但是特异性较低,从而高估椎间盘退变程度,有过度外科治疗的潜在风险。
T2mapping通过测量不同TE中图像信号强度,利用线性回归方法得到T2mapping图像,在T2mapping图像勾画感兴趣区即可获取组织的T2值。T2值不受主观因素影响,能较为客观地反映组织内在代谢与生化信息特征[8]。理论上由于水分和黏多糖蛋白复合体丢失,退变椎间盘T2值减低。国内外也有较多研究证实,基于T2mapping测得的T2值与椎间盘退变以及关节软骨退变呈负相关,T2mapping可以为判断椎间盘退变提供更为客观的定量依据[2,5,8-9]。本研究显示,随着椎间盘退变的进展,椎间盘T2值呈现下降趋势,与以往研究结果一致[10-12]。本研究还显示,T2mapping不仅可以早期反映椎间盘退变情况(造模后1个月),还能较为准确地将非进展期椎间盘退变与进展期椎间盘退变区分开来。由于T2mapping无创、无电离辐射、无需对比剂等优势,适合于对活体椎间盘进行动态观察,从而可为退变椎间盘外科干预时间节点的选择提供客观依据。与传统的Pfirrmann分级相比,T2mapping明显提升诊断特异性,从而有效避免过度治疗问题。
通过翻转角的变化,T1mapping可以定量测量组织的T1值,从而反映组织的含水量、纤维化以及胶原含量[13-15]。目前T1mapping主要用于心肌成像,国内外均未见用于椎间盘成像的报道。本研究显示,基于T1mapping测得的T1值其判断进展期椎间盘退变的能力仍然优于Pfirrmann分级,但敏感性明显低于T2mapping。将T2mapping和T1mapping联合应用,诊断效能与单独使用T2mapping相似。临床工作中,只需加扫T2mapping即可,没有必要行T1mapping扫描。
本研究样本量较小,由于麻醉原因造成部分动物突发死亡,随访检查时间较短。有待进一步研究改进,并进行长期随访。
综上所述,磁共振T2mapping和T1mapping两种成像技术均可判断进展期椎间盘退变,为临床治疗方案的选择提供影像学依据。其中T2mapping较T1mapping更具优势,在常规椎间盘MRⅠ检查中加扫T2mapping即可满足需要。
