甲状旁腺激素测定试剂盒行业标准的验证
2019-03-18曲守方于婷孙楠黄杰
曲守方 于婷 孙楠 黄杰
[摘要] 目的 制定甲状旁腺激素测定试剂盒行业标准,采用标准适用的化学发光法试剂盒进行验证,评价标准的适用性。 方法 采用磁微粒化学发光法、化学发光微粒子免疫检测法等5种不同厂家的试剂盒,按照拟定行业标准的要求和试验方法,对检出限、线性、准确度、精密度、特异性等项目进行验证。 结果 试剂盒的检出限不高于13.7 pg/mL;准确度、线性、精密度和特异性等其他项目均能满足拟定甲状旁腺激素测定试剂盒行业标准的要求。 结论 制订甲状旁腺激素测定试剂盒行业标准能够规范甲状旁腺激素测定试剂盒的技术要求,为甲状旁腺激素的检测工作及上市后的监督管理提供依据。
[关键词] 甲状旁腺激素;行业标准;化学发光;检出限;线性;准确度;精密度;特异性
[中图分类号] R446.6 [文献标识码] A [文章编号] 1673-7210(2019)01(c)-0105-04
[Abstract] Objective To establish the industry standard of parathyroid hormone assay kit, and to validate the standard by chemiluminescence detection kit, and to evaluate the applicability of the standard. Methods The detection limits, linearity, accuracy, precision and specificity of five kinds of kits from different manufacturers were verified by magnetic particle chemiluminescence and chemiluminescent particle immunoassay according to the requirements and test methods of formulating industry standards. Results The detection limit of the kit was not higher than 13.7 pg/mL, and other items such as accuracy, linearity, precision and specificity could meet the requirements of drafting the industry standard of parathyroid hormone detection kit. Conclusion The formulation of industry standard for parathyroid hormone detection kit can standardize the technical requirements of parathyroid hormone detection kit, and provide the basis for the detection of parathyroid hormone and the supervision and management after the listing.
[Key words] Parathyroid hormone; Industry standard; Chemiluminescent assay; Detection limit; Linearity; Accuracy; Precision; Specificity
甲狀旁腺激素是由甲状旁腺主细胞合成和分泌的直链多肽激素。甲状旁腺主细胞首先合成前甲状旁腺激素原,含115个氨基酸,其在细胞内裂解为含有90个氨基酸的甲状旁腺激素原,后者在细胞内裂解成为含84个氨基酸的多肽,即甲状旁腺素,其分子量约为9.43 kD[1-3]。整分子甲状旁腺激素经水解后产生氨基端片段、羧基端片段及中间片段。甲状旁腺激素在第34~37个氨基酸的位置断裂后,氨基端依然具有完整的甲状旁腺激素全部生物活性,具有生物活性的整分子甲状旁腺激素或氨基端片段半衰期很短[4-5]。甲状旁腺激素调节钙磷代谢,是维持机体钙平衡的主要激素,其分泌水平影响着血钙和血磷水平,促使血钙水平升高,血磷水平下降[6-8]。其作用的主要靶器官是骨和肾脏,主要通过促进肾小管对钙离子的重吸收和磷酸盐的排泄,使血钙浓度增加和血磷浓度下降。血清中甲状旁腺激素水平过低导致低钙血症,从而导致一系列的并发症,如肌肉痉挛、手足抽搐等,也可影响心脏功能,出现QT间期延长并导致心动过速、心室颤动,甚至心肌受损等。甲状旁腺激素通过抑制近端肾小管磷酸钠协同转运蛋白增加肾脏排磷,其缺乏可引起高磷血症。全段甲状旁腺激素水平检测也可用于评估和处理其他包括骨质疏松症和肾性骨病在内的骨代谢疾病[9-13]。骨质疏松症是一种由体内雌激素代谢紊乱导致的以骨量减少、脆性增加和易发骨折为特征的代谢性骨病。甲状旁腺激素可加速骨衬细胞对新分化成骨细胞的招募及破骨细胞的增殖,抑制成骨细胞的凋亡,使骨量及骨密度增加。间歇性小剂量使用甲状旁腺激素具有促进骨合成代谢作用,改善骨微结构,增加骨量,降低骨折发生。甲状旁腺功能亢进会导致甲状旁腺激素分泌增加,可以用于评估甲状旁腺功能亢进。甲状旁腺激素的半衰期仅为3~5 min,切除异常腺体后,甲状旁腺激素浓度明显降低。外科医生通过测定甲状旁腺激素就能评估切除是否完整以及全部分泌功能亢进的甲状旁腺组织是否已完全从患者身上切除。手术时操作失误导致的甲状旁腺被意外切除或甲状旁腺血供手术操作或能量器械热损伤,可导致患者术后发生暂时性或永久性的甲状旁腺功能减退,使甲状旁腺激素分泌不足,从而引起低钙血症。因此,术后进行快速全段甲状旁腺素是判断低钙血症的最好方法。甲状腺术后引流液中的甲状旁腺激素水平可以用于判断术后甲状旁腺是否原位保留及原位保留甲状旁腺激素的分泌功能[14-18]。因此,甲状旁腺激素的检测具有重要的临床意义。
目前,我国国家食品药品监督管理局批准的甲状旁腺激素测定试剂盒有20多家,该试剂盒的检测原理主要是基于双抗体夹心法的抗原抗体间的免疫反应,包括以酶标记和(电)化学发光标记等标记方法的免疫分析试剂盒,可以用于定量检测甲状旁腺激素[19]。目前,尚无统一的甲状旁腺激素国家标准或者行业标准,不同企业的甲状旁腺激素产品技术要求不一致,产品质量也参差不齐,从而导致检验结果缺乏可比性,造成了医疗成本增加,医疗资源浪费。为加强对甲状旁腺激素测定试剂盒的质量控制,迫切需要建立相关的行业标准,以便对市场上的该类试剂盒进行科学、合理的监督管理。按照国家食品药品监督管理局制订、修订医疗器械的项目计划,中国食品药品检定研究院(以下简称“我院”)在参考国内外不同甲状旁腺激素测定试剂盒技术资料的基础上,经过充分调研和征求意见,制订了甲状旁腺激素测定试剂(盒) 行业标准的技术要求,包括检出限、线性、准确度、精密度、特异性等项目。本研究采用了适用甲状旁腺激素测定试剂盒(化学发光法),对该行业标准进行验证。
1 仪器与试药
1.1 仪器
AutoLumo A2000全自动化学发光检测仪(郑州安图生物工程股份有限公司);Maglumi 2000 Plus全自动化学发光测定仪(深圳市新产业生物医学工程股份有限公司);IMMULITE 2000全自动化学发光免疫分析仪[西门子医学诊断产品(上海)有限公司];Access 2全自动免疫分析仪[贝克曼库尔特商贸(中国)有限公司];ARCHITECT i系统[雅培贸易(上海)有限公司]。
1.2 试药
试剂盒:甲状旁腺激素定量检测试剂盒A(磁微粒化学发光法,生产批号:20151130、20160405、20160 629);血清甲状旁腺素(甲状旁腺激素)测定试剂盒B(化学发光法,生产批号:064160712、064160407、0641 60224);全段甲状旁腺激素测定试剂盒C(化学发光法,生产批号:320);甲状旁腺激素测定试剂盒D(化学发光法,生产批号:622187);全型甲状旁腺激素测定试剂盒E(化学发光微粒子免疫检测法,生产批号:00916B000)。
样品:甲状旁腺激素国际标准品(NIBSC code:95/646,100 μg/支)、甲状旁腺激素国家候选品,均由我院提供。其他质控品等样本均由企业提供。
2 方法与结果
2.1 检测方法
按照拟定的行业标准试验方法进行操作,具体内容如下:
2.1.1 检出限 生产企业应提供甲状旁腺激素测定试剂盒的空白限、检出限及参考区间等相关信息。根据提供的信息,对5份浓度近似检出限的低值样本进行检测,每份样本检测5次,对检测结果按照大小进行排序,符合以下的条件,即可认为生产企业提供的空白限和检出限的设置基本合理:①低于生产企业提供的空白限数值的检测结果的数量应不大于3个;②没有高于生产企业提供的参考区间下限的检测结果的数值。
2.1.2 线性 将接近线性区间上限的高值样本按一定比例稀释成至少5个浓度,其中稀释的最低浓度样本须接近线性区间的下限。每一浓度的样本至少重复测定2次,计算其平均值,将测定浓度的平均值与理论浓度或稀释比例用最小二乘法进行直线拟合,并计算线性相关系数r,结果应不低于0.9900。
2.1.3 准确度 有甲状旁腺激素国家(或国际)标准品时:需将国家(或国际)标准品配制成试剂盒线性范围内的高、低浓度的准确度样品(至少2个浓度)进行检测,重复3次,取平均值,计算测定结果的相对偏差,结果应在±15.0%;无国家(或国际)标准品时:采用回收率的方法。即将已知浓度的甲状旁腺激素样本加入到正常人血清中,所加入甲状旁腺激素样本与正常人血清B之间的体积比例为1∶9,计算回收率,结果应在85.0%~115.0%。
2.1.4 精密度 批内精密度:用同一批号试剂盒,不同浓度的质控品(2~3个不同浓度)分别重复测定10次,计算测定结果的平均值和标准差,手工操作试剂盒测定结果的变异系数应不高于10.0%,全自动操作试剂盒测定结果的变异系数应不高于8.0%。批间精密度:使用3个批次试剂盒检测不同浓度的质控品,计算测定结果的平均值和标准差,质控品的测定结果的变异系数应不高于15.0%。
2.1.5 特异性 测定浓度为10 000 pg/mL的甲状旁腺激素降解片段甲狀旁腺激素(1-34)和10 000 pg/mL的甲状旁腺激素降解片段甲状旁腺激素(39-84),平行测定2次,计算均值,结果应不高于6 pg/mL。
2.2 结果
2.2.1 检出限 在游离人绒毛膜促性腺激素(β-HCG)定量标记免疫分析试剂盒等行业标准中,提出了空白限的要求:即用零浓度校准品或样本稀释液作为样本进行检测,重复测定20次,计算信号值的平均值和标准差,根据试剂盒所用标准品的定标曲线方程或者零浓度校准品和相邻校准品之间的浓度-信号值结果进行两点回归拟合得出一次方程,将(平均值+2×标准差)的信号值带入上述方程中,求出对应的浓度值,即为空白限。根据全国医用临床检验实验室和体外诊断系统标准化技术委员会(TC136)要求,甲状旁腺激素测定试剂盒行业标准需要采用“检出限”的要求。验证的甲状旁腺激素试剂盒的空白限为5.3 pg/mL,检出限为13.7 pg/mL,参考区间为15~65 pg/mL;5份浓度接近检出限的低值样本重复检测5次,检测结果按照大小进行排序,结果为7.2~14.2 pg/mL。结果显示,低于生产企业提供的空白限数值的检测结果的数量是0个,没有高于生产企业提供的参考区间下限的检测结果,表明生产企业提供的空白限和检出限的设置基本合理。因此,行业标准中规定试剂盒的检出限应不高于13.7 pg/mL。
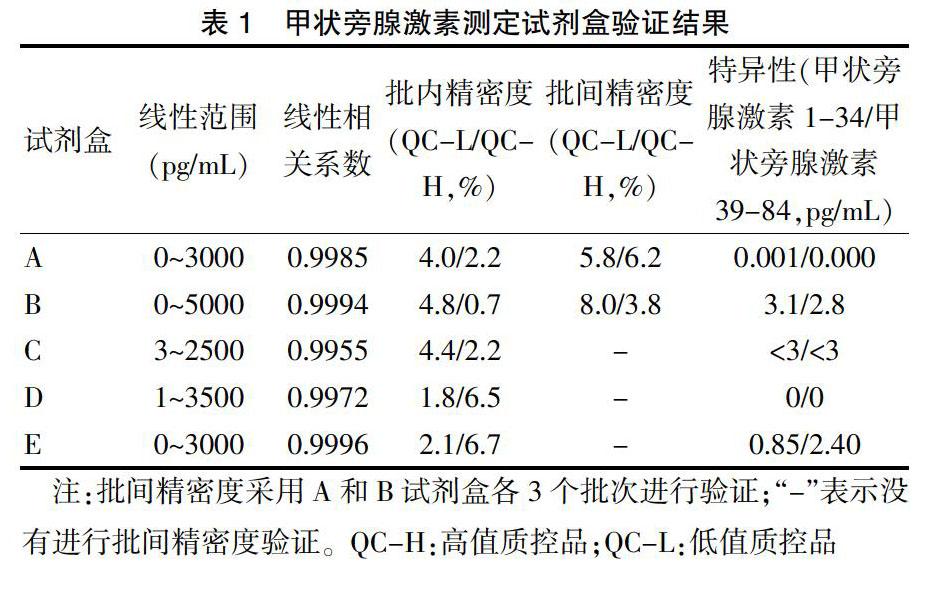
2.2.2 线性范围及相关系数 各企业的试剂盒均在线性区间内,剂量-反应曲线相关系数(r):0.9955~0.9996,高于行业标准的r≥0.9900的要求,表明在试剂盒线性范围内,量-效关系反应良好。
2.2.3 批内、批间精密度 验证的试剂盒均是全自动操作试剂盒,高值质控品(QC-H)和低值质控品(QC-L)测定结果的变异系数均不高于行业标准规定的上限8.0%,表明各试剂盒测定同一样本的测定值稳定,重现性良好。
2.2.4 特异性 目前,市场上甲状旁腺激素测定试剂盒基本是测量全段甲状旁腺激素。因此,选择甲状旁腺激素降解片段甲状旁腺激素(1-34)和甲状旁腺激素(39-84)作为特异性样品,用于评价其干扰。各企业生产的试剂盒的测定结果均不高于3.1 pg/mL,部分企业生产的试剂盒对这两个样本没有响应值;均低于行业标准的上限6 pg/mL。表明甲状旁腺激素降解片段不会干扰全段甲状旁腺激素的测定结果。见表1。
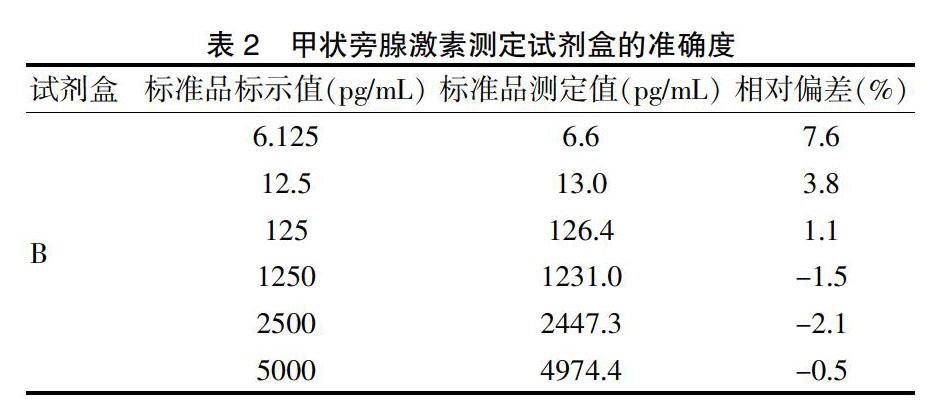
2.2.5 准确度 准确度是试剂盒最重要的性能要求。目前,市场上没有甲状旁腺激素国家标准品;而Parathyroid Hormone 1-84国际标准品是重组人源的甲状旁腺激素1-84,国内试剂盒生厂商只有少数几家溯源到这一支标准品,故不能按照相对偏差对市场上所有的试剂盒进行要求。因此,甲状旁腺激素测定试剂盒行业标准提供了相对偏差和回收率两种方法进行评价。本研究采用溯源到国际标准品的试剂盒进行相对偏差的验证,将国际标准品配制成试剂盒线性区间内的6种浓度梯度的样品,计算国际标准品的测定值与理论值的相对偏差,结果在-2.1%~7.6%,符合行业标准的要求,表明试剂盒赋值准确。见表2。采用不能溯源到国际标准品的试剂盒进行回收率的验证,将浓度为1153.5 pg/mL QC-H加入到正常人血清(7.8 pg/mL),测定结果为136.1 pg/mL,计算样本的回收率为112%。准确度的验证结果满足甲状旁腺激素测定试剂盒行业标准的要求。
3 讨论
我国医疗器械体外诊断试剂产业发展迅猛,但是体外诊断试剂行业标准的制修订工作进展缓慢,我国许多种类的体外诊断试剂产品没有统一的行业标准,医疗器械的监督管理工作有待于加强[20-22]。目前,市场上甲状旁腺激素测定试剂盒各自的技术要求参差不齐,缺乏统一的评价尺度,不能对其进行有效的性能评价。制订合理有效的甲状旁腺激素测定试剂盒行业标准具有十分重要的意义。
国家食品药品监督管理总局批准的甲状旁腺激素测定试剂盒包括磁微粒化学发光法、化学发光免疫分析法、荧光免疫层析法、量子点免疫荧光、酶联免疫法、荧光磁微粒酶免法等,其中化学发光法试剂盒约占75%以上。与酶联免疫法比较,化学发光法具有灵敏度高、线性范围广、操作方便等优点,在临床甲状旁腺激素检测中应用广泛。本研究采用化学发光法试剂盒进行验证,并选择国内常用的2种国产试剂盒和3种进口试剂盒进行验证,均为全自动操作试剂盒。对这些试剂盒的检出限、线性、准确度、精密度和特异性等进行验证,结果均符合行业标准的要求。经验证,制订的甲状旁腺激素测定试剂盒行业标准各项技术要求较为合理,可满足该类试剂盒的性能评价,具有很好的应用性。
在以往,制订的体外诊断试剂产品定量标记免疫分析试剂盒行业标准采用“空白限”的要求。根据全国医用临床检验实验室和体外诊断系统标准化技术委员会要求,甲状旁腺激素测定试剂盒行业标准采用“检出限”的要求,并进行了验证,结果符合要求。准确度是定量标记免疫分析試剂盒最关键的技术指标,在该行业标准中规定:如果有国家或国际参考品,必须采用相对偏差评价准确度;如果没有国家或国际标准品,可以采用回收方法进行评价。本课题组正在开展甲状旁腺激素国家标准品的研制工作,本研究中提供的一支国家候选品的验证结果很不理想,相对偏差已经超过15%,说明原料的甲状旁腺激素抗原表位不能与试剂盒包被的抗体有效结合。我院将继续筛选甲状旁腺激素原料制备国家标准品,以满足甲状旁腺激素测定试剂盒质量评价的需要。
[参考文献]
[1] 张萌萌.甲状旁腺素的生物学研究与成骨作用[J].中国骨质疏松杂志,2017,12(23):1648-1653.
[2] Souberbielle JC,Roth H,Fouque DP. Parathyroid hormone measurement in CKD [J]. Kidney Int,2010,77(2):93-100.
[3] 邱丹丹,蒋松.慢性肾脏病甲状旁腺激素代谢异常的研究进展[J].肾脏病与透析肾移植杂志,2017,2(26):174-178.
[4] Takahata M,Awad HA,O′Keefe RJ,et al. Endogenous Tissue Engineering:PTH Therapy for Skeletal Repair [J]. Cell Tissue Res,2012,347(3):545-552.
[5] Goettsch C,Iwata H,Aikawa E. Parathyroid hormone:critical bridge between bone metabolism and cardiovascular disease [J]. Arterioscler Thromb Vasc Biol,2014,34(7):1333-1335.
[6] 朱建明,黄建平.甲状旁腺功能减退症的激素替代治疗进展[J].医药导报,2017,36(A01):59-61.
[7] 周晓莉,饶一武,朱梅.甲状腺癌术后血钙及血清甲状旁腺激素检测的临床意义[J].热带医学杂志,2015,2(15):237-240.
[8] 陈澎涛.甲状腺全切手术后患者甲状旁腺激素和血钙的水平变化[J].上海医药,2017,38(13):45-47.
[9] 周露,陈仁贵,叶婷,等.糖尿病肾病与慢性肾小球肾炎血液透析患者甲状旁腺激素水平研究[J].临床军医杂志,2018,4(46):417-419.
[10] 王忻,赵毅,朱悦,等.甲状旁腺激素用于预防脊髓损伤后骨质疏松的实验研究[J].临床和实验医学杂志,2018, 3(17):230-234.
[11] 谭磊,邢攸军.甲状旁腺激素通过增加血管及骨的形成防治骨质疏松[J].中国骨质疏松杂志,2016,9(22):1112-1115.
[12] 刘明,潘薇,陈德才.甲状旁腺激素治疗骨质疏松症的研究进展[J].中华骨质疏松和骨矿盐疾病杂志,2012,2(5):151-156.
[13] 颜海彬,张炳云.联合使用甲状旁腺激素和辛伐他汀对去卵巢大鼠骨质疏松症的治疗有叠加效应[J].中国骨质疏松杂志,2016,3(22):300-303.
[14] 戴佳奇,张云,严杰,等.术中快速甲状旁腺激素检测在甲状腺手术中的应用研究[J].中华内分泌外科杂志,2017, 4(11):330-333.
[15] 张立永,赵文新,黎世雄,等.甲状腺术后引流液甲状旁腺激素测定的意义探索[J].中华内分泌外科杂志,2017, 5(11):395-398.
[16] 晏龙强,李富新,章帅,等.甲状腺癌行甲状腺全切除术后甲状旁腺激素水平变化的影响因素分析[J].中国全科医学,2015,29(18):3579-3581.
[17] 王曉妹,朱文秀,宋博,等.甲状腺癌全切除术围术期常规化监测甲状旁腺激素的临床价值探讨[J].国际检验医学杂志,2016,13(37):1836-1837.
[18] 韩树坤.继发性甲状旁腺功能亢进手术术中快速甲状旁腺激素测定33例临床分析[J].中国实用医药,2015, 7(10):59-60.
[19] 甘良英.甲状旁腺激素及其检测方法新进展[J].中国血液净化,2016,5(15):266-268.
[20] 徐智勇,鲁军,高小坤.体外诊断试剂冷链管理[J].中国医学装备,2018,15(3):110-112.
[21] 高尚先,孙彬裕,曲守方,等.关于我国体外诊断试剂监督管理改革的建议[J].药物分析杂志,2006,26(8):1175-1180.
[22] 杨海洁,蒋积余,吴永鑫,等.PDCA管理法在医院体外诊断试剂管理中的应用[J].中国医学装备,2017,14(11):129-132.
(收稿日期:2018-05-28 本文编辑:王 蕾)
