Fenton氧化对微生物群落结构和功能基因的影响
2019-03-18高春阳张坤峰于文赫杜显元韩占涛
高春阳 张 羽 张坤峰 于文赫 杜显元 郑 瑾 韩占涛
(1.中国地质科学院水文地质环境地质研究所;2.中国地质大学(北京) 3.中国石油集团安全环保技术研究院有限公司;4.石油石化污染物控制与处理国家重点实验室)
0 引 言
石油被广泛应用于生产及生活的各个领域,包括工业、农业、交通运输业等,素有工业“血液”之称,目前,全球石油总产量超过30亿t[1-3]。然而,在石油的开采以及运输等过程中出现的“跑、冒、滴、漏”等现象常导致其进入土壤和地下水进而造成污染[4-5]。石油是由烷烃、环烷烃、芳香烃等组成的混合物,具有高黏度、低流动性、低挥发性和低生物降解性等特点,一旦进入土壤和地下水将很难通过土壤和地下水的自我净化能力去除[6]。现有石油类污染土壤的修复方法大体包括物理法、化学法和生物法[7-11]。其中化学氧化法具有修复污染物范围广、修复周期短、氧化剂易得等优点,是目前处理地下水、沉积物和土壤石油污染的主流方法[12]。
化学氧化技术中常用的化学药剂包括O3、KMnO4、Na2S2O8和Fenton试剂等,其中Fenton试剂因其氧化后不产生其他副产物而被广泛应用[13]。在高浓度石油烃污染土壤修复中通常采用化学氧化技术作为预处理将高浓度的石油烃降低为低浓度的石油烃,然后再采用微生物技术或自然监测法进行后续修复[14]。然而,化学试剂不仅能降解石油烃同时也是一种杀菌剂,在氧化过程中不可避免地对土著微生物造成影响,而致使后续的生物过程失效。因此评价化学氧化后土壤中的微生物的群落结构和功能基因的变化对后期的生物降解过程具有重要的意义。
目前在对Fenton试剂的研究中提出采用固体Na2CO3·1.5H2O2(溶于水后分解:Na2CO3•1.5H2O2→Na2CO3+1.5H2O2)来替代H2O2形成Fenton试剂,通过Na2CO3·1.5H2O2缓慢释放H2O2来避免与石油烃反应时发生的自由基淬灭反应[15]。因此,本研究采用H2O2和Na2CO3·1.5H2O2所形成的两种类Fenton试剂对石油烃污染的土壤进行氧化处理,然后通过16s rDNA高通量技术对土壤中土著微生物的群落结构和功能基因进行分析。
1 实验部分
1.1 试剂材料和仪器
过氧化氢(ω(H2O2)=30%,分析纯)、过碳酸钠(Na2CO3·1.5H2O2,分析纯)、四氯化碳(CCl4,分析纯)、七水合硫酸亚铁(FeSO4·7H2O,分析纯)、一水合柠檬酸(C6H8O7·H2O,分析纯),FastDNA kit for soil(MP Biomedicals),Tris-HCl缓冲液。
实验土壤采自新疆油田原油污染地区,挑除石块、动植物残体后过2 mm筛,密封后于-70℃冰箱保存。石油污染土壤的基本理化性质见表1。

表1 石油污染土壤的基本理化性质
实验所用仪器包括:KH-600TDB型超声波清洗仪(昆山市超声仪器有限公司)、LD5-10B型低速大容量离心机(江苏同居科技仪器有限公司)、Oil-480型红外测油仪(北京华夏科创仪器股份有限公司)、7900型PCR仪(美国ABI)、QuantiFluorTM-ST 微型荧光计(美国Promega-GloMax Prome)。
1.2 分析方法
土壤含油率的测定采用超声萃取法[16],即称取干重为5 g的土壤于EPA VOA瓶中,然后在瓶中加入10 mL CCl4溶液后于100 W的超声波条件下超声10 min;随后在800 r/min的离心机中进行离心5 min;将上清液通过盛有1 cm厚度的无水硫酸钠(300℃干燥2 h)长颈玻璃漏斗(漏斗颈部塞有少许玻璃棉)收集至锥形瓶中;然后重复上述步骤至样品液无色。最后上清液通过稀释于红外测油仪中进行测定。
1.3 土壤微生物的测序
采用FastDNA kit for soil试剂盒对土壤中的DNA进行提取,完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA,再使用带有barcode的特异引物进行PCR扩增;参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。
1.3.1 Miseq文库构建
Miseq文库构建主要包括以下步骤:
1)通过PCR将Illumina官方接头序列添加至目标区域外端;
2)使用凝胶回收试剂盒切胶回收PCR产物;
3)Tris-HCl缓冲液洗脱,2%琼脂糖电泳检测;
4)氢氧化钠变性,产生单链DNA片段。
1.3.2 Miseq测序
Miseq测序主要包括以下步骤:
1)DNA片段的一端与引物碱基互补,固定在芯片上;
2)以DNA片段为模板,芯片上固定的碱基序列为引物进行PCR合成,在芯片上合成目标待测DNA片段;
3)变性、退火后,芯片上DNA片段的另一端随机与附近的另外一个引物互补,也被固定住,形成“桥(bridge)”;
4)PCR扩增,产生DNA簇;
5)DNA扩增子线性化成为单链;
6)加入改造过的DNA聚合酶和带有4种荧光标记的dNTP,每次循环只合成一个碱基;
7)用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;
8)将“荧光基团”和“终止基团”化学切割,恢复3′端黏性,继续聚合第二个核苷酸;
9)统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。
1.4 实验设计
实验共分3组,分别为空白组(CK)、H2O2形成的类Fenton试剂组(HP)和Na2CO3·1.5H2O2形成的类Fenton组(SPC),每组称取所采集土壤样品100 g于250 mL锥形瓶中,实验前分别配置0.5 M的FeSO4·7 H2O和0.5 M的C6H8O7·H2O溶液,过程中依次加入柠檬酸溶液和硫酸亚铁溶液,然后加入H2O2溶液和Na2CO3·1.5 H2O2固体,最后补充去离子水使水土比控制为1∶1。药剂添加后,将锥形瓶置于恒温摇床中于30℃、150 r/min下反应2 d,实验配方如表2。
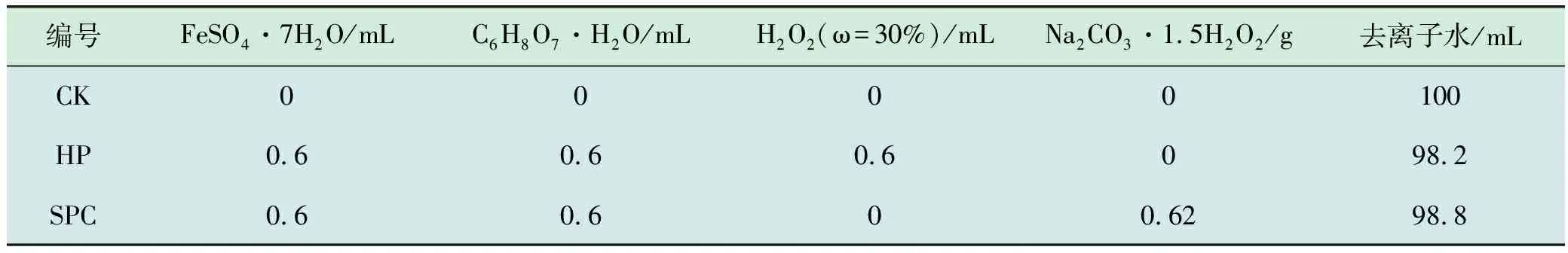
表2 实验配方
2 结果与讨论
2.1 两种氧化方式对原油的降解效果比较
氧化后土壤中的原油含量如图1所示,由图1可见,SPC组对原油的降解效果明显好于HP组,其中SPC组经过氧化后原油含量从42 326.24 mg/kg降解到20 960.33 mg/kg,相应的降解率达到50.48%,而HP组氧化后的原油含量为27 689.33 mg/kg,降解率为34.58%。占升等[15]应用H2O2和Na2CO3·1.5H2O2活化Na2S2O8对PAHs污染的土壤进行降解,得出Na2CO3·1.5H2O2活化好于H2O2,这可能是由于Na2CO3·1.5H2O2为有载体的H2O2,在反应的过程中缓慢释放H2O2,进而避免了氧化剂产生的自由基间的淬灭反应,导致其降解效果更好。
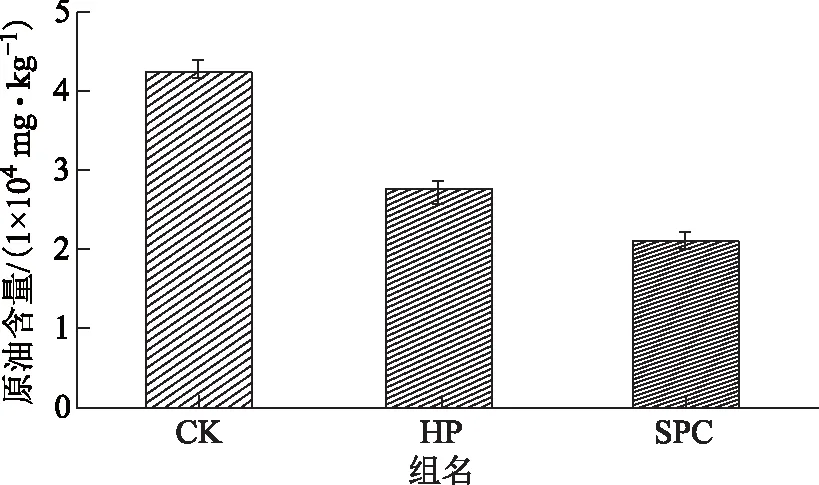
图1 氧化后各组的原油含量
2.2 两种氧化方式对土著微生物多样性的影响
氧化反应后,对3个样品土壤中的Alpha微生物多样性分析,计算的Shannon、Simpson、Ace、Chao、Coverage等指数如表3所示。

表3 土壤样品微生物群落多样性指数
Chao和Ace指数表征样品微生物群落丰度,数值越大丰度越高,从表3得出,两种氧化剂均使微生物群落丰度降低,未进行氧化的CK组,其Chao指数和Ace指数分别为287.833 333和283.126 841,而经过HP和SPC氧化处理后的Chao和Ace则降低到210~220,且这两种氧化方式对微生物群落丰度的影响相差不大。Shannon指数和Simpson指数表征微生物的多样性及均匀性。由表3可知,经过氧化处理后Shannon指数变化不大,即说明氧化后对微生物的多样性影响不大。比较两种氧化剂氧化后的Simpson指数发现,HP氧化后其Simpson指数降低,这表明经过HP氧化后土壤中的微生物群落均匀性变差,而SPC氧化后的Simpson指数则变化不大。
通过对图2的3个土壤样品OUT分布物种Venn图可以得出CK组、HP组和SPC组共有的OUT有146个,经过氧化处理的HP和SPC组均与未进行氧化处理的空白组共有的OUT有166(146+20),且经过HP和SPC氧化后的物种大部分是相同的。
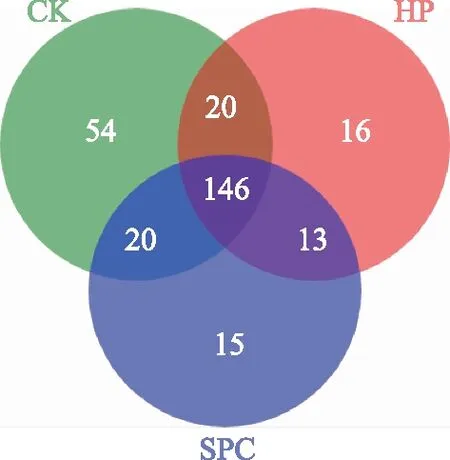
图2 土壤样品OUT分布Venn图
在门水平分析土壤样品中的微生物群落结果组成,如图3所示,化学氧化后,土壤中的优势菌种发生变化,未进行氧化的CK组,其优势菌种为放线菌门(Actinobacteria)占整体的47.16%,其次为变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)分别占总体的31.54%和18.58%。而经过HP和SPC氧化后土壤中的优势物种均变为了变形菌门(Proteobacteria),放线菌门(Actinobacteria)则变为次级优势种群,但所占的比例各有不同,在HP组中占80.66%,而在SPC组则占据61.16%。其次CK组中存在的异常球菌-栖热菌门(Deinococcus-Thermus)(1.46%)则在氧化后消失。有研究表明[17]放线菌门(Actinobacteria)可以在高温,低含水量的条件下形成孢子,被认为是对有机质分解均有良好作用的菌门。在本研究中放线菌门在长期原油污染土壤中形成了优势菌属,具有一定的原油降解能力,但经过化学氧化后此菌门变为次一级的优势物种,因此若后续进行生物修复,可能化学氧化具有一定的影响。
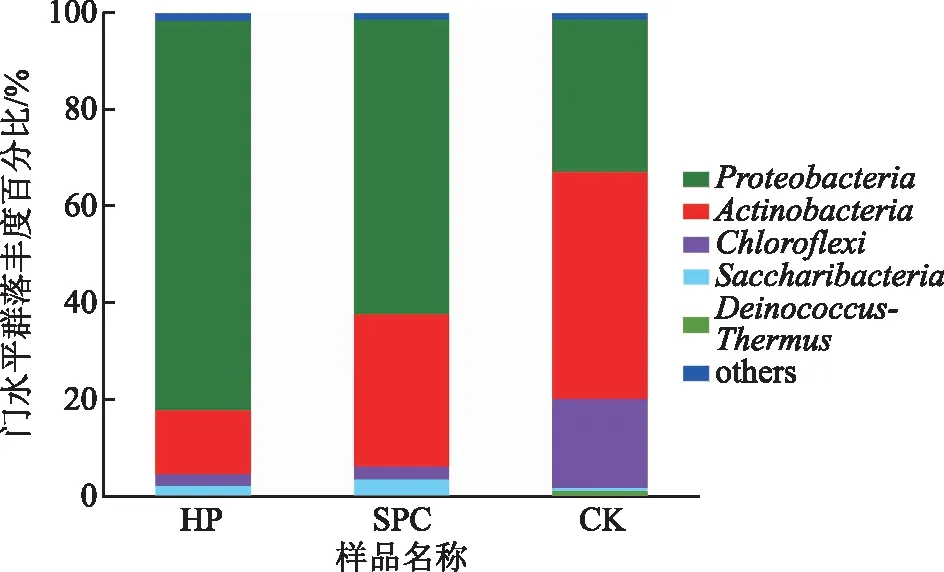
图3 不同氧化处理后样品中微生物群落结构组成(门水平)
2.3 氧化后功能基因变化情况
氧化后功能基因变化采用KEGG基因组数据库进行分析,具体包括细胞过程通路、新陈代谢通路、遗传信息处理通路、环境信息处理通路、人类病症相关通路和生物体系统通路[18]。不同氧化方式氧化前后在KEGG Pathway 功能分类上所含基因数目和丰度情况如图4所示。从图4可看出两种氧化剂氧化后在基因数量上均出现降低的现象,未进行氧化的CK组总基因数量为58 093 193个,而经过HP和SPC氧化后总基因数量则分别下降到36 282 211个和32 355 524个,其中对控制新陈代谢通路上的基因影响最大,由CK的34 975 895个分别降低到20 775 146和19 424 732个,SPC对基因数量的影响更大。这是由于氧化剂也是杀菌剂,氧化过程中致使一部分的土著微生物死亡所致[14]。然而在各种基因在总体基因的丰度上变化不大,其中HP氧化后在细胞过程通路和环境信息处理通路占比略有增加,分别从原占比的3.74和16.3增加到5.68和17.76。

图4 氧化前后在KEGG Pathway 功能分类上所含基因数目和丰度情况
3 结 论
1)H2O2和Na2CO3·1.5H2O2形成的类Fenton试剂对原油污染土壤的石油类降解率分别为34.58%和50.48%,Na2CO3·1.5H2O2所形成的类芬顿试剂降解效果更好。
2)H2O2和Na2CO3·1.5H2O2形成的类Fenton试剂氧化后均对土壤中的土著微生物丰度产生影响,表征微生物群落丰度的Chao和Ace指数有原来的287.833 333和283.126 841降低到210~220,且氧化后土壤中的优势微生物种群发生变化,原来的放线菌门(Actinobacteria)变为次级优势种群,而变形菌门(Proteobacteria)成为新的优势种群。
3)氧化后土壤中的总基因数量降低,两种氧化方式氧化后总基因数量由58 093 193个分别下降到36 282 211个和32 355 524个,而各种通路基因在总基因的占比变化不大,其中HP氧化后在细胞过程通路和环境信息处理通路占比略有增加,分别从原占比的3.74和16.3增加到5.68和17.76。
