帕金森病患者吞咽障碍的临床分析
2019-03-17王伟马宇敏孙丽王莹陈伟观
王伟,马宇敏,孙丽,王莹,陈伟观
帕金森病(Parkinson’s disease,PD)患者吞咽障碍的发生率在不同研究中差异巨大,从11%~87%不等[1-2]。这种巨大的差异可能与人们对吞咽障碍的定义不同及评估手段差异有关。最新的一项荟萃分析指出,PD患者客观存在口咽部吞咽障碍的发生率高达82%[3]。吞咽障碍作为最常见的非运动症状之一,严重影响了PD患者的生活质量。PD患者吞咽障碍可导致药物摄入不足、营养不良、脱水和继发性肺炎等多种并发症,其中继发性肺炎是导致PD患者死亡的首要原因[4]。PD患者吞咽障碍的临床表现形式多样,除了主观的吞咽困难,还可以表现为流涎,进食后口腔内食物残留,食团形成减少,口腔及咽部进食速度减慢,咽部吞咽反射触发延迟,食管上括约肌直径减小,食团停滞及误吸等。但目前,人们对PD患者吞咽障碍的发生机制及影响因素无确切分析。本研究通过使用吞咽X线荧光透视检查(Video-fluoroscopy Swallowing Study,VFSS)评估PD患者的吞咽功能,有助于发现PD患者早期的吞咽功能障碍,从而及时干预,减少并发症的发生,提高PD患者远期生活质量。
1 资料与方法
1.1 一般资料 本研究选取2017年3月~2018年6月在南通大学附属医院神经内科及康复医学科、南京市第一医院神经内科就诊的PD患者83例。纳入标准:符合中华医学会神经病学分会帕金森病及运动障碍学组制定的2016年帕金森病临床诊断标准[5];可经口进食;Hoehn&Yahr(H-Y)分期:0~4期;签署知情同意书。排除标准:已被证实的帕金森叠加综合征、继发性帕金森综合征;脑卒中等其他神经系统疾病或消化系统异常引起的吞咽困难;装有心脏起搏器等植入性电极的患者;生命体征不稳定、不能配合医生指令、头颈部外伤或肿瘤术后及留置胃管的患者;存在认知障碍的患者(MMSE总分30分,文盲≤17分,小学程度≤20分,中学程度≤24分为认知减退)。
1.2 方法及评定标准 VFSS目前被认为是诊断吞咽障碍的“金标准”[1],患者坐位下进食,选择侧位观察吞咽造影情况,造影剂食物按照先糊状,后液体及固体的顺序,按3ml、5ml、10ml逐渐加量,一旦发生误吸,立即停止该性状食物的检查。根据VFSS结果,将患者分为吞咽障碍组(PD-D)63例和非吞咽障碍组(PD-ND)20例。分析与PD患者吞咽障碍发生的有关情况;根据Schrag等[6]提出的临床表现分类法,将PD患者分为震颤型、僵直型和混合型;根据H-Y分期判断疾病严重程度;通过统一帕金森运动评分量表(UnifiedParkinsonDiseaseRatingScale,UPDRS)Ⅲ评估患者运动功能,分数越高,运动功能越差;通过非运动症状评估量表(Non-motor symptoms scale,NMSS)[7]、自主神经症状量表(Scale for outcomes in PD for autonomic symptoms,SCOPA-AUT)[8]、匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)[9]、汉密尔顿抑郁量表(Hamilton depression scale,HAMD)[10]、汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)评估患者非运动症状[11],分数越高越严重;左旋多巴等效剂量(Levodopa Equivalent Dose,LED)比较不同抗帕金森病药物的疗效;通过帕金森综合评分量表(Unified Parkinson’s Disease Rating Scale,UPDRS)Ⅱ评估患者日常生活能力,分数越高,日常生活能力越低;通过帕金森病生活质量问卷(Parkinson Disease Quality of Life Questionnaire,PDQL)评估患者生活质量[12],分数越高,生活质量越差。

2 结果
2.1 吞咽障碍的发生与PD患者一般情况的比较 PD-D组较PD-ND组年龄更大,更容易出现吞咽障碍(P<0.01),见表1。

表1 2组患者一般情况的比较
与PD-ND组比较,aP<0.01
2.2 2组患者疾病相关特征的比较 PD-D组较PD-ND组病程更长(P<0.01),H-Y分期更严重(P<0.05),LED剂量更高(P<0.01),UPDRSⅢ、SCOPA-AUT、HAMD、HAMA、UPDRSⅡ及PDQL评分均更高(P<0.01,0.05),见表2。
2.3 PD合并吞咽障碍的独立危险因素分析 将年龄、病程、H-Y分期、UPDRSⅢ、SCOPA-AUT、HAMD、HAMA、LED、UPDRⅡ、PDQL作为自变量,以有无吞咽障碍作为因变量进行非条件性Logistic回归分析。结果显示,年龄、H-Y分期、UPDRSⅢ及HAMD是吞咽困难的独立影响因素,且随着年龄增大,发生吞咽困难的可能性增加,PD患者的H-Y分期及运动症状越严重,更容易出现抑郁,见表3。

表3 PD合并吞咽障碍的独立危险因素分析
3 讨论
PD患者以运动迟缓、协调能力下降、速度减慢为主要表现。PD患者的运动能力下降可以明显影响吞咽功能,破坏正常吞咽过程,导致喉头抬高,咽期及吞咽持续时间延长,吞咽反射触发延迟,并最终导致误吸[13]。相关研究指出,随着病程的延长,神经退行性变加重,PD患者的吞咽相关肌肉可能出现失神经支配,从而导致咽期肌肉萎缩[14]。吞咽困难作为一种常见的PD患者非运动功能障碍,且在帕金森病患者中极为常见,目前临床上对吞咽障碍的评估[15],主要包括筛查(洼田饮水试验)、临床功能评估(标准吞咽功能量表、吞咽功能临床评估表等)和仪器评估(VFSS、纤维内镜吞咽功能检查、肌电图、超声检查)等三方面,其中VFSS被认为是诊断PD吞咽障碍的“金标准”[1]。该研究中PD患者吞咽障碍的发生率为75.9%,符合之前研究报道的11%~87%不等的吞咽障碍发生率[1-2]。这些巨大差异可能与人们对吞咽障碍的定义不同及评估手段差异有关。
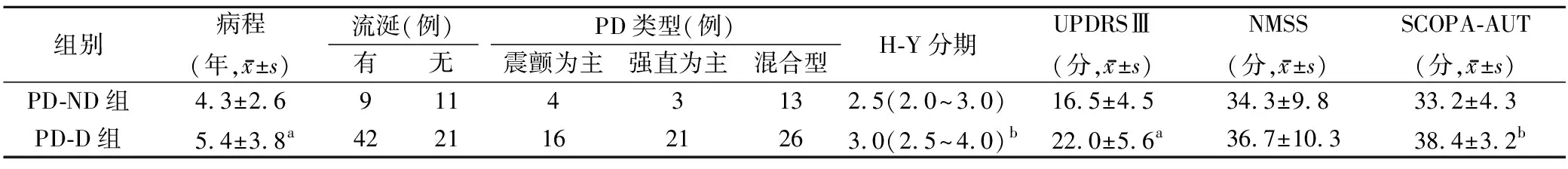
表2 2组患者疾病相关特征比较

组别PSQI(分,x-±s)HAMD(分,x-±s)HAMA(分,x-±s)LED(mg,M)UPDRSⅡ(分,x-±s)PDQL(分,x-±s)PD-ND组6.3±2.513.0(10.0~15.0)9.0(6.0~12.0)283.0(215.6~325.0)12.5±4.325.5±4.6PD-D组7.1±3.214.0(10~17.0)b12.0(9.0~13.0)b315.0(284.0~395.0)a16.3±2.4a32.4±5.8a
与PD-ND组相比,aP<0.01,bP<0.05
本组资料中,我们发现年龄为PD患者吞咽障碍的独立危险因素,这与之前Ding等[16]得出的结论一致,这提示老年PD患者更容易出现吞咽障碍;即使在非PD患者中,老年人也更容易出现吞咽障碍[17]。这可能与老年人肌肉减少,咽部肌肉力量减弱及反应速度下降有关。而吞咽障碍可能反过来加重老年患者的肌肉萎缩及力量下降,从而导致营养不良及误吸,增加PD患者的死亡率。因此,我们必须重视老年PD患者的吞咽功能评估,并给予及时的干预。
本研究发现H-Y分期及UPDRSⅢ也是PD患者吞咽障碍的危险因素,结果与之前的研究相似[16,18],提示PD病情严重程度与吞咽障碍明显相关。吞咽行为涉及一系列复杂的神经肌肉活动,包括口腔、咽部及食道阶段,其中每个阶段受控于不同的神经机制。受PD神经病理过程影响的多巴胺能基底神经节系统,在髓内吞咽系统中起重要作用。PD患者因纹状体中缺乏多巴胺可能损害到髓内吞咽网络。PD患者口咽部吞咽障碍与受损的基底神经节控制的口咽部肌肉运动障碍和肌肉僵硬有关[19]。随着PD患者病情加重,多巴胺能持续降低,可能导致吞咽系统功能的下降。
本研究指出,HAMD是PD吞咽障碍的独立危险因素,合并吞咽障碍的PD患者更容易出现抑郁。这可能与PD吞咽障碍患者可能出现各种口腔及咽部症状而产生羞愧、恐惧,担心被他人排斥及耻笑等心理有关。因此,我们可针对合并吞咽障碍的PD患者制定合适的饮食方案,帮助患者减少进食时的心理压力。
与之前研究结果不同的是,我们发现流涎及吞咽障碍并没有明显相关性[20],这可能与评估吞咽障碍的方法不同有关。早期的研究中,吞咽困难的诊断多依靠量表及患者自我评估[21],而本研究中采取VFSS,能更准确的诊断隐匿的吞咽障碍的患者。
本研究的主要局限性是样本量相对较小,门诊上的PD患者病情较轻,调查结果可能存在偏倚。下一步的研究需要进一步扩大样本量,加强患者的随访。
