DNA 免疫技术在单克隆抗体开发中的研究进展
2019-03-15叶尔那扎尔努尔吐热邱丽芬张富春张茂祥
叶尔那扎尔·努尔吐热 邱丽芬 张富春 张茂祥
(1. 广州中医药大学华南针灸研究中心,广州 510000;2. 新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
自1972年杂交瘤技术问世以来,治疗性单克隆抗体的开发成为医学和科学研究的热点[1]。DNA免疫技术从1990年开始,主要应用于针对流感病毒感染引起的传染性疾病的疫苗研发[2-5]。DNA免疫技术与传统的蛋白免疫最大区别在于目的抗原的表达方式,即蛋白质免疫首先在体外合成和纯化抗原,然后将蛋白质转入动物体内产生免疫应答反应,而DNA免疫将带有目的基因序列的质粒DNA转入动物体内,因此外源基因序列在宿主细胞内得以表达并诱导机体免疫应答[6]。靶向抗原的表达方式对于诱导产生高滴度、高亲和力的抗体至关重要,多项研究表明DNA免疫诱发产生的单克隆抗体的专一性和稳定性明显高于传统的蛋白质免疫。
DNA免疫在宿主细胞内表达目的基因并诱导机体免疫应答至少有3种机制,包括直接转染体细胞、直接转染专职抗原递呈细胞(Antigen presenting cells,APCs)和类似凋亡机制(图1)。直接转染体细胞:将外源DNA分子直接转入到动物体内,肌肉细胞被激活产生MHC I类分子,从而诱导机体免疫应答,然而研究表明直接转染体细胞诱导产生的免疫应答反应中并非肌细胞起主导作用,交叉激活专制抗原递呈细胞(Antigen presenting cells,APCs)才是诱导机体免疫应答的关键。直接转染专职APCs是指少量的专职 APCs可在注射部位直接被转染,产生内源性蛋白,经MHC I和MHC II分子完成内源性抗原的递呈,其中树突状细胞(Dendritic cells,DC)在肌肉注射质粒DNA所引起的免疫应答中发挥重要作用,一方面未成熟的树突状细胞(Immatured dendritic cells,iDC)识别外源DNA分子被激活,从而能够将MHC I 类复合体直接递送到细胞表面,同时表达免疫细胞协同刺激分子CD80/86,成熟的树突状细胞(Matured dendritic cells,mDC)能够激活CD8+T 细胞免疫应答反应;另一方面将外源质粒DNA激活树突状细胞促使它捕获细胞间隙的多肽片段复合物,进而经内化后形成 MHC II类复合体递送到细胞表面,从而激活CD4+T细胞,同时在不同细胞因子的协同作用下诱导机体体液免疫或细胞免疫反应。类似凋亡机制是指目的抗原或者表达目的抗原的重组质粒序列本身具有转导特性,但是目前这些蛋白的转导作用机制尚不清楚[7-9]。
DNA 免疫技术在制备抗体中的应用,尤其是对高效治疗性单克隆抗体的开发具有重要意义,与传统蛋白质或多肽免疫方式相比较,DNA 免疫具有诸多优势。本文根据前人的研究成果,对DNA 免疫表达载体的构建、提高DNA免疫效率的优化方案、质粒DNA的传递方式及其优点和发展前景进行论述。
1 DNA免疫的构建
1.1 抗原的设计
DNA 免疫抗原的设计需要根据抗原本身的特性而灵活使用,因此根据抗原的特性和自身实际需要,在设计引物和表达载体时对蛋白质原始序列和特征进行改造和优化,获得符合实际需要的重组质粒DNA,但在设计抗原时要保持抗原的免疫原性和原有的生物学功能,以便最终得到能够识别天然抗原表位的高特异性的单克隆抗体(表1)。
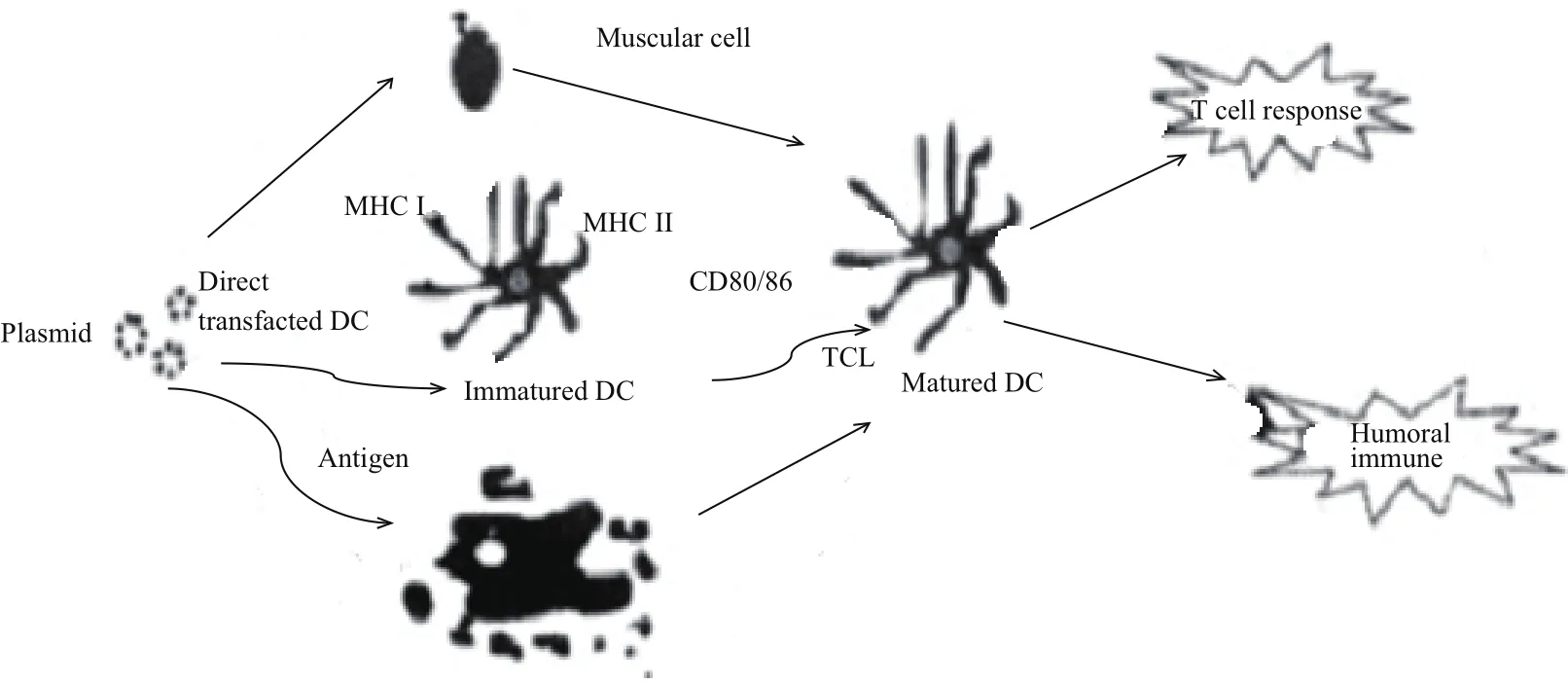
图1 DNA免疫在体内诱导产生免疫应答的3种机制
一般来说,将编码蛋白的全长基因序列插入到表达载体上,获得高特异性单克隆抗体通常适用于大多数蛋白,尤其是可分泌蛋白或细胞表面膜蛋白[10-19],包括人促甲状腺激素受体(Human thyrotropin receptor,hTSHR)、柯萨奇病毒和腺病毒受体(Coxsackievirus and adenovirus receptor,CAR)、前列腺特异性抗原(Prostate specific antigen,PSA)等。如果靶向抗原是单次跨膜蛋白,我们可以选择性地将编码细胞外或者细胞内蛋白区域的质粒片段插入到表达载体上,可以诱导产生针对跨膜蛋白细胞外或者细胞内区域的单克隆抗体[23-27]。对于细菌毒素的靶点,改造更具有其优越性。例如,研究者将艰难梭状芽胞杆菌毒素A,幽门螺杆菌空泡细胞毒素等细菌毒素作为靶向抗原,选择性地去除具有毒性的功能区域而不改变蛋白质的免疫原性,经过如此修饰而得到的单克隆抗体,不仅对机体没有毒害作用,而且能够有效地预防和诊断由细菌感染引起的毒素侵害[28-29]。Puttikhunt等[30]报道使用膜蛋白锚定序列将登革热病毒NS1的跨膜区域转换成膜蛋白。
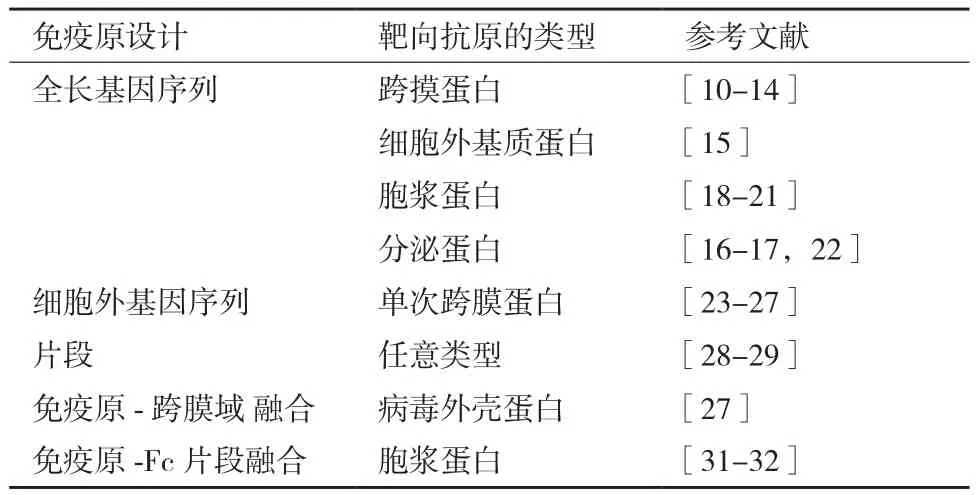
表1 免疫原设计
1.2 表达载体中启动子的选择和功能优化
DNA 免疫载体设计中高效启动子对于提高目的抗原在宿主细胞内的表达起到很重要的作用[6]。Hazen等[33]利用编码多重穿膜转运蛋白(Multidrug resistance associated protein 4,MRP4)的 cDNA 免疫动物,通过检测荧光素酶的活性对于DNA载体中巨细胞病毒(Cytomegalovirus,CMV)启动子和人工合成的高效启动子CAG对诱发免疫应答和产生抗体的激活能力进行了比较,结果表明带CAG启动子的质粒能够诱导长期稳定的MRP4蛋白的表达而且增强了抗MRP4的特异性免疫应答反应。Bates 等[20]通过荧光素酶报告基因比较了CMV 启动子和人类泛素C启动子对靶向抗原在宿主细胞内表达水平的效率,结果表明带两种启动子的表达载体都能诱导产生高特异性的单克隆抗体,在单次DNA 免疫情况下,泛素启动子C的抗原的半衰期和滴度都比CMV启动子诱导产生的抗体明显,而在多次DNA 免疫的情况下,二者均能诱导生成高滴度的抗体。载体中其它相关调控序列也对增强启动子的功能有影响,Wang等[34]报道密码子的优化,病毒启动子功能的增强和前导序列的选择等策略都在一定程度上提高抗原在宿主细胞内的表达效率及增强抗原的免疫原性。
2 使用不同佐剂对DNA免疫效果的影响
2.1 使用基因佐剂-CpG寡聚核苷酸对DNA免疫效
果的影响
CpG寡居核苷酸是从一种杆菌中提取的DNA片段,具有抗肿瘤、增强机体非特异性免疫应答等生物活性,人工合成的CpG寡居核苷酸具有与杆菌DNA类似的免疫刺激效应,能够促进B细胞前体的发育与成熟,从而增强DNA免疫在体内产生抗体的效率[35]。Gomis 等[36]对 CpG 寡聚核苷酸免疫保护作用进行了探讨,他们用人工合成CpG寡聚核苷酸免疫被大肠杆菌感染的鸡,病理学和微生物学检测结果表明,与对照组相比,接受含CpG寡聚核苷酸的鸡,不管是皮下免疫还是肌肉免疫都显著提高了存活率。因此,CpG寡聚核苷酸对细胞外细菌感染的动物起到有效的免疫保护作用。Qiu 等[37]报道在乙型肝炎病毒(Hepatitis B virus,HBV)DNA 疫苗试验中,包含CpG寡聚核苷酸序列的阳离子脂质体作为DNA 免疫的佐剂显著提高了DNA 疫苗的免疫原性且诱导免疫类型的转变,从而有效地将乙型肝炎病毒DNA 疫苗导入皮肤,在机体内诱导有效的预防性免疫应答。
2.2 使用传统佐剂对DNA 免疫效果的影响
粒细胞巨噬细胞集落刺激生长因子(Granulocyte macrophage colony stimulating growth factor,GM-CSF)作为DNA免疫的分子佐剂,有助于提高DNA免疫在体内诱发产生抗体的效率。例如,Hazen 等[33]报道联合使用两种分子佐剂,即编码胎儿酪氨酸激酶3配体(Fetal tyrosine kinase 3 ligand,FLT3L)和粒细胞巨噬细胞集落刺激生长因子(GM-CSF)的质粒DNA,显著提高了机体免疫反应,从而成功地诱导出识别靶向抗原12个跨膜蛋白(MRP4)的细胞外抗原表位的高特异性单克隆抗体。
分子伴侣是DNA 免疫的一类很重要的分子佐剂,在诱导产生针对G蛋白偶联受体(G proteincoupled receptor,GPCR)等具有复杂结构的特异性单克隆抗体中起到了较高的佐剂效应。Fujimoto等[38]报道了将大肠杆菌热休克蛋白作为DNA 免疫的分子佐剂,构建了编码内皮素受体A(Endothelin A receptor,ETAR)的重组质粒ETAR-GroEL,免疫动物后产生了针对天然靶向抗原的特异性抗原,而不含分子佐剂的编码靶向抗原的质粒免疫之后未产生特异性抗原。Takatsuka等[39]也将分子伴侣作为DNA 免疫的分子佐剂诱导产生了有效识别趋化因子(ChemoCentryx chemokine receptor,CCX-CKR)细胞表面的单克隆抗体。
细胞因子是机体细胞产生的一类具有广泛生物学活性的异质性肽类调节因子,使免疫活性细胞在体内被激活,从而参与机体特异性免疫应答的产生和调节过程。近年来有大量文献报道细胞因子能作为DNA 免疫的佐剂,通过诱导机体特异性免疫应答而增强DNA 免疫的效果,然而各种各样的细胞因子以不同的免疫调节方式在DNA免疫中发挥各自不同的免疫调节活性[40]。例如,Chow等[41]发现在乙型肝炎病毒DNA 疫苗中,白介素-2(IL- 2)和丙型干扰素(INF-γ)显著增强了辅助性T细胞1(Th1)的活性以及提高了抗-HBV的IgG2a抗体的产生,而且显著增强了由HBV疫苗诱导的细胞毒性T细胞(Cytotoxic T lymphocytes,CTL)反应,同时显著抑制了辅助性T细胞2(Th2)的活性以及减弱了IgG1抗体的产生。然而,白介素-4(IL- 4)表现出与之相反的调节活性。Cui 等[42]研究发现将编码IL- 12、IL- 15、IL- 18 或 IL- 21的质粒DNA 与编码生殖器单纯疱疹病毒(Herpes simplex virus,HSV)糖蛋白B的质粒DNA 共免疫生殖器单纯疱疹病毒感染小鼠时都显著提高了小鼠的存活率,结果表明了这些细胞因子通过同时诱导机体的体液和细胞免疫应答,能够在DNA免疫中起到有效的调节作用。
2.3 使用免疫调节佐剂对DNA免疫效果的影响
异源性DNA初免-蛋白质加强免疫(Heterologous DNA prime-protein boost)的免疫策略显著提高了DNA免疫的效率,主要程序是:首先用携带目的基因序列的重组DNA质粒免疫动物,随后再隔一段时间注射一定量的抗原蛋白作为加强免疫[43-44]。Wang 等[45]报道利用异源型DNA 初免-蛋白质加强的免疫策略诱发人免疫应答反应,从而获得抗人类免疫缺陷病毒(Human immunodeficiency virus,HIV)包膜抗原的高特异性抗体。已有不少研究证实异源性DNA初免-蛋白质加强免疫策略比多次注射同一类型的免疫原更有效,能够诱导产生稳定的保护性单克隆抗体[46-50]。Vaine 等[51]采用了 DNA 单独免疫、蛋白质单独免疫和异源型DNA 初免-蛋白质加强等不同免疫策略,验证了其中DNA 初免-蛋白质加强的免疫策略诱导产生的单抗可以有效阻止HIV-1 包膜糖蛋白与 CD4 受体的结合(表2)。

表2 免疫加强的选择
3 DNA免疫的递送方式
DNA 免疫的递送方式是体内诱导产生高效、稳定的单克隆抗体的关键一步,目前已有多种递送方式,其中最具代表性的有传统针管方式注射DNA 质粒所属的化学传递方式以及基因枪方法、电穿孔的方法、水动力尾静脉注射法等方法所属的物理传递方式(表3)。
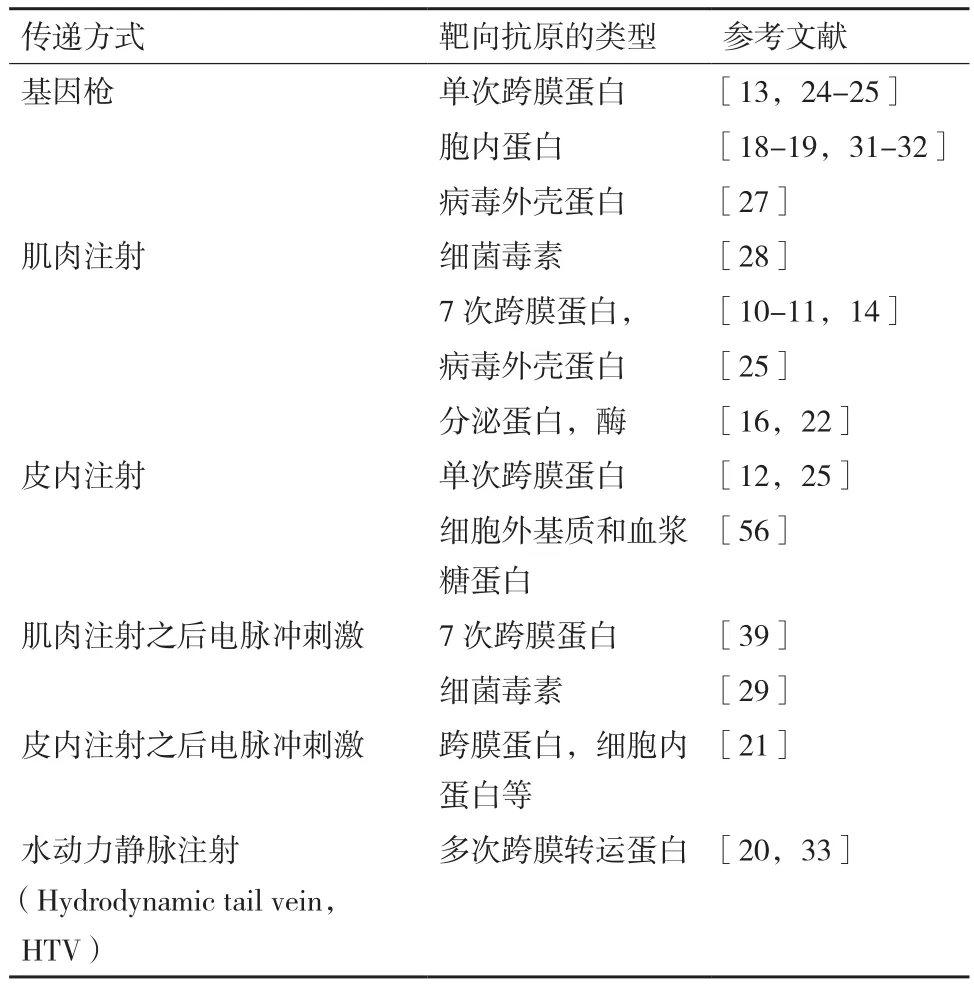
表3 DNA免疫的传递方式
3.1 传统的针管注射法
传统的针管注射法,一般根据抗原特异性和实际需要选择不同的注射部位,包括肌肉注射、皮下注射、静脉注射等。研究表明用传统的针管注射法免疫动物,虽然操作简便且经济,但注射少量的质粒DNA在动物体内很难得到高效价的抗体,所以此方法经常以附加佐剂或者DNA初免-蛋白质加强免疫等方法来提高DNA 免疫的效率。DNA 免疫传递方式在动物体内诱导产生靶点特异性单克隆抗体都有成功的报道,而且该技术在不断地改进和完善[9]。
3.2 基因枪技术
基因枪技术是指用化学性质较稳定的金或钨作为金颗粒,将带有目的基因序列的质粒DNA吸附在金颗粒上,然后通过冲击力将质粒DNA导入到靶向细胞内开始表达。与传统的针管注射相比较,基因枪技术是一种DNA免疫的高效传递方式,有效提高了外源基因在宿主细胞内的表达效率,然而基因枪技术具有操作难度较大且成本高等局限性,降低了其实际应用价值[31-32,52-54]。
3.3 电脉冲技术
电脉冲技术是首先用传统的针管注射法在动物肌肉或者皮下注射质粒DNA,随后在对应的注射处用电脉冲刺激,使细胞膜通透性瞬时增大,从而促进外源大分子导入到靶向细胞内得以高效表达。电脉冲技术具有效果显著、应用方便经济等优点,是最理想的DNA免疫的传递方式[21-22]。
3.4 水动力尾静脉注射法
另外一种特殊传递方式是通过水动力尾静脉注射(Hydrodynamic tail vein injection,HTV)。已有文献报道,利用这一传递DNA 免疫的方法成功诱导产生了针对细胞毒等跨膜蛋白的单克隆抗体[20,33]。由于需要特殊经验和设置,这种方法还没有得到广泛的应用。
对以上不同的DNA免疫的传递方式进行了比较,即与传统的裸DNA质粒注射比较,电脉冲和基因枪技术通过物理刺激的辅助作用有效的提高了外源DNA分子在宿主细胞内的表达水平[55]。例如,Alexandrenne等[56]将朊病毒蛋白(Prion protein,PrP)作为靶向抗原,通过不同DNA 免疫策略,对外源基因在宿主细胞内的表达效率进行了比较,结果表明经过DNA 免疫之后电脉冲刺激的传递方式比传统的裸DNA 质粒直接注射更有效,由此方法产生的单克隆抗体能有效识别朊病毒蛋白天然的抗原表位。Wang 等[57]将编码血细胞凝集素(Hemagglutinin,HA)的质粒DNA 通过肌肉注射免疫动物,同时用基因枪和电脉冲刺激的不同传递方式免疫动物,结果表明,与单独肌肉注射相比较,基因枪和电脉冲刺激更有效,诱导产生了高特异性的抗血细胞凝集素的单克隆抗体。
4 利用 DNA 免疫技术诱导生产高效单克隆抗体的优点
利用DNA免疫诱导产生高特异性的单克隆抗体的优势主要表现在以下几个方面:首先,DNA免疫同时刺激体液免疫和细胞免疫,加快抗原特异性B淋巴细胞的成熟,从而可以诱导产生有效识别靶点抗原表位的高特异性抗体。其次,DNA免疫无需在体外合成和纯化抗原,而是将目的基因直接导入到宿主细胞内得以表达,因此可以避免蛋白质天然构象和免疫原性因外界因素的干扰而受到影响。换言之,在宿主细胞内表达目的蛋白可以维持蛋白质空间构象更接近于其天然构象,而且还保证了原始多肽在真核细胞内的转录和修饰,如此就能提高针对靶向抗原的抗体的专一性和稳定性。再次,DNA免疫技术具有潜在的创新性和可选性,科研工作者在应用过程中按照自己的实际需要可以设计多种不同的免疫策略,也可以选择符合靶点抗原特异性的候选方案。最后,DNA免疫策略比传统的免疫方法更安全、操作简便、经济且可靠,为制备高质量单克隆抗体提供良好的技术平台[6-9]。
5 结语
作为一种新型简便的免疫技术,DNA 免疫的概念从刚被发现就受到了极大的重视,尤其是针对传染性疾病的DNA 疫苗的开发和应用[2-5]。在针对艾滋病病毒和流感病毒疫苗的开发和研究工作中,DNA免疫技术已成为了决定其成功与否的关键一步[58-60]。随着种类繁多的保护性或者治疗性单克隆抗体的应用和开发,DNA免疫技术在高特异性单克隆抗体研发中的地位也在不断上升,尤其是针对G蛋白偶联受体(GPCR)、跨膜蛋白的特异性单克隆抗体的开发中占绝对优势[33,51]。
总之,DNA免疫技术在高特异性单克隆抗体的开发中具有诱人的发展前景。首先,DNA免疫不需要在实验室合成和纯化抗原,而是在宿主细胞内表达插入基因序列,这样可以最大程度地维持蛋白质天然构象和免疫原性,这对于后续产生有效识别原始抗原表位的高亲和性抗体至关重要。最后,虽然单一DNA免疫在机体内很难生成高滴度的抗体,但随着DNA免疫技术的不断完善,已有了不少提高DNA免疫效率的免疫策略,显著提升了DNA免疫的免疫原性和实用性。由此可见,DNA免疫将在高质量的治疗性或诊断性单克隆抗体的研发中具有更广阔的应用前景[61-63]。
