丹霞苹果纯合基因型株系形态学分析
2019-03-15石江鹏张春芬侯丽媛李芙蓉董艳辉聂园军曹秋芬
石江鹏 ,张春芬 ,邓 舒 ,侯丽媛 ,肖 蓉 ,李芙蓉 ,董艳辉 ,聂园军 ,曹秋芬 ,
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院果树研究所,山西太原030031;3.山西省农业科学院生物技术研究中心,山西太原030031;4.山西省农业科学院农业资源与经济研究所,山西太原030031)
苹果为温带水果的一种,大多数温带水果的特点是育种周期长,童期长达5~7 d,高度杂合且异花授粉,通过传统育种手段改变性状遗传信息需要花费大量的时间,育种目标也具有随机性[1]。单倍体育种是现代育种的一项重要手段,通过雄核离体培养(花药培养、花粉培养)和雌核离体培养(未授粉子房或胚珠、辐照花粉培养等)等方法诱导产生具有单套染色体的单倍体植株,再利用秋水仙素诱导等方法进行染色体加倍形成双单倍体(Double Haploid,DH)纯合再生株系,可提高育种效率、扩大亲本选择范围、减少基因重组数量[2]。单倍体和双单倍体作为基础研究材料,在突变的研究中可用于筛选隐性突变体,可以提高遗传分析、图谱构建、基因定位的效率及降低基因组测序成本[3]。单倍体育种丰富了种质资源,加快了育种进程,在科学研究中具有重要意义[4]。
果树花药培养开始于20世纪70年代,目前已在梨[5]、枣[6]、柑橘[7]、草莓[8]等多种植物中获得了成功应用。1981年,国内获得了黄太平、元帅苹果花药培养再生植株[9-10]。TSUKUNI等[11]和 OKADA 等[12]成功获得苹果花药培养再生植株后,利用SSR分子标记技术检测再生植株来源,并对纯合再生株系进行形态学观察。HÖFER等[13]经过多年研究得出,苹果花药培养所得纯合再生植株与杂合供体相比结实率较低,且形态特征发生了改变。在此基础上,ZHANG等[14]研究发现,处于单核晚期或双核早期的小孢子可显著提高苹果花药培养胚状体诱导率,对花药进行4℃低温预处理20~30 d,胚状体诱导率呈上升趋势。罗慧珍等[15]通过转录组测序的方法分析低温诱导对苹果花药基因的调控,结果表明,蔗糖、淀粉生物合成、植物激素信号转导相关基因的表达变化是影响小孢子获得胚性潜能的关键。温鑫等[16]利用流式细胞仪对苹果花药离体培养获得再生植株进行倍性分析,再选用苹果SSR(HIDRAS)标记鉴定再生植株基因型,经检测,再生株系全部为纯合基因型,包括单倍体、二倍体、四倍体。
国内外有关苹果花药培养的研究不断发展,但关于苹果花药培养再生植株移栽技术的相关研究报道尚未得到大量有效的验证,因此探究苹果花药培养试管苗的移栽条件可以更好地选出优良的苹果新种质。
本研究以丹霞苹果花药培养的8个纯合再生株系为材料[16-18],每个纯合再生植株均由不同的花粉粒分化而来,因此,不同的株系根系生长状态、叶片形态特征具有差异性。通过对每个株系试管苗的根系生长特性、叶片形态特征进行观察分析,选出具有优良性状的株系,对苹果种质资源创新具有重要意义。
1 材料和方法
1.1 试验材料
采集山西省农业科学院果树研究所苹果基地的丹霞苹果品种的健壮花蕾,将其经低温预处理、消毒,在无菌操作台中将花药接种于胚状体诱导培养基(N6+2.0~3.0 mg/L 6-BA+0~0.15 mg/L NAA),于25℃在恒温培养箱暗培养。将长至1 cm左右的胚状体转入胚状体分化培养基(MS+1.0~5.0 mg/L6-BA+0.1~0.3 mg/LIBA+3%蔗糖+0.6%琼脂),20 d左右分化出幼芽。经继代培养获得再生植株[1]。本研究以丹霞苹果纯合基因型DH3-1,DH3-2,DH3-3,DH3-4,DH3-5,DH3-6,DH3-7,DH3-8株系为材料[16]。
1.2 试验方法
1.2.1 根系的诱导及测定 从继代组培苗中选取生长旺盛的再生植株接种于生根诱导培养基(1/2 MS+2.0 mg/LIBA+2%蔗糖+0.6%琼脂)。每个株系接种15株,置于温室光照培养(25℃3 000 lx;光照14h,黑暗10 h;相对湿度70%),40 d后选取5个植株用镊子挑选出培养基中的全部根系,观察并测定根的长度和根的数量,拍照记录。
1.2.2 叶片性状的观察及测定 从生根试管苗中选取叶片充分展开和成熟的植株(茎中部叶片),每个株系取5个植株,每株选取3个叶片,每个株系共测量15个叶片。将叶片用清水洗干净后铺平放入含有滤纸的自封袋中,注明株系号。测量每个叶片的叶长度、叶宽度(最大叶宽度)、叶柄长度。计算叶形指数(叶长度/叶宽度)。观察叶色、叶缘变异,并拍照。观察记载方法参照《果树种质资源描述符:记载项目及评价标准》[19]进行。
1.2.3 再生植株移栽技术研究 选择生根培养基上生长茁壮的苗,即叶色浓绿,根系发达,以在组培瓶中株高较高的为佳。将组培苗进行炼苗,炼苗方法设2个处理,分别为开盖后直接移栽和温室中闭盖放置5~7 d,开盖加入蒸馏水放置2~3 d后移栽,每个处理5个植株。移栽时先把基质(草炭∶蛭石∶珍珠盐为1∶1∶1)装至盆的4/5,将取出的试管苗在清水中洗净根部残留的琼脂后移栽进基质中,立即用清水浇透,并罩上透明杯,注明移栽日期和株系号。置于光照培养箱,15 d后去掉透明杯,每周浇一次营养液(1/2MS+2 mg/LIBA)。
1.3 数据统计分析
采用Microsoft Excel 2010软件进行原始数据整理和统计分析,使用SPSS 20.0软件对不同处理进行多重比较、单因素方差分析,显著性水平设定为α=0.05,图表中所有数据均为3个重复的平均数±标准误。
2 结果与分析
2.1 不同株系根系形态特征分析
通过对丹霞苹果纯合基因型株系的根系形态进行分析(表 1、图 1),结果表明,DH3-8,DH3-4 株系的根数、根长显著高于其他6个株系(P<0.05),根长分别为26.53,27.70 cm,根数分别为39.00,51.67 个(图 1-A,B);DH3-1,DH3-3,DH3-6 株系的根长、根数无显著差异(P>0.05),与 DH3-4,DH3-8相比显著减小,根长为16.67~20.50 cm,根数为13.33~15.33 个(图 1-C~E);DH3-2,DH3-5,DH3-7株系的根长、根数与其他5个株系相比显著较小(P<0.05)(图 1-F~H),其中,DH3-7 株系根长、根数最小,分别为7.67 cm,4.33个(图1-H)。可见,丹霞苹果纯合基因型8个株系的根系形态特征具有差异性,DH3-4,DH3-8株系根的生长状态较好。

表1 丹霞苹果纯合基因型株系根系形态特征

2.2 不同株系叶片形态特征分析
从表2可以看出,丹霞苹果纯合基因型株系的叶片形态特征如叶片宽度、叶片长度、叶柄长度具有明显差异,DH3-3,DH3-4株系的叶片宽度较宽,分别为 1.90,1.73 cm(图 2-A,B),显著宽于其他株系;DH3-8,DH3-1,DH3-6,DH3-5 株系间叶片宽度无差异(图2-C~F),但显著宽于DH3-2株系,DH3-2株系叶片宽度仅为1.00cm(图2-H)。DH3-7株系的叶片长度显著较短,为1.83 cm(图2-G),但与其他7个株系的叶片长度未达到差异显著水平。不同株系具有不同的叶柄长度,DH3-3,DH3-8株系的叶柄长度较长,分别为1.30,1.37 cm(图2-A,C),DH3-2株系的叶柄长显著最短,为0.47cm(图2-H)。叶形指数在不同株系间表现差异显著,DH3-6株系的叶形指数显著较大,表明叶片为窄长形(图2-E),DH3-3株系的叶形指数显著最小,表明叶片呈阔圆形(图2-A),DH3-1,DH3-5株系的叶形指数差异不显著,二者的叶片形状相似(图2-D,F)。
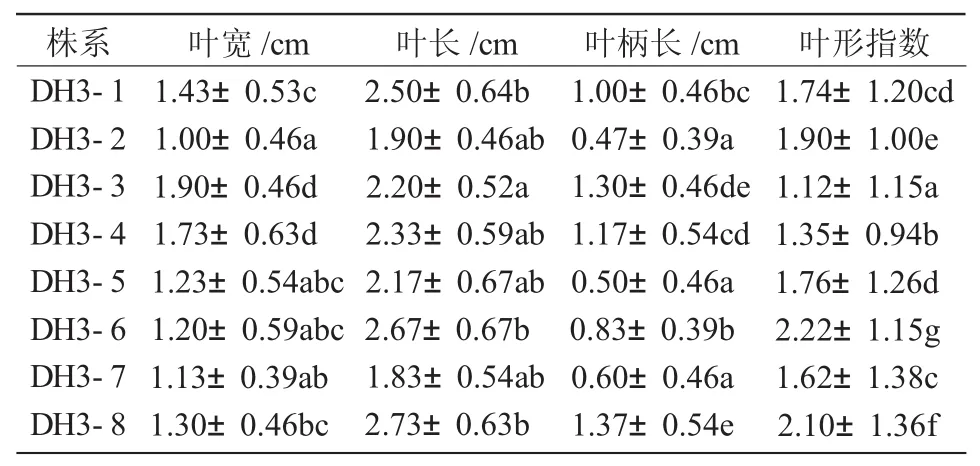
表2 丹霞苹果纯合基因型株系叶片形态特征比较

叶缘、叶色、叶片形状等的变异,不同的株系表现不一致。DH3-3株系叶基为楔形(图2-A),DH3-4株系为宽楔形(图2-B),而DH3-6株系的叶基为偏斜(图 2-E);从叶尖来看,DH3-4,DH3-7株系的叶尖为锐尖(图 2-B,G),DH3-3,DH3-8,DH3-6 株系的为渐尖 (图 2-A,C,E),DH3-1,DH3-5株系为突尖(图2-D,F),DH3-2株系叶尖呈撕裂状(图2-H);分析每个株系的叶片形状,DH3-3,DH3-4株系叶片形状为卵形(图2-A,B),DH3-8,DH3-1,DH3-6,DH3-5,DH3-7 为 椭 圆 形(图2-C~G),DH3-2为畸形叶片(图2-H);不同株系叶缘锯齿的变异也表现出多样性,DH3-3株系为圆齿状(图2-A),DH3-8,DH3-6株系为锯齿状(图2-C,E),DH3-4,DH3-2 株系为重锯齿状(图 2-B,H);就叶色而言,DH3-3,DH3-4,DH3-1 株系叶色较深(图 2-A,B,D)。
综上所述,DH3-3,DH3-4,DH3-8 株系的叶片宽度、长度、叶柄长度优于其他株系,所以,DH3-3,DH3-4,DH3-8株系的综合性状较好。丹霞苹果纯合基因型株系的叶基、叶尖、叶片形状、叶缘、叶色具有差异性,就叶片的形态而言,每个株系均具有唯一性。
2.3 再生植株移栽分析
丹霞苹果纯合基因型株系移栽过程如图3所示。温室中闭盖放置5~7 d,开盖加入蒸馏水放置2~3 d,植株在炼苗过程中死亡(图3-A),没有株系成活。开盖后直接移栽植株生长状态较好(图3-B,C),有3个株系成活,成活率达到37.50%。

3 讨论
苹果花药培养是指将发育到一定阶段的花药在消毒处理后接种到人工培养基上,花药培养获得单倍体植株有2种途径:一是花药改变原来的发育过程直接形成胚状体,经培养后形成再生植株(胚胎发生系统);二是诱导花药增殖形成愈伤组织,再诱导分化成胚状体,继而形成单倍体植株(器官发生途径)。由于受花粉壁等体细胞的干扰,所以通过花药培养技术获得的再生植株可能是杂合植株,因此,花药培养再生植株需要经同工酶、S等位基因、分子标记等方法进行纯合性鉴定。HÖFER等[20]选用磷酸葡萄糖异构酶(PGI)、苹果酸脱氢酶(MDH)对苹果花药培养再生植株进行同工酶分析,经鉴定获得的植株均为单倍体来源。SSR分子标记法目前应用较为广泛,HÖFER等[13]通过SSR标记证明,Pirina,Rene苹果花药培养再生新种质的纯合性。温鑫等[16]利用来自HISDAS的130个SSR标记对嘎啦、丹霞、富士3个苹果品种的花药培养再生植株进行PCR,筛选出可区分再生植株为纯合基因型的SSR标记。本研究丹霞的8个花药培养再生植株经SSR鉴定均为纯合基因型[16-17]。
VANWYNSBERGHE等[21]研究表明,苹果花药来源纯合基因型株系生长较慢,部分品系发生异常分枝,花粉发芽率差,果实显著变小。HÖFER等[20]研究发现,与供体植株相比,苹果花药来源的植株移栽到田间后树和花的形态学发生改变。本研究中,丹霞苹果纯合基因型8个株系的根系形态特征、叶片形态特征表现出明显差异。DH3-4,DH3-8株系的根数最多、根长最长,DH3-1,DH3-3,DH3-6株系的根长、根数次之。DH3-3,DH3-4,DH3-8株系的叶片宽度、长度、叶柄长度优于其他株系。不同株系的叶缘、叶色、叶片形状等也存在差异,其中,如DH3-3株系叶基为楔形、叶片形状为卵形、叶色较深、叶缘锯齿为圆齿状;DH3-4株系叶基宽楔形、叶尖为锐尖,叶片形状为卵形、叶色较深、叶缘锯齿为重锯齿状;DH3-8株系叶基为楔形、叶尖为渐尖,叶片形状为椭圆形、叶缘为锯齿状。苹果花药来源株系表型多样性可能是由于潜在隐性基因表达,每个株系含有不同的基因型,进而表现出不同的性状[20]。
本研究进行炼苗时采用2种方法,分别为开盖后直接移栽和温室中闭盖放置5~7 d,开盖加入蒸馏水后放置2~3 d移栽。其中,开盖后直接移栽成活株系为3株,成活率达到37.50%;温室中闭盖放置5~7 d,开盖加入蒸馏水后放置2~3 d移栽,成活率为0。开盖后直接移栽比开盖放置2~3 d后移栽成活率高,可能是由于开盖放置2~3 d的过程中,瓶盖去掉后叶片水分严重散失而导致植株很快枯萎,若只将盖拧松而不全部去掉,培养基霉菌繁殖致使植株死亡。开盖后直接移栽到含有草炭、蛭石、珍珠盐的基质中,然后在刚移栽的植株外罩上透明杯,可以避免霉菌繁殖,减少植株水分散失。谢璇等[22]以红富士苹果组培苗为试材,采用水培炼苗的方法,即将组培苗闭瓶培养在改良的霍格兰德营养液中(霍格兰德配方用量减少1/2[23]),室内自然光下培养14 d后,再用改良的霍格兰德全营养液开瓶炼苗21 d后移栽,这种方法提高了移栽成活率。也有研究表明,水培炼苗可避免培养基干裂、霉菌过多繁殖,锻炼组培苗根系的吸水能力,使移栽成活率提高[24-25]。
4 结论
丹霞苹果花药培养获得的8个纯合基因型株系中,DH3-3,DH3-4,DH3-8株系优于同一品种其他株系(根系较长、数量较多,叶片宽度、长度、叶柄长度较长)。丹霞苹果纯合基因型株系的叶缘、叶色、叶尖、叶基、叶片形状表现出明显差异。丹霞苹果纯合基因型株系不经过炼苗而直接移栽植株生长状态更好。
