髋关节镜手术治疗髋关节原发性滑膜软骨瘤病临床疗效
2019-03-14钟名金欧阳侃丘志河梁达强柳海峰彭亮权李阔阔朱伟民陆伟王大平
钟名金 欧阳侃 丘志河,3 梁达强 柳海峰 彭亮权 李阔阔,3 朱伟民 ,2 陆伟 ,2 王大平 ,2
1 深圳市第二人民医院深圳大学第一附属医院(深圳 518035)
2 深圳市组织工程重点实验室 3 深圳大学医学部
原发性滑膜软骨瘤病(primary synovial chondromatosis,PSC)是一种以滑膜关节、滑囊或腱鞘的滑膜组织发生软骨化生为特点的良性瘤样病变[1,2]。PSC最多见于膝关节,髋关节相对少见[3]。髋关节原发性滑膜软骨瘤病(primary synovial chondromatosis of the hip,HPSC)起病较为隐蔽,病程较长,临床症状以疼痛、捻发感、活动受限为主,但症状无特异性,在早期阶段很难确诊,往往在疾病进展多年后影像学检查发现骨化游离体方被诊断[3-5]。研究表明,骨化的游离体对关节软骨造成破坏性损伤,导致骨关节炎(osteoarthritis,OA)[6]。因此,临床上一旦确诊为HPSC,应该早期积极进行手术治疗[7]。传统髋关节脱位切开手术治疗HPSC取得了良好的临床效果[8-10]。但是切开手术创伤大、恢复时间长,术后容易出现感染、异位骨化、股骨头坏死等并发症[11,12]。近年来,随着关节镜技术的发展,关节镜下可以完成滑膜切除、游离体取出和关节清理等操作,相对开放手术而言,关节镜手术具有创伤小、恢复快、并发症少等显著优势[4,11,13]。本研究回顾性分析2012年7月至2017年7月在我院采用髋关节镜手术治疗HPSC的18例患者的临床表现、影像学资料及术后病理特点,并同时对术后疗效进行追踪随访,以期进一步为临床诊疗提供参考。
1 对象与方法
1.1 研究方法
回顾分析2012年7月至2017年7月在我院行髋关节镜手术治疗HPSC患者的临床病例资料。纳入标准:(1)临床确诊为HPSC;(2)术前影像学资料完整;(3)同意并接受髋关节镜手术;(4)术后定期随访,随访资料完整。排除标准:(1)临床或影像学资料不全;(2)既往同侧髋关节手术病史;(3)不接受髋关节镜手术;(4)严重髋关节OA。
1.2 影像学和髋关节功能评估
所有患者术前、术后及终末随访时均行髋关节X线片、三维CT(3-dimensional computed tomography,3D-CT)和磁共振成像(magnetic resonance imaging,MRI)。依据Tönnis分级标准在X线片上评估髋关节OA级别[14]。3D-CT有助于准确判断骨性游离体的位置和分布。MRI对未骨化的软骨性游离体、关节水肿、滑膜增生和软骨损伤具有诊断意义。术前和末次随访时记录髋关节的活动度。采用疼痛视觉模拟评分(visual analog scale,VAS)、改良髋关节Harris评分(modified Harris hip score,mHHs)、髋关节功能评分-日常生活量表(hip outcome score—activities of daily living,HOS-ADL)和髋关节功能评分-体育运动量表(hip outcome score—sport-specific subscale,HOSSSS)进行髋关节功能评估[14]。
1.3 手术方法
采用全身麻醉下进行髋关节镜手术。患者平卧于牵引床上,双下肢置于牵引架上,保护会阴部,标记大转子(greater trochanter,GT)和髂前下棘(anterior inferior iliac spine,AIIS)。牵引患肢至关节间隙达8~10 mm(出现新月征),C臂X线机透视引导下,在GT顶点上方1 cm处穿刺进入中央间室作为前外侧入路(anterolateral portal,ALP),70°镜监视下在ALP和AIIS延长线交点穿刺建立前方入路(anterior portal,AP),在大转子后缘1 cm处穿刺建立后外侧入路(posterolateral portal,PLP)。为了避免过多切开关节囊、充分切除增生的滑膜和尽可能多地取出游离体,通常建立近端前外侧入路(proximate anterolateral portal,PALP)和远端前外侧入路(distal anterolateral portal,DALP)(图1A)。术中使用滑槽辅助关节镜和操作器械在各个入路间相互交换,对于小的游离体可以直接用刨刀进行刨削清理,对于较大的单个游离体或融合的游离体团块可以先用髓核钳逐步进行咬除。髋关节后方和前内侧为操作盲区(图1B),可以使用套管进行灌洗,将游离体冲出后再取出。按Milgram法分别记录疾病分期[1]。按Outerbridge分级法记录股骨头软骨和髋臼软骨的损伤程度[14],对于Ⅰ~Ⅱ度软骨损伤仅做清理,Ⅲ~Ⅳ度软骨损伤(图1C、D)则进行微骨折处理。对于磨损、退变的髋臼盂唇予以清理。中央间室处理后放松牵引,轻度屈髋屈膝,使用30°镜,取出外周间室的游离体和清理炎性增生滑膜。对股骨头颈部异常凸起形成Cam撞击者使用磨钻磨除。对存在OA增生的骨赘均予以磨除。按照中央间室-外周间室-中央间室-外周间室的顺序依次处理。术中单次牵引时间不超过90分钟。最后彻底止血,大量生理盐水冲洗关节腔,无菌敷料包扎切口。对取出的游离体(图G)及滑膜组织进行病理检查(图1K)。
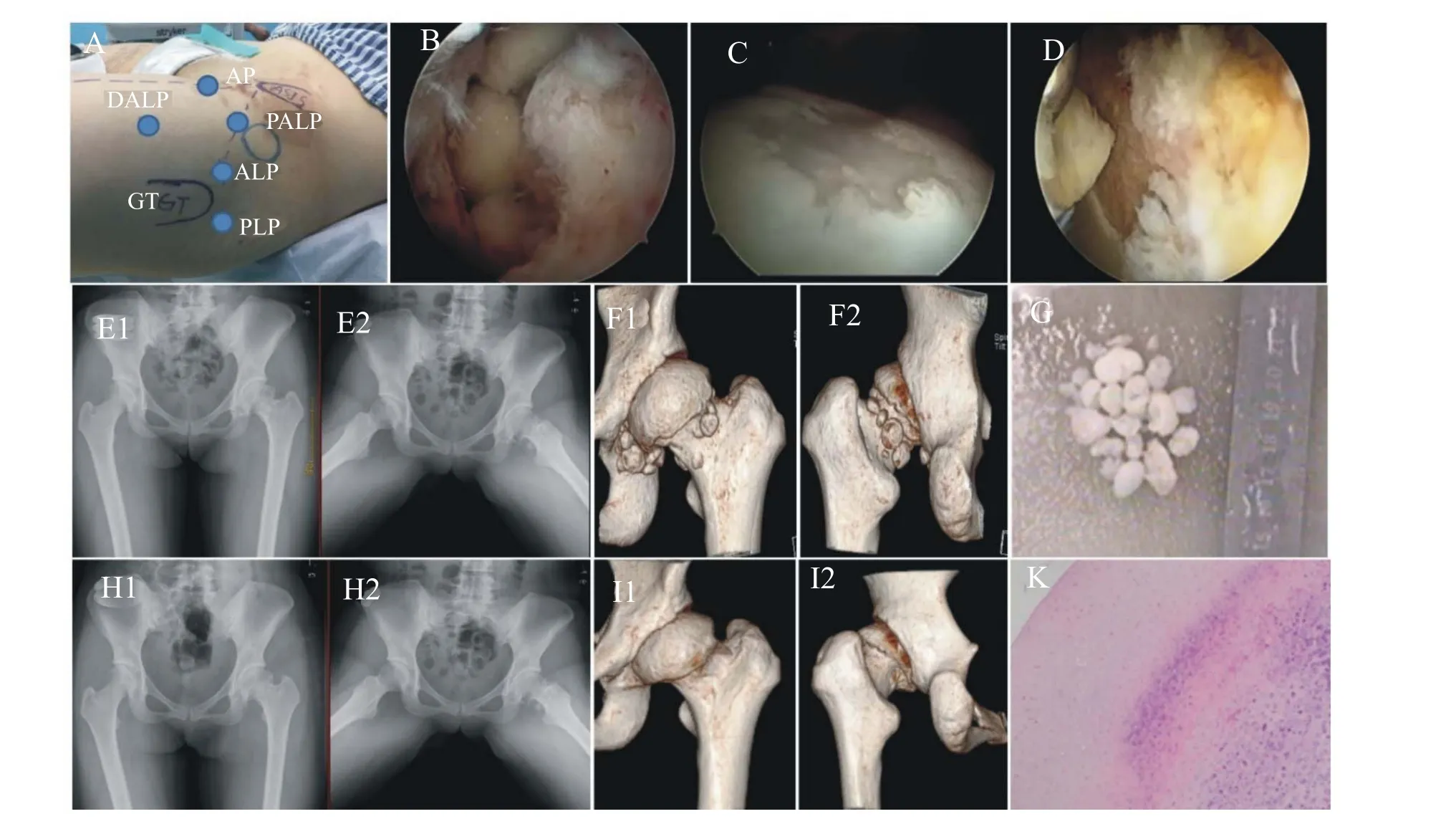
图1 髋关节镜手术治疗HPSC
1.4 术后康复及随访
麻醉过后,鼓励患者进行股四头肌等长收缩和踝泵练习。对于单纯行游离体取出、滑膜切除或合并Ⅰ~Ⅱ度软骨损伤的患者,术后第2天即可部分负重,术后2周后完全负重。对于合并Ⅲ~Ⅳ度软骨损伤并行微骨折的患者,开始负重时间延长至术后4周,术后6周完全负重。术后第3~5天即可出院。患者术后2周、6周、3个月、6个月、12个月返回医院随访,此后每年随访1次。
1.5 统计学方法
采用SPASS17.0统计软件进行分析。数据以均数±标准差表示,术前、术后髋关节活动角度及功能评估采用配对t检验,P<0.05表示具有显著统计学差异。
2 结果
2.1 一般资料
2012年7 月至2017年7月共18例HPSC患者在我院进行了髋关节镜手术治疗。年龄28~51岁,平均38.2±8.6岁;男性11例,女性7例;右髋10例,髋8例;病程18~60个月,平均28.5±8.7个月。所有患者术前均有不同程度的疼痛和活动范围受限,4例患者有捻发感,2例患者有跛行步态,1例患者自行触及肿块感。15例患者“4”字征阳性,4例患者前方撞击试验阳性。术后所有患者获得随访,随访时间12~48个月,平均32.2±10.8个月。
2.2 影像学评估
X线片和3D-CT均为阴性结果,MRI可见大量软骨性游离体、滑膜结节样增生而确诊有3例(图2 A1-A5);X线片阴性而3D-CT显示骨性游离体确诊的2例(图2 B1-B5);X线片能够清晰地显示多发游离体(图2 C1-C5)和融合成块状游离体(图D1-D5)共13例。髋关节OA按Tönnis分级:0级6例,Ⅰ级5例,Ⅱ级7例,Ⅲ级0例(表1)。术后33.3%(5/15)的患者在术后即可复查X线或3D-CT仍有骨性游离体残留,残留的部位常见为髋关节前内侧、后方及皮下。终末随访时,术前X线和3D-CT阴性的3例患者复查MRI未见复发。术后5例残留游离体的患者中的4例基本无明显变化,2例显示游离体成团块变大;2例患者在3D-CT上可见新生骨性游离体,术后复发率11.1%(2/18)。髋关节OA Tönnis分级:0级4例;Ⅰ级4例;Ⅱ级10例;Ⅲ级0例;术后16.7%(3/18)的患者髋关节OA进行性加重(表1)。
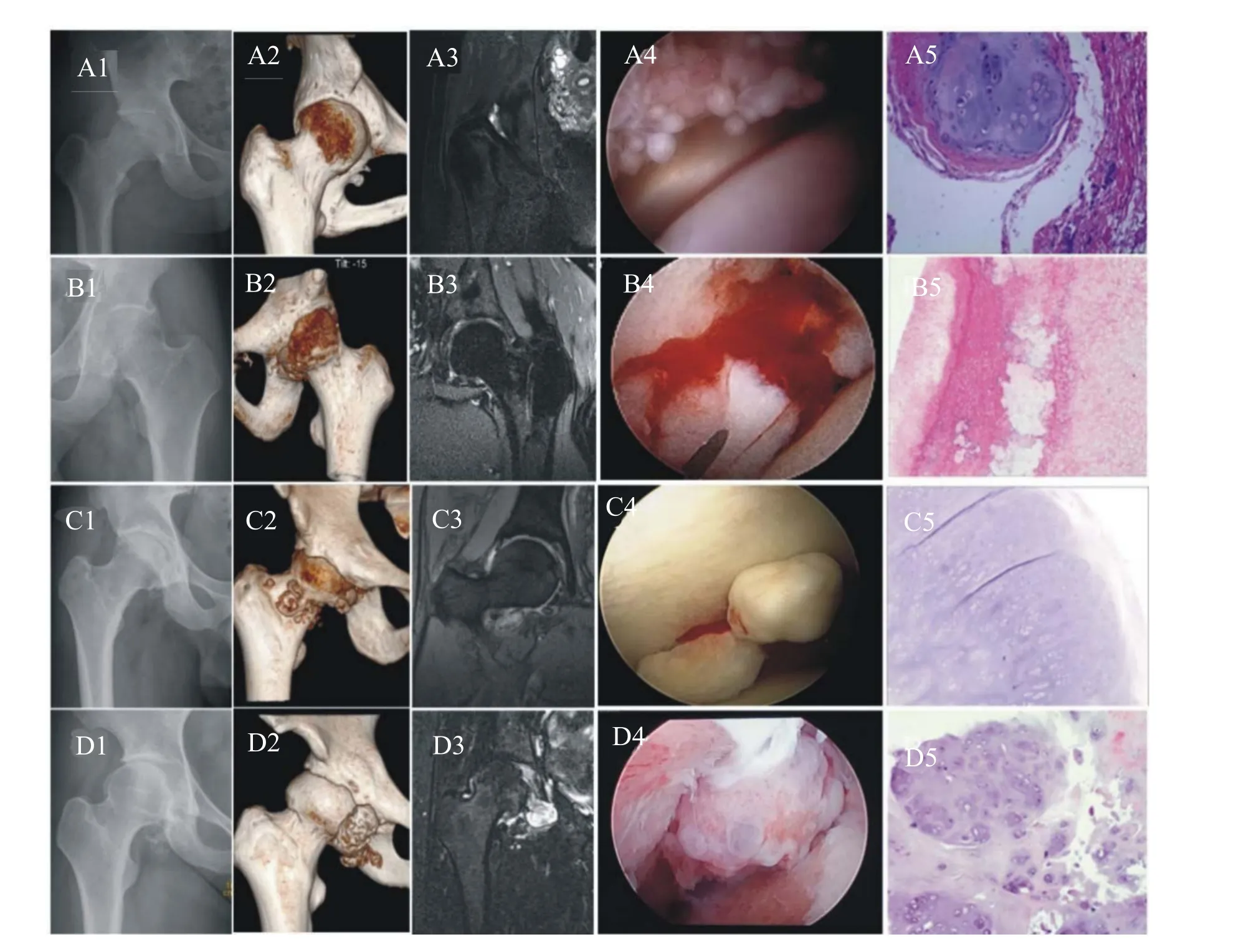
图2 不同类型HPSC的影像学、镜下和病理特点

表1 影像学评估
2.2 关节镜下评估
所有患者在髋关节镜手术和术后病理结果中得到最终确诊。Milgram Ⅰ期3例,Ⅱ期9例,Ⅲ期6例。关节镜下66.6%(12/18)的患者合并股骨头或(和)髋臼软骨磨损、退变,其中11.1%(2/18)患者存在OuterbridgeⅢ级以上的软骨损伤。6例患者股骨头颈部异常凸起形成Cam型撞击进行打磨成形术。4例患者合并髋臼盂唇磨损、退变均使用刨刀进行清理(表2)。手术时间92~172 min,平均105.5±36.7 min,单次牵引时间均未超过90 min。
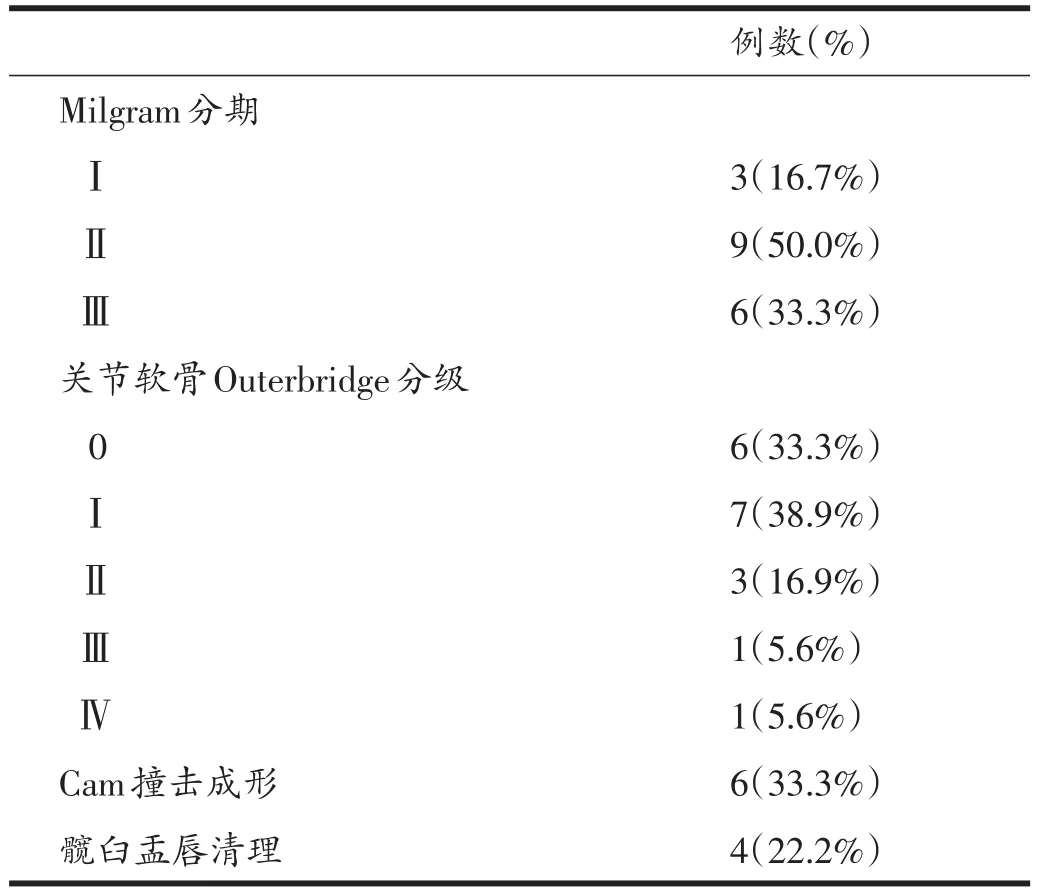
表2 关节镜下评估
2.3 髋关节功能评估
终末随访时髋关节活动度、疼痛视觉模拟评分(VAS)评分、改良髋关节Harris评分(mHHs)、髋关节功能评分-日常生活量表(HOS-ADL)评分均较术前明显改善(P<0.05);髋关节功能评分-体育运动量表(HOSSSS)评分术前、术后无明显差异(P>0.05)(表3)。随访期间无感染、神经牵拉伤、血管损伤和下肢深静脉血栓形成等并发症发生,所有患者均未进行二次关节镜或关节置换等翻修手术。
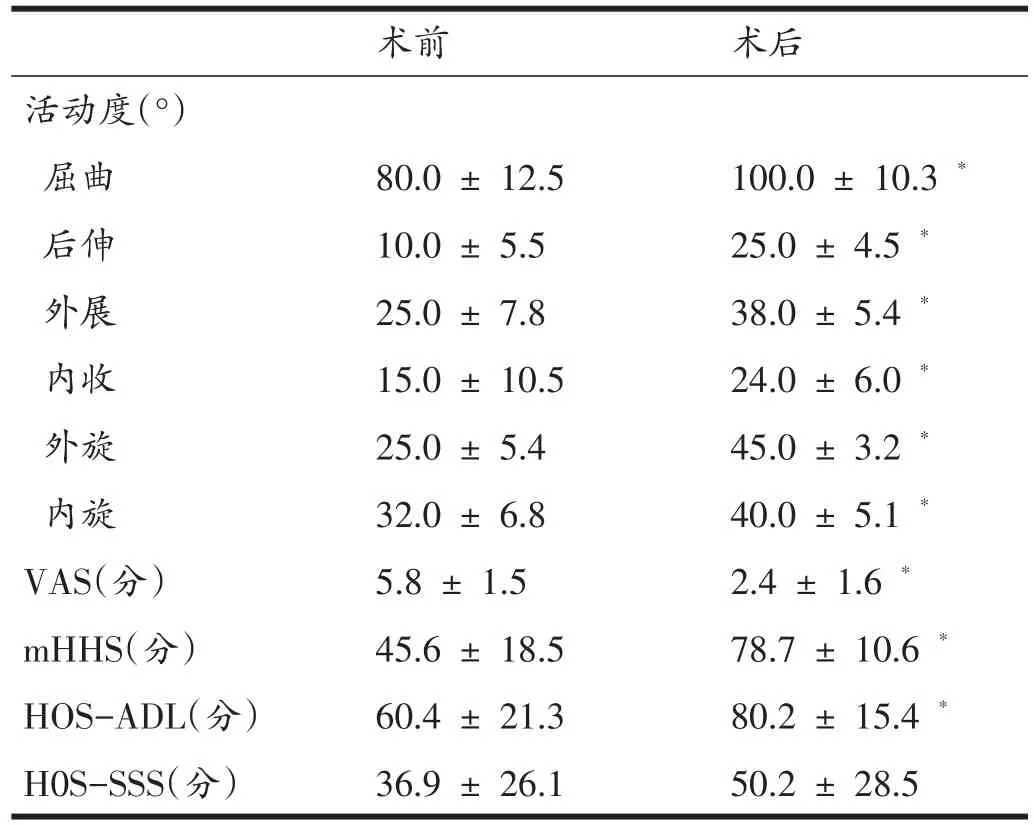
表3 髋关节功能评估
3 讨论
原发性滑膜软骨瘤病(PSC)的病理机制为滑膜关节、滑囊和腱鞘滑膜组织内的多功能间充质干细胞向软骨化生,形成软骨或骨-软骨游离体,少数可能恶变形成滑膜肉瘤或软骨肉瘤[15,16]。根据病变的部位不同,PSC可分为关节内型和关节外型,最常累及膝关节,其次为髋关节、肩关节、踝关节和腕关节[3,4]。Milgram根据病程及病理表现将PSC分为三期:Ⅰ期或早期,滑膜病变活动期,滑膜内形成软骨小体,但无游离体产生;Ⅱ期或过渡期,滑膜病变与游离体并存;Ⅲ期或晚期,关节内大量游离体而无滑膜炎病变[1]。本组病例中,Milgram Ⅰ期3例,Ⅱ期9例,Ⅲ期6例。
髋关节被丰富的肌肉包裹,位置比较深,髋关节原发性滑膜软骨瘤病(HPSC)的病程往往较长,早期患者多无明显症状,随着疾病的进展,逐渐出现疼痛、肿胀、跛行和活动受限等症状,少数患者在体表触及肿块。研究表明,HPSC从出现症状到就诊,年龄平均在40岁,病程超过30个月[4],本组病例结果与之相似。单纯的滑膜病变和软骨性的游离体对关节的破坏较小,而骨性游离体会造成股骨头和髋臼关节软骨破坏性损伤,导致髋关节OA的发生[6]。X线或3D-CT可以显示骨性游离体,同时也可以发现髋关节周围骨赘增生、软骨下骨囊变和关节间隙变窄等OA表现。Lee等[3]对24例HPSC患者的髋关节X线平片进行分析发现,58%的患者在X线上有OA的迹象。本组病例中66.7%的患者在X线有不同程度的OA的表现。研究表明,髋关节关节间隙<2 mm或OA TönnisⅡ级以上是影响手术预后不佳的重要因素[17,18],因此临床上强调早期诊断早期治疗。
临床上诊断HPSC主要依靠影像学检查。普通髋关节X线平片是最基本、最常用的检查方法,骨性游离体多数可以清晰显示。X线片还可以直观地评估髋关节OA的严重程度。3D-CT可以清晰立体地观察游离体的位置和分布,对手术方案有重要的指导意义。当病变处于MilgramⅠ期或Ⅱ期,X线和CT也难以诊断。Lim等[9]认为早期诊断HPSC应该首选MRI。骨化的游离体在MRI T1和T2加权像上都是低信号。未骨化的游离体和增生的滑膜结节在T1加权像上是低信号,而在T2加权像上是高信号。MRI对滑膜增生、关节水肿和关节软骨损伤也具有一定的诊断意义[19]。文献报道的一组病例中,83%(20/24)的患者在X线片上可显示骨性游离体,92%(22/24)的患者在MRI可见软骨或骨性游离体,所有患者在MRI上均可见滑膜增生变厚[3]。本组病例中,3例X线和3D-CT阴性的患者在MRI予以确诊。Zini等[4]报道的11例患者中,18%(2/11)的患者在X线、CT和MRI上均未明确诊断,最终在关节镜下确诊。
治疗HPSC的关键在于切除病变的滑膜和取出关节内的游离体,阻止疾病进展和复发。传统的切开髋关节脱位手术能够直接暴露关节,直视下操作,手术清除范围彻底[11]。Lim等[9]采用切开手术治疗了21例HPSC患者,术后随访4.4年,HHS评分由术前的58分提高到91分,81%(17/21)患者对手术效果满意。Schoeniher等[8]切开髋关节脱位进行滑膜全切治疗8例HPSC,术后随访6年,无复发。韩纲等[20]采用髋关节S-P切口,术中髋关节未将股骨头脱位,12例患者平均随访2年,术后效果良好,但2例患者出现复发。近年来,越来越多的学者开始尝试使用关节镜手术治疗HPSC,对影像学不能明确诊断的疾病,关节镜仍然是“金标准”。Zini等[4]报道了髋关节镜手术治疗11例HPSC患者的临床疗效,术后平均随访22个月,72%(8/11)的患者对关节镜手术效果满意,82%(9/11)的患者髋关节功能达到优良(HHS>80分)。Lee等[3]进行了较长时间的随访,术后随访时间平均41个月,术后无一例并发症发生,VAS评分由术前的8.1±1.3降低为3.1±1.4;HHS评分由术前的39.0±6.9提高到82.0±10.2分,75%(18/24)患者临床效果满意。Ferro等[21]认为髋关节镜手术不仅可以改善术后髋关节功能,还能降低OA的程度。他们报道了一组髋关节镜治疗23例HPSC患者的病例,术后平均随访2.5年,mHHS评分由术前的62分提高到术后的84.8分,西安大略骨关节炎指数(Western Ontario and McMaster Universities Osteoarthritis Index,WOMAC)由术前的27.1分减低到术后的7.2分。吴华等[22]、王志刚等[23]也认为关节镜治疗HPSC术后临床疗效确切。王志刚等[23]根据瘤体在镜下的不同形态分为游离体型、滑膜游离型和髋臼窝嵌压型。本组病例中,我们发现瘤体有四种形态:结节样滑膜增生型、软骨游离体型、骨性游离体型和骨性团块型。
术后复发是HPSC最需关注的并发症。研究表明,病变滑膜未完全切除或游离体碎片残留是术后复发的主要因素[3]。Milgram等[1]建议切除活动期增生的滑膜(Ⅰ和Ⅱ期)。Schoeniger等[8]报道了切开滑膜清理治疗8例髋关节滑膜软骨瘤病病例,术后平均随访6.5年,均未发现复发。Lim等[9]采用切开手术治疗了21例HPSC患者,平均随访4.4年,8例患者进行切开髋脱位来彻底清理病变滑膜,术后无1例复发;另外13例仅切开清理未行髋关节关节脱位术,术后15%的患者出现复发。他们认为彻底切除病变滑膜可以有效地防止术后复发。Lee等[3]认为关节镜很难到达髋关节后外侧和后内侧区域,因此他们认为建立内侧入路(medial portal,MP)有助于清理该区域的病变滑膜,降低术后复发率,但MP入路并未处于安全区域,容易损伤股神经、股动脉和股静脉。de Sa等[24]通过系统综述分析,关节镜治疗HPSC术后复发率7.1%,平均在术后3.5年(0~7年)复发。年龄与术后复发相关,年龄越大术后复发的可能性越大。但由于目前缺乏大样本量的长期随访研究,HPSC术后复发与Milgram分期、年龄、性别、游离体残留等是否相关有待进一步研究。
HPSC常常合并关节软骨损伤、盂唇退变、Cam撞击等病理改变,这是术中另一个值得关注的问题。本组病例中合并软骨损伤、盂唇退变和Cam撞击的比率分别为66.7%(12/18)、22.2%(4/18)和33.3%(6/18),术后至终末随访16.7%(3/18)的患者髋关节OA程度持续性进展。Ferro等[21]在手术中发现85%的患者合并软骨损伤,100%的患者合并盂唇撕裂和Cam撞击。他们认为Cam撞击并非继发于HPSC,而是一种独立疾病。因为有一部分HPSC患者是在关节镜手术中证实PSC和Cam撞击并存的,而在实施关节镜手术前并未诊断。我们认为这一类Cam撞击形成的可能原因有两方面:一是滑膜化生形成大量软骨瘤体,导致关节液营养成分流失,关节表面的关节软骨发生退变,继发形成骨赘;二是瘤体本身粘附在股骨头颈部后骨化形成。研究表明,无论是切开髋关节脱位手术还是髋关节镜手术治疗HPSC合并Cam撞击时,术中清理游离体的同时行Cam成形,术后临床效果均十分满意[21,25]。
本研究的不足之处在于:一是研究样本量较小;二是随访时间较短,平均32.2±10.8个月,术后长期临床疗效有待进一步随访研究。
综上所述,髋关节镜手术治疗HPSC创伤小、并发症少、恢复快,短期术后疗效满意,能显著改善髋关节活动度和功能。但是髋关节后方及前内侧区域是髋关节镜的操作盲区,增加了游离体残留和复发率的风险。
