肾功能受损对细菌性血流感染患者降钙素原的影响
2019-03-14张潇菡徐炳欣杨亚娟
张潇菡, 刘 静, 徐炳欣, 林 炜, 杨亚娟, 赵 亮
(许昌市中心医院 1. 药学部; 2. 感染管理办公室; 3. 外科重症监护室, 河南 许昌 461000)
降钙素原(procalcitonin,PCT)是近年来临床细菌感染性疾病常用的标志物之一。因其与细菌感染特别是脓毒症的相关性良好,被推荐用于细菌感染性疾病的诊断、分层、治疗监测和预后评估[1]。由美国重症医学会、欧洲危重症医学会撰写的《拯救脓毒症运动:脓毒症与感染性休克治疗国际指南(2016)》中推荐检测PCT水平,以缩短脓毒症患者抗菌药物治疗疗程。然而,随着PCT在临床的广泛应用,人们发现许多患者存在PCT假阳性的情况。现有研究[2]表明,细胞的任何损伤,不论是直接组织损伤还是缺血再灌注损伤,都会出现由损伤相关分子模式诱导的PCT升高。某些情况下,非细菌因素也能诱导PCT增高[1],如外科手术和创伤、器官移植、肾功能不全、重症胰腺炎、肿瘤晚期及罕见的副肿瘤病例等。
笔者在临床实际工作中也发现患者PCT检测值与同期肾功能情况有着一定的关联。近年来国外研究[3]显示,随着肾功能的恶化,患者血清PCT水平呈现上升趋势。但国内文献报道中的主要研究对象为非特定感染部位的患者,混杂因素较多。本研究通过回顾性分析细菌血流感染患者的PCT与肾功能水平,探讨肾功能对于血清PCT的影响,为临床医生制定更加科学合理的抗感染治疗方案提供帮助。
1 资料与方法
1.1 临床资料 回顾性收集某院2014年5月—2017年11月双份血培养结果阳性病例788例,通过查询电子病历及实验室信息系统筛选出187例符合要求病例。入组标准:(1)疑似血流感染后立即行血培养标本采集(双侧双瓶),其中至少两瓶血培养结果为阳性,且为同一病原体,并且在抽取血培养前后12 h内留取样本行PCT检测。参考美国疾病控制与预防中心(CDC)医院感染诊断标准中血流感染诊断标准:以临床诊断或治疗为目的,通过微生物培养或非培养方法,从取出的动脉或静脉血中鉴定出病原体[4]。(2)PCT>0.05 ng/mL。排除标准:(1)血培养结果为真菌的病例。(2)年龄≤2岁的儿童。(3)合并影响PCT水平的非感染性疾病,如外科手术和严重创伤、器官移植、肿瘤、血液系统疾病、自身免疫性疾病、急性胰腺炎等。
1.2 研究方法 将患者的性别、年龄、体重、血肌酐、初次PCT结果、感染严重程度、临床诊断等信息录入Excel 2007表内进行整理。参考美国重症医学会Sepsis 3.0标准,依据qSOFA/SOFA评分将患者的感染严重程度分为非脓毒症、脓毒症、感染性休克[5]。参考《诊断学》(第八版)[6],依据患者年龄、体重和血肌酐计算内生肌酐清除率(endogenous creatinine clearance rate, Ccr),Ccr>70 mL/min为肾功能正常,Ccr≤70 mL/min为肾功能损害,Ccr<30 mL/min为肾功能重度损害。采用Roche PCT电化学方法测定PCT,仪器为Roche cobas e601全自动电化学发光免疫检测仪。采用Roche cobas c702 全自动生化分析仪测定血肌酐。
本研究所属课题的另一研究[7]表明,革兰阴性(G-)菌血流感染与革兰阳性(G+)菌血流感染早期PCT水平存在统计学差异,为避免病原菌不同对本研究结果造成影响,先依据血培养病原菌革兰染色结果将187例患者分为G+菌和G-菌两组,再依据计算所得的Ccr将G+菌组和G-菌组分为:G+菌肾功能正常组23例,G+菌肾功能受损组27例(含G+菌肾功能重度受损组11例);G-菌肾功能正常组63例,G-菌肾功能受损组74例(含G-菌肾功能重度受损组23例)。因G+菌肾功能重度受损组样本量过少,仅11例,未比较G+菌肾功能正常组和肾功能重度受损组的PCT水平。研究最终分别比较G+菌肾功能正常组与肾功能受损组的PCT水平,G-菌肾功能正常组与肾功能受损组、G-菌肾功能正常组与肾功能重度受损组的PCT水平。
1.3 统计学方法 应用SPSS 17.0软件对数据进行统计学分析。计数资料采用χ2检验;计量资料先进行正态性检验,符合正态分布的数据,以均数±标准差表示,采用t检验;不符合正态分布的采用中位数及四分位间距表示集中和离散趋势,采用非参数秩和检验。采用受试者工作曲线(receiver operating characteristic curve,ROC)评估肾功能对PCT的影响。P≤0.05为差异具有统计学意义。
2 结果
2.1 基本资料 G+菌、G-菌肾功能正常组与肾功能受损组患者的性别构成、年龄比较,差异均无统计学意义(均P>0.05);G+菌肾功能受损组中,重度受损组患者11例。G-菌肾功能受损组中,重度受损组患者23例,其中男性12例,女性11例,年龄[68(53.00~72.00)]岁;G-菌肾功能正常组与重度受损组患者的性别构成、年龄比较,差异均无统计学意义(均P>0.05)。见表1。
表1G+菌、G-菌肾功能正常组与受损组患者基本资料的比较
Table1Comparison in basic information of patients between G+/NRF group and G+/IRF group, as well as G-/NRF group and G-/IRF group

基本信息G+菌肾功能正常组(n=23)肾功能受损组(n=27)χ2/ZPG-菌肾功能正常组(n=63)肾功能受损组(n=74)χ2/ZP性别0.650.420.230.63 男12114044 女11162330年龄(岁)66(39.00~61.00)72(3.00~61.00)-0.530.6059(53.00~65.00)64(53.00~68.00)-1.870.06
2.2 感染严重程度比较 G+菌、G-菌肾功能正常组与肾功能受损组患者的感染严重程度构成比较,差异均无统计学意义(均P>0.05)。23例G-菌肾功能重度受损组患者中感染性休克2例,脓毒症5例,非脓毒症16例,G-菌肾功能正常组与肾功能严重受损组患者感染严重程度构成比较,差异无统计学意义(P>0.05)。见表2。
表2G+菌、G-菌肾功能正常组与受损组患者感染严重程度比较(例)
Table2Comparison in severity of infection in patients between G+/NRF group and G+/IRF group, as well as G-/NRF group and G-/IRF group (No. of cases)

组别非脓毒症脓毒症感染性休克PG+菌0.10∗ 肾功能正常组(n=23)2030 肾功能受损组(n=27)1791G-菌0.53∗ 肾功能正常组(n=63)49104 肾功能受损组(n=74)59205
*:采用Fisher确切概率法
2.3 PCT水平比较 G+菌、G-菌肾功能正常组与肾功能受损组患者PCT水平比较,差异均无统计学意义(均P>0.05);23例G-菌肾功能重度受损组患者的PCT水平为[18.23(8.55~49.72)]ng/mL,G-菌肾功能正常组患者PCT水平低于重度受损组患者,差异有统计学意义(P<0.001)。见表3。
表3G+菌、G-菌肾功能正常组与受损组患者血清PCT水平比较
Table3Comparison in serum PCT levels in patients between G+/NRF group and G+/IRF group, as well as G-/NRF group and G-/IRF group
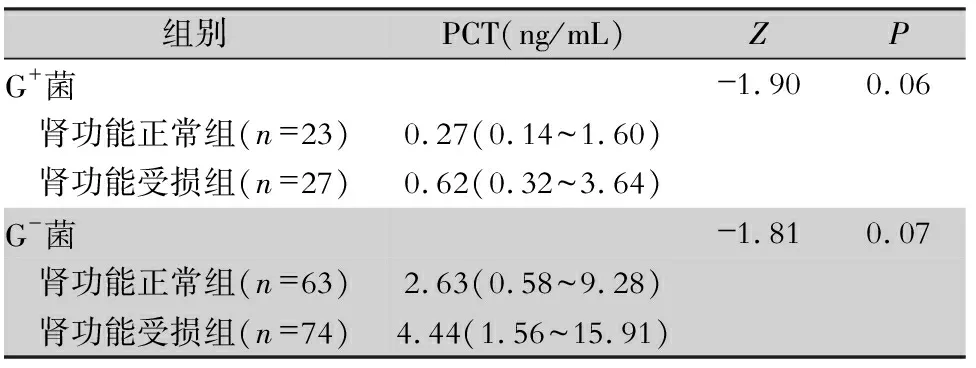
组别PCT(ng/mL)ZPG+菌-1.900.06 肾功能正常组(n=23)0.27(0.14~1.60) 肾功能受损组(n=27)0.62(0.32~3.64)G-菌-1.810.07 肾功能正常组(n=63)2.63(0.58~9.28) 肾功能受损组(n=74)4.44(1.56~15.91)
2.4 肾功能对PCT水平的影响 依据G-菌肾功能正常组与重度受损组患者PCT水平,取中位数4.26 ng/mL为折点,将上述两组患者的Ccr分为两部分(PCT水平>4.26 ng/mL和PCT水平≤4.26 ng/mL)绘制ROC曲线,曲线下面积(AUC)为0.664(P=0.009)。通过ROC曲线得出约登指数0.37,表明以Ccr作为71.81 mL/min临界值时,患者PCT水平受到肾功能重度损伤影响的阳性预测值灵敏度为86.0%,特异度为51.2%。见图1。
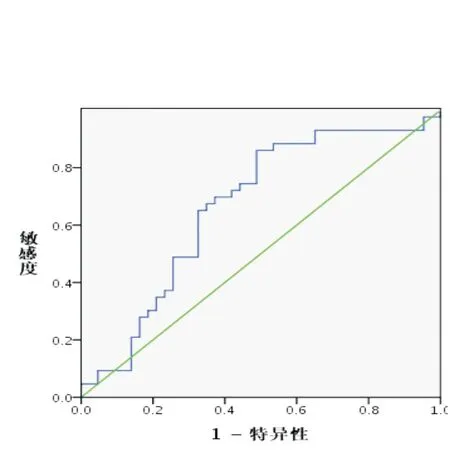
图1Ccr评估患者肾功能损伤造成PCT水平变化的ROC曲线
Figure1ROC curve of Ccr for evaluating changing in PCT level due to renal impairment in patients
3 讨论
PCT是无激素活性的降钙素的前体物质,是由116个氨基酸组成的糖蛋白,结构上包括降钙蛋白、降钙素和N端残基片段[8]。生理情况下,甲状旁腺C细胞可产生极少量的 PCT,健康人群的血清中几乎测量不到(<0.1 ng/mL)[9],在系统性全身炎性反应尤其是细菌感染的炎症状态下,肝库普弗细胞和单核细胞、肺及肠道组织的淋巴细胞及内分泌细胞,由内毒素、肿瘤坏死因子-α(TNF-α)及白介素-6(IL-6)等诱导、合成、分泌大量的PCT,导致血清PCT水平显著升高,且随着炎症的进展和控制而持续高水平或逐渐下降[10],并且与患者的预后相关[11-12]。有研究[13]显示,PCT在全身细菌感染后4 h即可检测到,6 h后急剧上升,并在6~24 h维持该水平,不会降解为降钙素,不受体内激素水平的影响,稳定性好,体内半衰期为25~30 h。其相较于传统的炎症指标,有着较好的诊断特异度,可用于鉴别诊断严重的全身性或细菌性感染[11,14]。
本研究结果表明,对于血流感染患者,不论病原菌是G-菌或G+菌,其PCT水平与肾功能总体水平无相关性,该结论与Meisner[15]等的研究结果相一致。患者的肾功能状态对细菌性血流感染患者的PCT水平无显著影响,可能影响因素是:在健康人群中,大约1/3的PCT是通过肾脏排泄的,有严重肾功能障碍的患者可有 PCT 基础水平升高,但是无PCT蓄积[16],Meisner等[15]的研究表明,肾对PCT的清除不是影响 PCT血浆质量浓度的决定因素,肾功能正常患者尿中PCT清除总量只占血清PCT的7.8%,而当肾小球滤过率下降至30 mL/min以下时,肾仍可清除3%的血清PCT。因此,肾功能的下降并不会导致血清PCT升高。
然而本研究对肾功能损伤分组后进一步分析发现,病原菌为G-菌的血流感染,肾功能重度受损组患者(Ccr≤30 mL/min)PCT水平较肾功能正常组(Ccr>70 mL/min)升高。可能与肾功能受损时患者PCT“血浆半衰期”延长及其微炎症状态有关。因为 PCT的分子量较低,大约为13 kDa,所以肾功能的正常状态有利于PCT从血浆中清除,而肾功能的严重损伤会影响血浆中PCT的清除速率和浓度。如果将重度肾功能不全患者的PCT临床观察清除率与肾功能正常的患者比较,无尿患者的血浆清除率的中位数大约延长1/3,肾功能正常患者PCT的50%血浆清除率的中位数大约为30 h(最低四分位数为:22~25 h),肾功能重度损伤患者大约在40 h(最低四分位数26~36 h)[15]。颜瑶等[17]在2016年的一项研究中发现,PCT用于诊断脓毒症的准确性虽然在非肾损伤及肾损伤各组中差异无统计学意义,但各组中的截点值差异存在统计学意义(非急性肾损伤0.59 ng/mL,风险期1.01 ng/mL,损伤期3.44 ng/mL,衰竭期4.17 ng/mL,P<0.01) ,在非脓毒症和脓毒症患者中,PCT与Scr呈正相关,而PCT与eGFR呈负相关。这些结果表明,PCT的清除路径涉及肾,因此与肾功能相关。除此之外,也有研究[18]表明随着肾功能的下降,患者的微炎症状态会导致其外周血单核细胞产生PCT增多,而在肾衰竭患者中由于微炎症反应较其他患者更为明显,因而单核细胞产生更多的PCT,导致肾衰竭患者血清PCT水平高于其他患者。
本研究还发现,对于G-菌肾功能重度损伤的血流感染患者,随着内生肌酐清除率的降低,PCT水平升高,当Ccr为71.81 mL/min时,患者PCT水平受到肾功能重度损伤影响的阳性预测值敏感性为86.0%,特异性为51.2%。
对于入院诊断有细菌感染的患者,医生通过PCT水平判断其感染严重程度的治疗过程中,可通过动态监测PCT水平的变化趋势判断病情进展情况 。本课题另一研究[7]表明:PCT对G-菌和G+菌所致细菌性血流感染有一定的鉴别作用;在PCT>1.81 ng/mL时,G-菌血流感染可能性较G+菌大。结合本研究的结论,在依据PCT水平判断患者感染可能病原体及感染严重程度时,需要考虑肾功能是否对PCT产生了影响,特别是Ccr<71.81 mL/min的患者,既有脓毒症、严重脓毒症或脓毒性休克、G-菌血流感染的可能,也不能排除肾功能受损(重度损伤)致PCT水平异常升高的可能;另外制定治疗方案时需要密切关注并评估患者的肾功能,应注意避免肾毒性药物如造影剂、肾血管收缩药物的应用及避免肾缺血和血容量减少,严密监测患者是否发生了急性肾损伤,及时开始肾替代治疗。因肾功能受损患者发生感染时,可引起感染性休克及多器官功能障碍综合征,极易导致肾小球滤过率下降而发生急性肾损伤(AKI),病死率极高[19]。
目前,PCT诊断脓毒症的界值水平为>0.5 ng/mL,那么对于严重肾功能不全患者,《降钙素原(PCT)急诊临床应用的专家共识》[1]建议,推荐使用在(0.5~1.5)ng /mL作为脓毒症诊断界值,亦需要在今后的研究中进一步明确。
