夹脊电针对急性脊髓损伤模型大鼠NLRP3炎症小体活化的实验研究*
2019-03-14李晓宁李庆琳梅继林
李晓宁,李庆琳,付 豪,梅继林
(1.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001; 2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
急性脊髓损伤(Acute spinal cord injury,ASCI)多由暴力外伤所致,其病理过程分为原发性损伤和继发性损伤[1]。原发性损伤因难以控制,因此聚焦于如何对SCI继发性损伤进行干预并促进神经功能修复。继发性损伤机制众多,而细胞焦亡作为一种细胞新型程序性死亡,激起了国内外学者讨论和广泛研究。研究成果显示多种神经疾病均有NLRP3过度活化而引起的细胞焦亡参与[2],那么此机制在急性脊髓继发性损伤中是否也存在呢?基于此,笔者以ASCI大鼠为对象,通过对比不同模型下炎性因子NLRP3、ASC、cleaved caspase-1的表达情况,对细胞焦亡机制进行探索,同时为临床夹脊电针治疗急性脊髓损伤提供实验依据。
1 实验材料
1.1 实验动物
由辽宁长生生物技术有限公司(许可证号2015-0001)提供的36只清洁级雌性大鼠,体质量为210~230g,实验过程中食物充足,饮水自由,室内温度控制在24℃~26℃,光照12 h昼夜循环,均按照动物关怀指南严格执行。
1.2 实验仪器
石蜡切片机(德国Leica,RM2235);电热恒温鼓风干燥箱(中国上海精宏,QH01-9030A);超纯水系统(中国香港Heal Force,NW10LVF型);显微镜(日本OLUMPUS,DP73);电热恒温培养箱(天津泰斯特,DH36001B);电针仪(中国英迪,KWD-808 II)。
1.3 实验试剂
过氧化氢(中国国药,10011218);无水乙醇(中国国药,10009218);苏木精(中国Solarbio,H8070);山羊血清(中国Solarbio,SL038);DAB显色液(中国Solarbio,DA1010);NLRP3(中国Wanleibio,WL02635);cleaved caspase-1(中国Wanleibio,WL03450);生物素化山羊抗兔IgG(中国Beyotime,A0277);辣根酶标记链酶亲合素(中国Beyotime,A0303);ASC(中国Bioss,bs-6741R)。
2 实验方法
2.1 动物分组与模型制备
将36只大鼠随机均分成假手术组(Sham)、模型组(Model)和夹脊电针组(EA),每组根据术后3、7天时间点又分为2个亚组,对每只大鼠编号并进行标记。
使用10%水合氯醛(3.5 mL/kg)注射大鼠腹腔进行麻醉。首先使大鼠俯卧将其固定,减去背部毛发以及常规消毒,根据大鼠肋骨体表标志确定第10胸椎位置。在第10胸椎处作长约3 cm的纵行手术切口,切开皮下肌筋膜,暴露9~11胸椎棘突,钝性分离附近肌肉至关节突水平,暴露其下的椎板,直至完整暴露脊髓组织。将10 cm玻璃管垂直立于暴露的脊髓组织,释放5 g的砝码,将其沿玻璃管自由落下,造成脊髓组织的局部损伤,操作完成后,用生理盐水冲洗局部并观察脊髓充血情况,最后缝合伤口。
2.2 造模成功标志
当砝码撞击脊髓时,可见大鼠肢体及躯干异常活动,双侧下肢痉挛回缩,移除砝码后可见暴露部位硬脊膜充血变红[3-4]。观察动物运动过程中各关节及躯体协调情况进行BBB评分,评分范围为0~21分,0分为无后肢运动,满分为21分为步态协调,躯干稳定,运动状态良好,0~7分主要观察后肢的活动情况。选取BBB评分为1~3分的大鼠入组,表现为大鼠后肢有1~2个关节可广泛活动[5]。
2.3 各组实验模型干预方法
假手术组在暴露脊髓后,回笼饲养,不采取任何处置,每日同步固定30 min;模型组大鼠在模型制备后每日同步固定30 min;夹脊电针组[6]干预方法为选用0.35 mm×13 mm规格的毫针对大鼠进行针刺,根据脊髓损伤位置选取针刺双侧T9、T11节段夹脊穴;针刺深度为4~5 mm;针刺后以脊柱同侧夹脊穴为一组连接电针仪,正极在上、负极在下;强度以大鼠可耐受且背部肌肉轻微抽动为宜(约为0.4~0.6 mA),时长30 min,日1次。
2.4 实验样本采集
根据大鼠活动能力,评分范围为0~21分,分数越高自主活动能力越强。各组大鼠于术后3天和7天时分别观察并记录BBB评分。
在治疗后3、7天时用水合氯醛(3.5 mL/kg)麻醉大鼠并处死,快速取出损伤处长度约2 cm的脊髓,置于4%多聚甲醛缓冲液中固定并保存,包埋切片,将标本蜡块装在切片机上,切成层厚为5 μm的薄片。烘干后,依次放入不同浓度的二甲苯和无水乙醇中反复浸泡,使切片脱蜡并通过3% H2O2以室温进行孵育和正常山羊血清封闭15 min;3种试剂一抗用PBS按1∶100比例稀释后二抗用PBS稀释200倍,孵育30 min,浸泡在PBS中5 min,重复3次。滴加100 μL的DBA显色试剂稀释后用苏木素复染,封片并以400×显微镜下拍照。
于术后各治疗时间点结束后取出其损伤处脊髓,以IHC法检测Nod样受体蛋白3 (NLR family pyrindomain-containing3,NLRP3)、凋亡相关的斑点样蛋白(Apoptosis-associated speck-like protein containinga CARD,ASC)、半胱氨酸天冬氨酸蛋白酶1(cleaved caspase-1)蛋白表达。
2.5 统计学分析
3 结果
3.1 各组大鼠治疗前后BBB评分的变化
Sham组大鼠术后BBB评分无明显变化。与Sham组相比,Model组大鼠术后各时间点BBB评分明显下降(P<0.05)。与Model组相比,EA组大鼠术后3、7天BBB评分显著升高(P<0.05)。见表1。

表1 各组大鼠BBB评分结果
3.2 各组大鼠脊髓组织中NLRP3表达
Model组大鼠脊髓组织术后各时间点NLRP3阳性细胞平均光密度值均高于Sham组(P<0.05)。给予夹脊电针治疗后,EA组大鼠脊髓组织NLRP3阳性细胞平均光密度值在各时间点均低于Model组(P<0.05)。见封三彩图1、图2。
3.3 各组大鼠脊髓组织中ASC表达
模型组大鼠脊髓组织术后各时间点ASC阳性细胞平均光密度值高于Sham组(P<0.05)。EA组大鼠脊髓组织ASC阳性细胞平均光密度值下降且显著低于Model组(P<0.05)。见封三彩图3、图4。
3.4 各组大鼠脊髓组织cleaved caspase-1表达情况
模型组大鼠脊髓组织术后cleaved caspase-1阳性细胞平均光密度值显著高于Sham组(P<0.05)。给予夹脊电针治疗后,EA组大鼠脊髓组织cleaved caspase-1阳性细胞平均光密度值低于Model组(P<0.05)。见封三彩图5、图6。
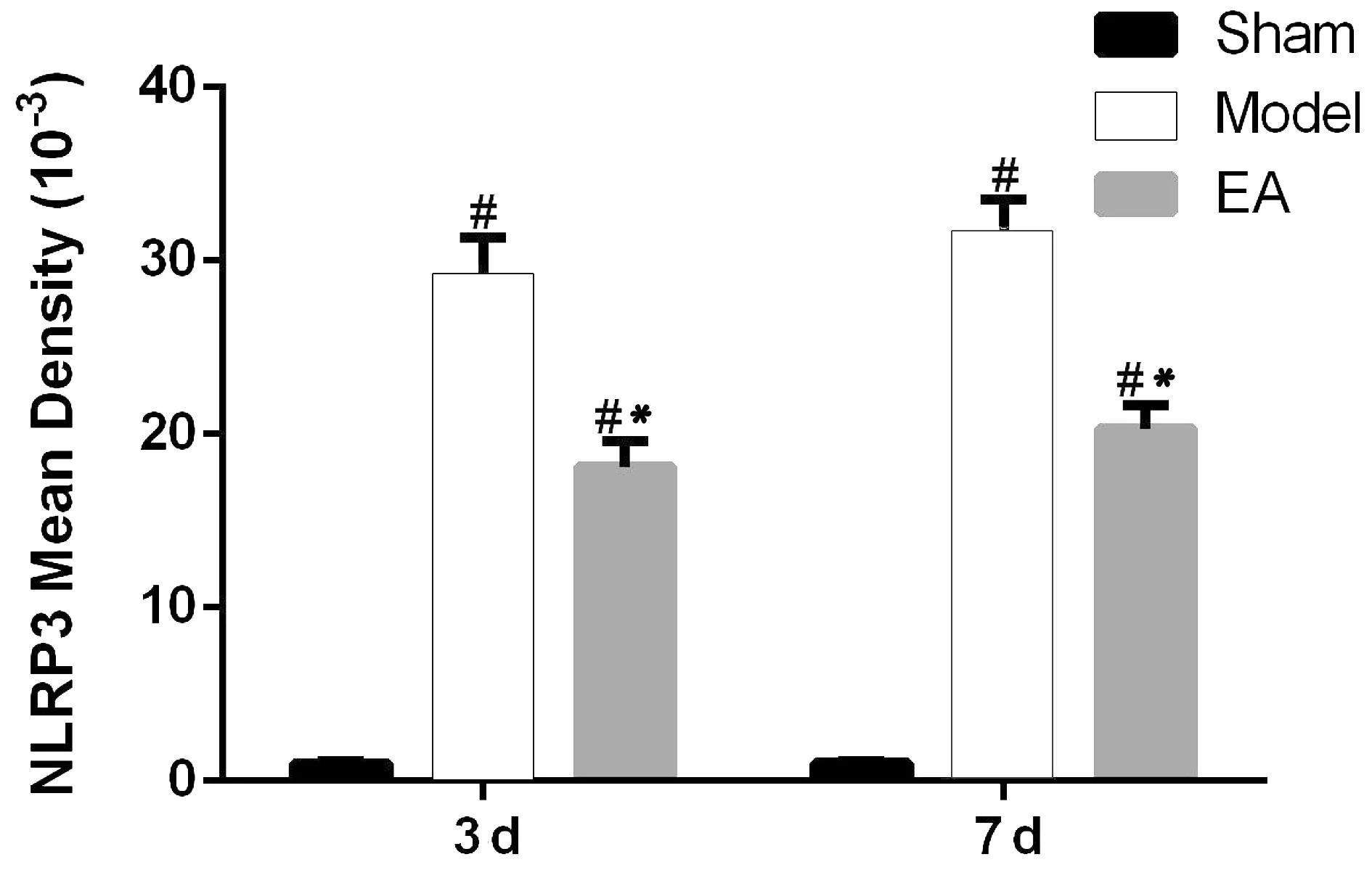
注:与Sham组比较,#P<0.05;与Model组比较,*P<0.05。

注:与Sham组比较,#P<0.05;与Model组比较,*P<0.05。
4 讨论
细胞焦亡作为一种新型程序性死亡方式,其经典焦亡途径由Caspase-1裂解相关蛋白促使细胞膜穿孔细胞内容物外溢,细胞最终死亡[7];同时Caspase-1还可以激活白细胞介素-1β(IL-1β)前体形成IL-1β,使炎症反应不断扩大,加重继发性损伤[8]。炎症小体在整个细胞焦亡信号通路中承接上游信号分子,再通过活化的Caspase-1传递焦亡信号至下游蛋白,最终细胞破裂并释放IL-1β和白细胞介素-18(IL-18),使细胞焦亡整个过程最终完成。
炎症小体NLRP3 一般通过两类复合体激活机体免疫应答,分别是NLR家族和ALR家族[9]。而本次实验涉及的NLR家族,是由NLRP3、ASC 和Caspase-1 前体组成的一种大分子多蛋白复合体。研究表明,针对NLRP3炎症小体活化的调控机制可能包括NLRP3 priming 阶段、蛋白复合物组装及亚细胞器等方面的调节[10]。NLRP3接受活化信号后,细胞内离子环境发生变化,钙离子、钾离子依赖于各自的离子通道而发生变化。钙离子升高,钾离子浓度不断降低并外流,现公认激活NLRP3必须通过降低钾离子浓度而实现[11]。炎症反应发生时NLRP3 与ASC 结合,同时Caspase-1 前体与其共同组装NLRP3 炎症小体,被活化的Caspase-1 最终诱导细胞焦亡。
除了多种神经系统疾病,同时NLRP3也与糖尿病、动脉粥样硬化、痛风等疾病的发展密切相关[12]。本次实验可证实在急性脊髓损伤中,NLRP3炎性小体同样参与急性脊髓损伤后炎性反应。Kim MJ[13]以及Rivero Vaccari JP[14]证明NLRP3炎性体介导了脊髓损伤后一系列炎症反应以及Jiang W[15]的研究皆表明NLRP3炎性小体是脊髓损伤继发性损害的重要因素。还有学者提出经典焦亡途径在中枢神经系统损伤后起主导作用,并提议针对该靶点进行干预[16]。
在中医学中本病属“痿病”范畴。督脉为阳脉之海,通调一身阳气,激发太阳、阳明、少阳经气,气血充盛,肢体得以濡润。况且在病位附近部位及其经脉取穴,发挥了腧穴的近治作用,使治疗目的更加明确。所以取夹脊穴对于全身运行气血,调和阴阳,可通经气使之上下贯通,阳气通达,刺激肢体运动具有重要意义。据解剖学研究发现[17],脊神经后内侧支分布在人体后正中线旁开0.5寸深部椎板表面,直刺夹脊穴可改善脊柱深层肌肉的痉挛状态,并通过其周围的脊神经根,向中枢系统进行信息反馈从而促进中枢系统相关支配区域的功能恢复,同时给予低频直流电传导神经冲动,促进神经突触可塑性。本次动物实验针刺穴位定位在损伤脊髓节段上下椎体棘突旁夹脊穴,是根据“电场”理论,损伤处适宜电场电流方向可减轻轴突损伤,并促进神经新生,保护神经元[18]。而通过既往研究可发现电针可通过清除自由基、提高组织抗氧化能力和缺氧缺血状态而改善微环境;同时抑制神经细胞凋亡促进脊髓神经恢复[19-21]。
本次实验以机械砸压的方式造成大鼠脊髓局部充血损伤,使大鼠肢体运动功能受损视为造模有效,最终选取BBB评分3分以下进行入组。模型组运动功能评分下降而炎性指标均显著升高,而夹脊电针治疗后3天及7天各项观察指标均向良性方向改善,且在7天的时间点各项均高于3天,虽然由于样本有限而无显著差距,但有着良好的趋向性,可能疗效与治疗天数之间具有量效关系,但还需要进一步研究。课题组在之前的实验中证实了夹脊电针对于急性脊髓损伤组织微环境Rho-ROCKⅡ信号通路以及细胞凋亡的抑制作用,本次实验补充其不足并从炎性反应方面进行观察,更加全面地验证夹脊电针对于急性脊髓损伤的作用机制。
结果显示,夹脊电针治疗能提高脊髓损伤大鼠模型BBB评分且降低NLRP3、ASC和Caspase-1表达,防止炎性小体过度活化,减缓细胞焦亡,改善脊髓继发性炎性损伤,最终实现大鼠肢体活动能力增强,为脊髓损伤不断发掘新的致病机制以及为临床夹脊电针治疗脊髓损伤提供实验依据。
