球形镍氧化物制备硫酸镍的方法研究
2019-03-14冯建华李亦婧卢晓锋
冯建华 ,周 通,李亦婧 ,郭 勇 ,卢晓锋
(1.金川集团股份有限公司,甘肃金昌737100;2.中国科学院兰州化学物理研究所)
锂离子电池是绿色新型电池,由于其具有工作电压高、能量密度大、循环寿命长等优点,在未来新能源发展中有巨大的潜力。锂离子电池由正极、负极、电解液、隔膜等组成,其能量存储和释放是以电极材料的氧化还原反应形式实现的,正极活性物质是最为关键的核心材料[1]。镍钴酸锂、镍钴锰酸锂、镍钴铝酸锂等含镍的正极材料陆续产业化并应用于众多领域。随着新能源汽车的发展,镍钴锰三元电池逐渐取代价格高昂的钴酸锂电池成为电池的主流[2]。近年来钴价持续走高,性能稳定、价格低廉的高镍材料成为电池材料的发展方向。因此,硫酸镍(NiSO4)的产量和品质的提高成为关键点。
NiSO4不仅作为三元电池材料镍钴锰酸锂的重要组成成分,而且也广泛应用于电镀、印染、医药、建筑、国防等领域。NiSO4的制备方法主要有化学法和电化学法,而生产NiSO4的原料包括电镍、高冰镍、含镍的废旧物质以及粗氢氧化镍等[3-5]。高纯硫酸镍需要粗硫酸镍经除杂(化学法[4,6]、萃取法[7])后结晶获得,流程繁杂,存在镍损失较大、耗时、耗能等缺点。同时,随着开采的进行,红土矿的品位降低,相应的工业氢氧化镍中的镍含量减低、杂质成分升高,加之供应短缺、生产成本增加等因素,使得寻求新的硫酸镍生产原料成为必须考虑的问题。为提高NiSO4的品质,高品质NiSO4的生产原料以及与其相对应的生产方法的探索成为硫酸镍生产的关键。金川集团股份有限公司与中国科学院兰州化学物理研究所合作开发了一种简洁、高效合成高纯硫酸镍的方法。
1 实验部分
1.1 原料和仪器
原料:球形镍氧化物,由金川集团提供;硫酸,购买自西陇化工股份有限责任公司;高纯水,由重庆摩尔高纯水处理设备制取。
仪器:ESCALAB 250Xi X射线光电子能谱仪(XPS);X′PERT Pro X 射线衍射仪(XRD);725-ES 电感耦合等离子体发射光谱仪(ICP-OES);JSM-5601LV扫描电子显微镜(SEM);TGYF-A型高压反应釜(聚四氟乙烯内衬);PHS-3B型精密PH计。
1.2 原料分析
将球形镍氧化物消解,利用ICP-OES对球形镍氧化物成分进行分析,结果见表1。由表1看出,该类球形镍氧化物含镍量较高(质量分数为77.96%),是一种高纯的含镍化合物,其含镍量接近于氧化亚镍(NiO)的含镍量,因此该类球形氧化物可能为NiO。
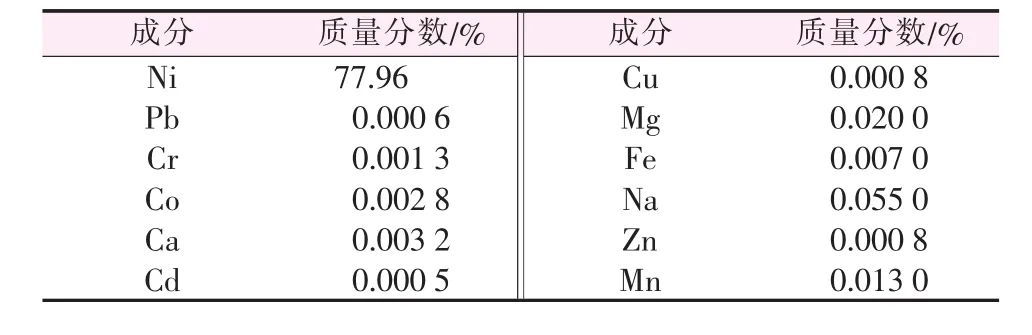
表1 球形镍氧化物成分分析结果
借助XRD和XPS对球形镍氧化物的成分进行详细研究,结果见图1。由图1看出,该类球形镍氧化物与 NiO[8](JCPDS No:73-1523)卡片数据相一致,所以该类球形镍氧化物为NiO;相应地,镍原子能谱衍射数据证明镍原子主要以+2价[9-10]形式存在于化合物中,且与NiO的衍射数据基本一致,从侧面证实了球形镍氧化物的组成。由于NiO表面外壳坚硬,不易破损,考虑在高温高压条件下对其进行浸取。

图1 球形镍氧化物XRD谱图(a)和镍原子XPS图(b)
1.3 浸取方法
称取10 g球形镍氧化物、量取50 mL浓度为1.84 mol/L的H2SO4溶液,置于100 mL高压反应釜中,放入磁子,密封。控制加热温度为200℃,反应6h后停止反应。抽滤,滤液采用ICP-OES检测离子含量,滤渣用弱酸水洗涤后干燥、称其质量。在浸取过程中,体系的压力来源于密闭条件下水的饱和蒸气压而非外压。反应方程式:
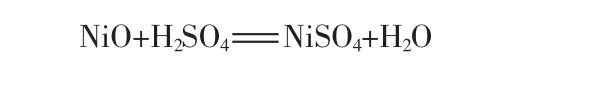
2 结果与讨论
2.1 初始酸度优化
将10 g球形镍氧化物与50 mL不同浓度的H2SO4溶液置于100 mL高压反应釜中,在200℃加热反应6 h,将反应后剩余的固体质量和反应后溶液pH分别与H2SO4浓度作图,结果见图2。由图2发现:随着H2SO4浓度增加,溶液中剩余的固体质量减少,两者基本成线性关系;当H2SO4浓度小于1.84 mol/L时,反应后溶液pH基本一致,而H2SO4浓度大于1.84 mol/L后,溶液pH迅速下降,酸性增强。为减少结晶过程中酸的夹带和确保溶液中Ni离子浓度足够大,选择1.84 mol/L的H2SO4溶液作为起始酸度。
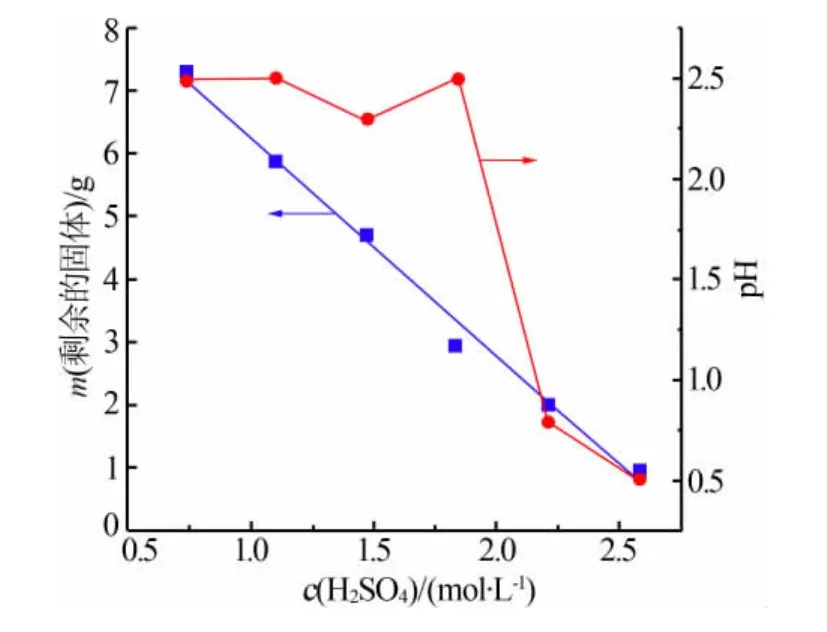
图 2 反应后剩余的固体质量和反应后溶液pH与H2SO4浓度的关系
2.2 固液比
不同质量的球形镍氧化物与50 mL浓度为1.84 mol/L的H2SO4溶液置于100 mL高压反应釜中,在200℃反应6 h,将反应的固体质量与固液比作图,结果见图3。由图3发现:随着固液比提高,反应的镍氧化物质量增加;当固液比大于0.3 g/mL后,反应消耗的镍氧化物质量基本不变。因此,该反应的最佳固液比为0.3 g/mL。

图3 反应的固体质量与固液比的关系
2.3 反应时间
将15g球形镍氧化物与50mL浓度为1.84mol/L的H2SO4溶液置于100 mL高压反应釜中,在200℃反应不同的时间,将反应后剩余的固体质量与反应时间作图,结果见图4。由图4发现:反应剩余的固体质量随着反应时间的延长逐渐减少;当反应时间高于6 h时,剩余固体质量基本恒定。因此,最佳反应时间为6 h。
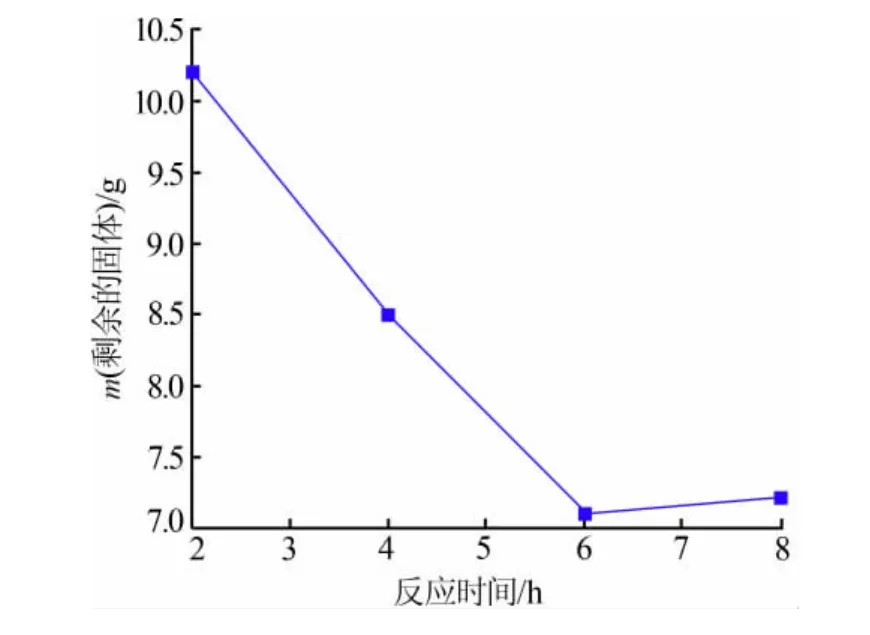
图4 反应后剩余的固体质量与反应时间的关系
2.4 温度优化
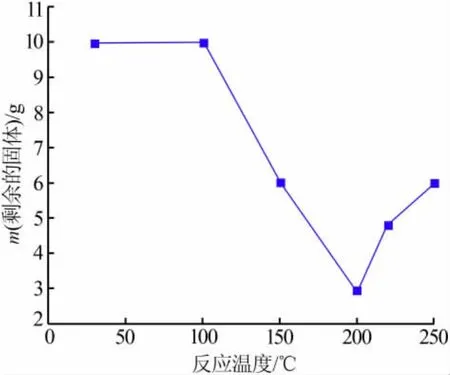
图5 反应后剩余的固体质量与反应温度的关系

图6 150℃(a)和 250℃(b)反应后的滤渣照片
将10g球形镍氧化物与50mL浓度为1.84mol/L的H2SO4溶液置于100 mL高压反应釜中,控制不同的反应温度加热反应6 h,将反应后剩余的固体质量与温度作图,结果见图5。由图5发现:当温度低于100℃时,球形镍氧化物未发生反应;当温度为100~200℃时,随着温度升高球形镍氧化物溶解量也在增加;当温度超过200℃时,溶液中剩余的固体质量增加。需要说明的是,低温时不发生反应的原因可能是球形镍氧化物表面有一层致密的氧化层不容易被酸腐蚀。另外,高温时溶液中固体质量的增加不是由于反应程度的减弱,而是由于新生成的硫酸镍溶液在高温条件下析出大量白色固体。图6为150、250℃反应剩余固体的照片。由图6看出,反应温度为150℃时,滤渣大部分为未反应的球形镍氧化物和部分反应剩余的黄绿色残渣;反应温度为250℃时,滤渣中仅有少量的球形镍氧化物存在,大部分为白色析出物。对两者分别进行表面分析:150℃反应剩余固体Ni质量分数为64.97%、O质量分数为23.93%、C质量分数为11.10%;250℃反应剩余固体Ni质量分数为40.13%、O质量分数为39.39%、S质量分数为15.84%、C质量分数为4.64%,其中C来源于双面胶。由此看出,白色析出物为含Ni、O、S的复合物。利用XRD对白色析出物的组成进行分析(见图7),通过比对发现白色析出物的衍射峰与NiSO4·H2O(JCPDS No: 81-0021)和 NiO(JCPDS No:73-1523)的卡片数据相吻合,且大部分成分为NiSO4·H2O,少量为NiO(来源于未反应的原料)。为避免复合物析出,选择200℃作为最佳反应温度。此外,为保证NiSO4·H2O充分析出,在后续工作中对250℃的反应时间进行了优化。
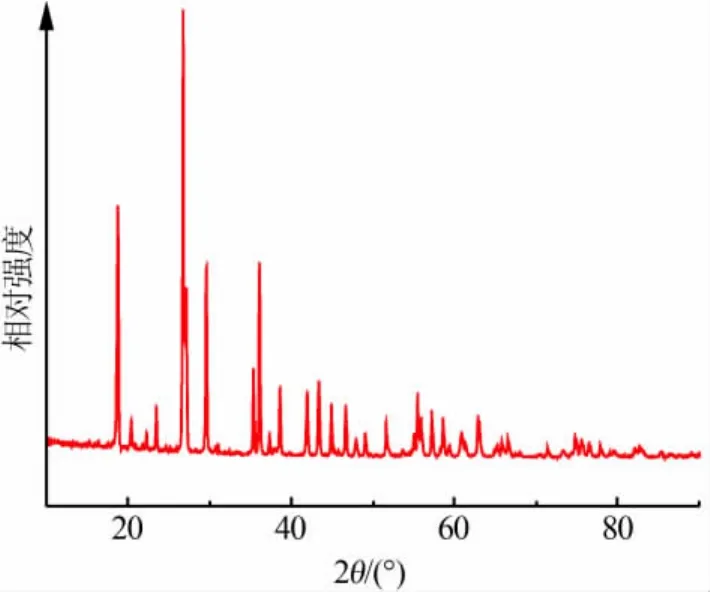
图7 白色析出物XRD谱图
2.5 放大实验
利用上述最优条件(H2SO4浓度为1.84 mol/L,固液比为0.3 g/mL,反应温度为200℃,反应时间为6 h)对100 g的球形镍氧化物进行浸取,浸取后溶液pH=2.5,其他各金属离子质量浓度见表2。由表2看出,溶液中Ni质量浓度高达114.58g/L,并且除了Mn、Co、Mg、Fe 离 子 浓 度 较 高 外 ,Pb、Cr、Cd、Cu、Na、Zn等离子浓度均非常低。该溶液与由粗氢氧化镍浸取制备的硫酸镍相比较,杂质含量明显较低[11]。
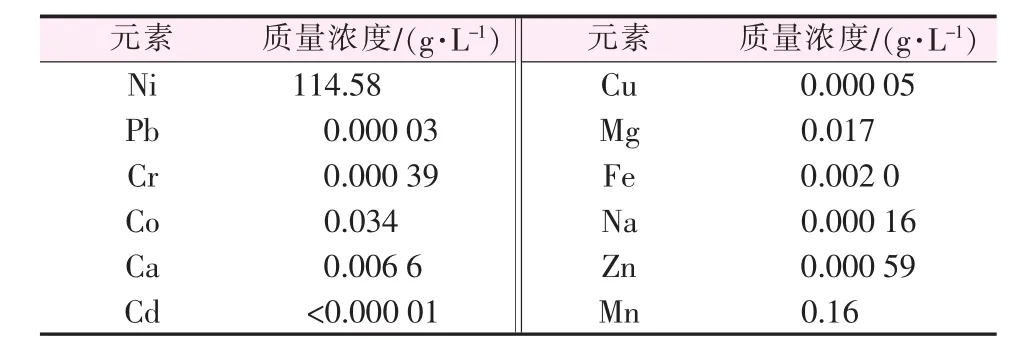
表2 最优条件制备硫酸镍溶液成分分析结果
2.6 高纯硫酸镍的制备
通过上述对各条件的优化,获得了较稳定的高温高压条件下浸取制备硫酸镍的方法。但是,本方法所得浸取液pH最高达到2.5,在结晶过程中容易造成酸夹带,使最终的硫酸镍结晶酸度过高而无法满足精制硫酸镍的生产要求。因此,将250℃条件下生成的NiSO4·H2O经过滤、洗涤后,在水溶液中再次溶解制备高纯硫酸镍溶液。NiSO4·H2O经洗涤后基本为中性,再次溶解过程中溶液pH可以根据起始水溶液的酸度进行自由调控。将冷水洗涤、干燥后的10 g NiSO4·H2O与30 mL pH=5.0的稀酸水溶液混合,在70℃加热30 min获得澄清溶液。过滤,移除未溶解的黑色球形NiO,对溶液中的离子含量进行分析,结果见表3。由表3看出,溶液中Ni质量浓度高达101.5 g/L,并且除了Mg外,其他元素的含量均非常低且溶液pH在5.0左右。
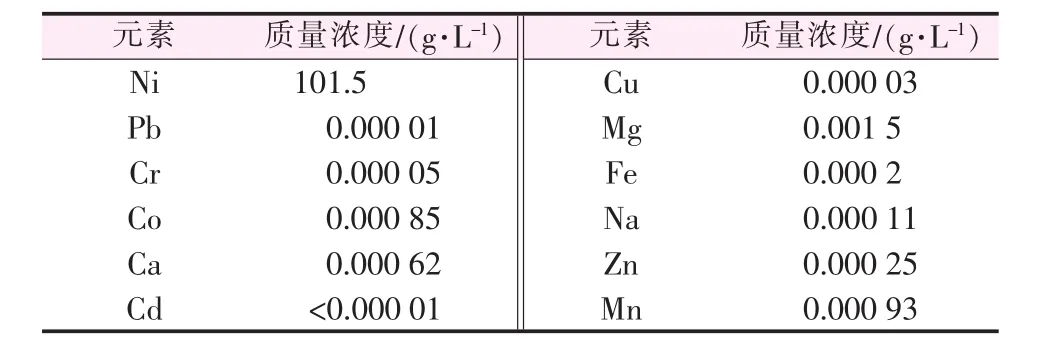
表3 精制硫酸镍溶液成分分析结果
3 结论
1)通过XRD和XPS等表征手段,确认纯度较高的球形镍氧化物的主要成分为NiO。2)根据原料特征,探索了其在高温高压条件下的最优浸取条件,最终确立了H2SO4浓度为1.84mol/L、反应温度为200℃、固液比为0.3 g/mL、反应时间为6 h为最优反应条件。根据此条件还进行了相应放大实验,结果表明采用该方法浸取后Ni质量浓度达到110 g/L以上,其他杂质含量均较低。3)以250℃生成的NiSO4·H2O为原料,再次溶解于水溶液形成硫酸镍溶液,溶液酸度可控,能够根据需求制备任意pH和镍离子浓度的硫酸镍溶液,而且其他金属杂质的含量非常低。
