荆芥挥发油抗内毒素中毒小鼠NLRP3炎症小体通路的机制研究
2019-03-14吕红君温桃群刘小波
吕红君,温桃群,罗 杰,刘小波,杨 菊,曾 南
(1. 成都中医药大学药学院,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137;2. 四川大学生物治疗国家重点实验室,四川 成都 610064)
荆芥为唇形科一年生草本植物荆芥(SchizonepetatenuifoliaBriq.)的干燥地上部分,是临床常用解表药,其味辛性平而偏寒,具有良好的祛风解表功效,临床上常用于治疗与风邪有关的表证及皮肤、头目疾患,而这些疾病都与炎症的病理过程相关。荆芥挥发油(essential oils ofSchizonepetatenuifoliaBriq., EOST)含量丰富,是其辛味药性的物质基础之一[1]。实验室前期研究表明,EOST预防给药能通过下调促炎因子的释放,减轻炎性细胞浸润等,抑制炎症反应,从而发挥对内毒素中毒模型小鼠的保护作用,但其抗炎效应的分子机制有待进一步研究[2]。本研究基于前期药效研究基础,从NLRP3炎症小体激活角度,探讨EOST对内毒素中毒模型小鼠保护作用的抗炎效应机制,以期进一步揭示其抗炎作用机制,为EOST治疗“表证”的临床应用提供科学依据。
1 材料
1.1实验动物♂C57BL/6J小鼠(动物合格证号11400700130007),体质量(20±2)g,SPF级,购自北京维通利华实验动物有限公司,许可证号:SCXK(京)2012-0001。
1.2药物与试剂荆芥,购自成都新荷花池中药材市场,经成都中医药大学中药鉴定教研室严铸云教授鉴定,为唇形科一年生草本植物荆芥(SchizonepetatenuifoliaBriq.)的地上部分。EOST的制备同文献[2],实验时用0.35%吐温-80(Tween-80)配制药物,给药剂量分别为其半数致死量(LD50)的1/10和1/5,即0.226、0.452 g·kg-1。地塞米松、脂多糖(lipopolysaccharides from Escherichia coil 055:B5, LPS),均购自美国Sigma公司; NO试剂盒,购自碧云天生物技术研究所;FastQuant cDNA 第一链合成试剂盒、SuperReal PreMix Plus(SYBR Green),均购自天根生化科技(北京)有限公司;AxyPrepTMMultisource Total RNA Miniprep Kit, 购自Axygen公司;抗组织蛋白酶(Cathepsin)B、嘌呤受体 P2X7(purinergic 2X7 receptor, P2X7R)、GADPH、COP1抗体,均购自美国Abcam公司;抗NLRP3、pro-IL-1β抗体,均购自美国Cell Signaling公司;生物素化山羊抗兔IgG(H+L)、辣根酶标记链霉素卵蛋白素(HRP/A-V)、浓缩型DAB试剂盒,均购自北京中杉金桥生物技术有限公司;凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC) 抗体,购自Abbexa; caspase-1(p20)抗体,购自Santa Cruz公司;引物均由Invitrogen公司设计。
1.3仪器酶标仪、NanoDrop 2000(美国Thermo Fisher Scientific公司);PCR仪、凝胶成像系统、转膜仪(美国Bio-Rad公司);2015型轮转式切片机(德国徕卡公司);TSJ-Ⅱ型组织脱水机(常州市中威电子仪器有限公司);BA200Digital 数码三目摄像显微摄像系统(麦克奥迪实业集团有限公司)。
2 方法
2.1实验分组、给药与造模取健康C57BL/6J♂小鼠,按体质量分层,随机分为空白组、模型组、地塞米松(0.005 g·kg-1)组、EOST(0.226、0.452 g·kg-1)组。除地塞米松组在d 4、5腹腔注射给药2次外,其余给药组小鼠按20 mL·kg-1体积灌胃给药,空白组与模型组给予等体积0.35%吐温-80溶液,连续给药5 d。末次给药后30 min,小鼠腹腔注射LPS (0.015 g·kg-1,10 mL·kg-1) 造模,造模后12 h剖取小鼠肺组织,将右肺置于-80℃保存,左肺置于体积分数为10%的中性福尔马林溶液中,用于免疫组化实验。
2.2小鼠肺组织中NO含量的检测按试剂盒说明书制备肺组织匀浆,采用Griess法进行NO含量测定。
2.3小鼠肺组织NLRP3、ASC、caspase-1、IL-1β、iNOS、p65mRNA的检测取 “2.1”项下所得右肺组织于冰上解冻后,按照Axygen总RNA小量制备试剂盒步骤提取总RNA,测定总RNA纯度和浓度,并检测所得总RNA样本的完整性(琼脂糖凝胶)。逆转录合成cDNA,qPCR分析NLRP3、ASC、caspase-1、IL-1β、iNOS、p65 mRNA的表达。采用相对定量法,以GADPH基因为内参基因,以样本的平均Ct值作为校正值,通过差异值反映EOST对模型小鼠肺组织NLRP3、ASC、caspase-1、IL-1β、iNOS、p65 mRNA表达的影响。引物序列见Tab 1。
2.4免疫组化检测小鼠肺组织CathepsinB、P2X7R的表达将 “2.1”项下所得左肺组织石蜡切片常规脱蜡至水,热抗原修复和山羊血清封闭后,用一抗、二抗孵化,DAB显色,苏木精复染,脱水,透明,中性树胶封片。采集图像,细胞膜或细胞质内出现浅黄色或棕色的颗粒物质为阳性表达。采用Image-Pro Plus 6.0图像分析系统,测定所采集全部图像的平均光密度(平均光密度=黄色或棕色部分的累积光密度值/照片面积)。
2.5Westernblot检测小鼠肺组织NLRP3、caspase-1(p20)、pro-IL-1β、COP1蛋白表达取各组小鼠右肺组织40 mg,加入液氮制成粉末状,再加入400 μL RIPA裂解液制备匀浆,4℃、10000 r·min-1离心5 min,取上清,釆用BCA法测定蛋白含量,将所有蛋白样本调至等浓度。取低温保存的蛋白样品,95 ℃水浴加热5 min后,上样电泳。采用湿法转膜,转膜后的PVDF膜用封闭液(5%脱脂牛奶)封闭2 h,加入一抗孵育过夜,漂洗后,加入二抗孵育1.5 h。显色液显色后测定灰度值,运用 Image lab图像分析系统测定光密度值,目的蛋白条带灰度值/内参蛋白条带灰度值即为蛋白相对含量,进行统计分析。
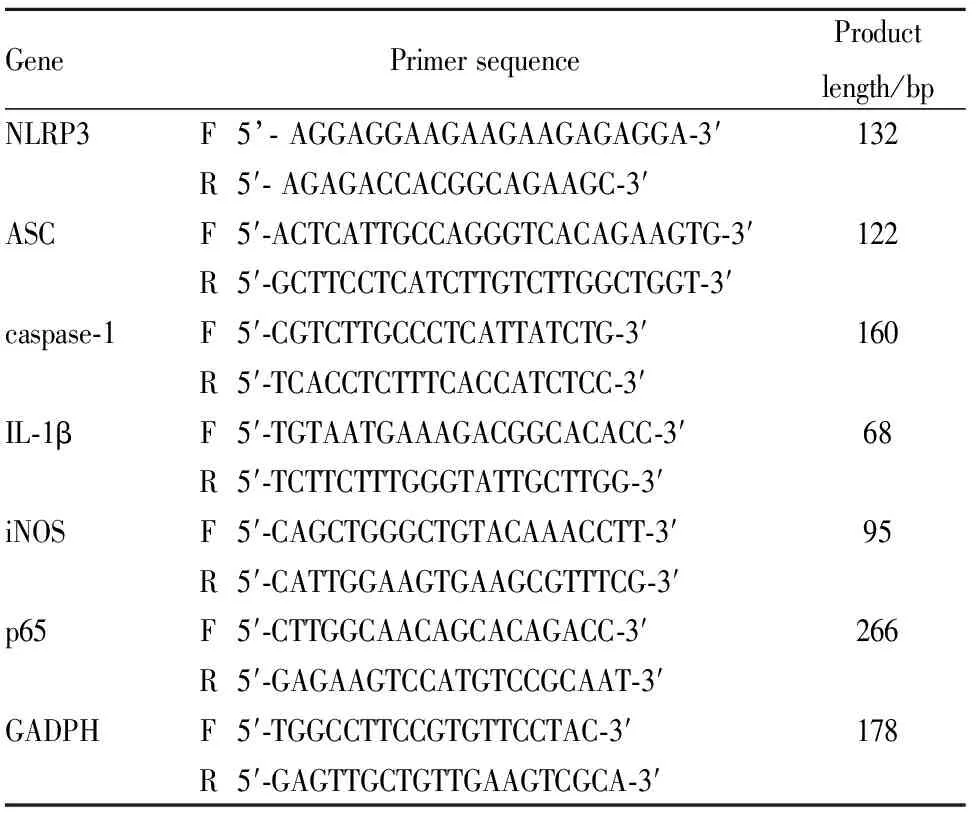
Tab 1 Gene primer sequences

3 结果
3.1EOST对LPS中毒模型小鼠肺组织NO含量的影响如Tab 2所示,模型组小鼠NO含量较空白对照组明显升高(P<0.05);EOST 0.452 g·kg-1剂量组小鼠肺组织NO含量较模型组明显降低(P<0.05)。

Tab 2 Effect of EOST on level of NO in lung tissues of inflammatory mice induced by endotoxin n=7~8)
#P<0.05vscontrol;*P<0.05vsmodel
3.2EOST对模型小鼠肺组织NLRP3、ASC、caspase-1、IL-1β、iNOS、p65mRNA表达的影响Tab 3所示,与空白组比较,模型组小鼠肺组织中NLRP3、caspase-1、iNOS、p65、IL-1β mRNA表达水平明显升高(P<0.01,P<0.05),提示NLRP3炎症小体被激活。与模型组比较,EOST 0.452 g·kg-1明显降低小鼠肺组织中NLRP3、iNOS、p65、IL-1β mRNA的表达(P<0.01,P<0.05)。
3.3EOST对内毒素中毒模型小鼠肺组织CathepsinB、P2X7R表达的影响由Fig 1可知,与空白组相比,模型组小鼠肺组织Cathepsin B、P2X7R蛋白表达水平明显升高(P<0.01)。与模型组比较,EOST 0.226 g·kg-1明显降低模型小鼠肺组织Cathepsin B蛋白含量(P<0.01),EOST 0.452 g·kg-1明显降低小鼠肺组织中P2X7R蛋白含量(P<0.05)。
3.4EOST对中毒模型小鼠肺组织NLRP3、caspase-1(p20)、pro-IL-1β、COP1蛋白表达的影响如Fig 2所示,与空白组比较,模型组小鼠肺组织中NLRP3、p20、pro-IL-1β蛋白表达量明显上升(P<0.01,P<0.05),COP1蛋白表达明显降低(P<0.05)。与模型组比较,EOST(0.226、0.452 g·kg-1)能明显下调p20蛋白水平(P<0.01,P<0.05),二者亦能明显升高COP1蛋白水平(P<0.01,P<0.05);EOST 0.226 g·kg-1明显下调NLRP3蛋白表达水平(P<0.05)。
4 讨论
病原微生物的感染是“表证”的一个主要病因,炎症反应是“表证”的一个主要病理环节,解表药的解表功效与其抗炎作用密切相关。由于肺为“娇脏”,易受外邪入侵,且“肺主皮毛”,然“皮毛”为一身之表,有抵御外邪之功能,是人体抵抗外邪的屏障。LPS是革兰阴性菌细胞壁的重要成分,作为细菌分泌的内毒素,是导致炎症反应发生的重要原因。本研究选择LPS腹腔注射诱导的内毒素中毒模型小鼠,基于前期药效学的研究基础[2],以NLRP3炎症小体通路为切入点,探讨EOST对内毒素中毒模型小鼠保护作用的抗炎效应分子机制,为荆芥“解表祛邪”功效的科学内涵阐释提供更为丰富的科学依据。

Tab 3 Effect of EOST on expressions of NLRP3, ASC, caspase-1, IL-1β, iNOS, p65 mRNA in lung tissues of inflammatory mice induced by endotoxin n=4~5)
#P<0.05,##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
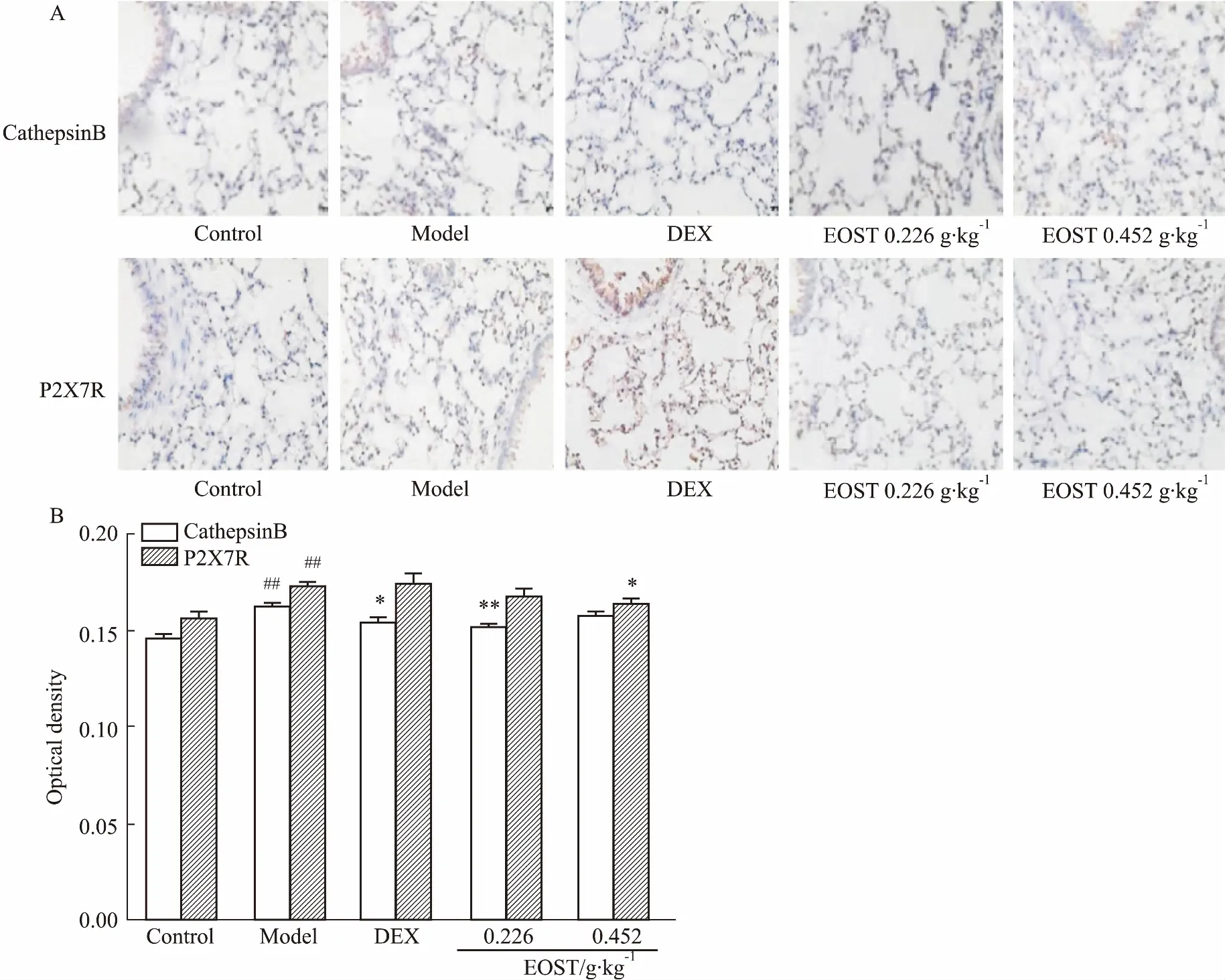
Fig1EffectofEOSTonproteinexpressionsofCathepsinBandP2X7Rinlungtissuesofinflammatorymiceinducedbyendotoxin

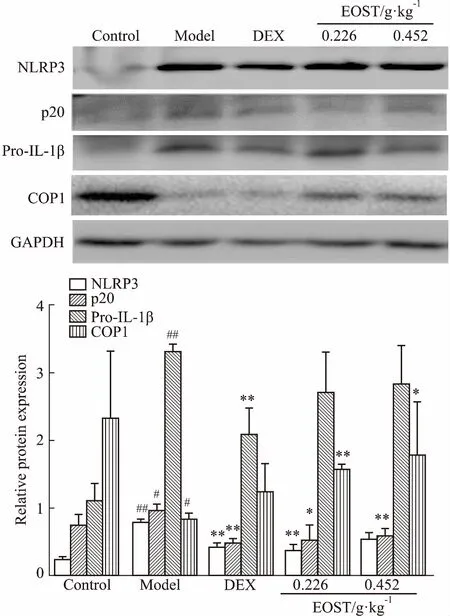
Fig 2 Effect of EOST on expressions of NLRP3, caspase-1(p20), pro-IL-1β, COP1 protein in lung tissues of inflammatory mice induced by endotoxin n=4)
#P<0.05,##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
机体在受到革兰阴性细菌感染时,LPS作用于细胞膜受体,可导致大量炎性细胞因子和炎性介质的产生。NO是内毒素中毒机体产生的一种重要活性物质,其参与炎症反应,作用复杂,在不同类型的炎症反应和炎症阶段发挥着抗炎或者促炎的作用。体内NO由一氧化氮合酶(nitric oxide synthase, NOS)催化L-精氨酸产生,NOS包括结构型一氧化氮合酶(constitutive NOS, cNOS)和诱导型一氧化氮合酶(inducible NOS, iNOS),cNOS 可源源不断地产生,而iNOS只有在受到感染或其他刺激时才产生[3]。炎症反应中,经LPS和细胞因子刺激后,会生成iNOS,从而合成大量NO[4]。在高浓度条件下,NO激活NF-κB,诱导促炎症细胞因子TNF-α、IL-1β等的产生,TNF-α的产生又可激活iNOS,促进机体产生更多的NO,从而形成正反馈循环,使炎症细胞因子的分泌及NO自身的表达得以持续,致使炎症反应更持久、剧烈[5]。文献表明,薄荷酮抗炎作用的发挥可能通过影响 NO 的释放,来干扰NLRP3炎症小体的激活[6]。本研究发现,由LPS引起的中毒模型小鼠肺组织中NO的水平和 iNOS基因的转录水平均明显升高,表明小鼠处于炎症病理状态。EOST能减少模型小鼠肺组织中NO水平,下调 iNOS mRNA表达水平,进一步验证表明该挥发油对内毒素中毒模型小鼠有抗炎保护作用。
NLRP3炎症小体由核心蛋白NLRP3、接头蛋白ASC和效应蛋白caspase-1组成,能被一些内源性危险信号和外源性因素所激活,包括活性氧(reactive oxygen species, ROS)、LPS等[7-8]。NLRP3炎症小体受到这些激活剂刺激后,效应蛋白caspase-1会负责将无活性的前炎症因子Pro-IL-18和Pro-IL-1β剪切为成熟的IL-18和IL-1β,从而激活下游相关信号通路,生成大量的炎症介质,诱导机体发生严重的炎症反应。本研究发现,小鼠经内毒素攻击后,其肺组织中NLRP3、caspase-1、IL-1β mRNA表达明显升高,肺组织NLRP3、caspase-1(p20)和 Pro-IL-1β 蛋白表达亦明显增加,表明该模型小鼠肺组织中NLRP3炎症小体信号通路被激活,而EOST预防性给药,可明显下调模型小鼠肺组织中NLRP3、IL-1β mRNA和NLRP3、caspase-1(p20)蛋白表达水平,提示EOST对NLRP3炎症小体信号通路的激活具有抑制作用。
NLRP3炎症小体上游通路较为复杂,其激活的机制也不尽相同。其中, P2X7R是ATP门控离子通道,参与了机体免疫反应。K+外流是NLRP3炎症小体活化的关键环节,细胞内的K+可通过P2X7R外流,进而激活NLRP3炎症小体信号通路[9]。受到ATP刺激后,溶酶体被破坏,释放的Cathepsin B等多种溶酶体水解酶可介导NLRP3炎症小体的激活[10]。p65作为NF-κB信号通路激活的标志性蛋白,p65 mRNA的表达增加则表明NF-κB信号通路处于激活状态,调控NF-κB的活性能间接影响NLRP3炎症小体的激活[11]。只含CARD结构域蛋白COP1在炎症小体调控中发挥重要作用,COP1含有1个与caspase-1相似的CARD结构域,所以COP1可以通过竞争caspase-1,干扰炎症小体的组装,从而负向调控NLRP3炎症小体活化[12]。本实验结果显示,模型组小鼠肺组织 P2X7R、Cathepsin B蛋白表达明显升高,p65、caspase-1 mRNA表达明显增高,COP1蛋白表达明显降低,表明该模型小鼠肺组织NLRP3炎症小体激活,其激活机制涉及多条上游信号通路。EOST预防性给药,能明显下调模型小鼠肺组织中P2X7、Cathepsin B蛋白,以及p65、caspase-1 mRNA的表达,明显上调COP-1蛋白表达,提示EOST抑制NLRP3炎症小体的激活是其抗炎作用机制之一,可能通过影响K+/P2X7R、溶酶体/Cathepsin B、NF-κB、COP-1/caspase-1等多种途径,发挥抑制效应。
综上,LPS所诱导的中毒模型小鼠体内NLRP3炎症小体信号通路呈现激活状态,EOST对内毒素中毒模型小鼠有抗炎保护效应,且EOST抑制NLRP3炎症小体的激活是通过干扰K+/P2X7R、溶酶体/Cathepsin B、NF-κB、COP-1/caspase-1等多途径发挥作用的,但对于炎症小体激活后其聚合体之间关系的变化尚不明晰,有待进一步深入。