PFOS对中华倒刺鲃幼鱼爆发游泳及运动后代谢恢复的影响
2019-03-11夏继刚李秀明付世建
夏继刚 李秀明 付世建
(重庆师范大学生命科学学院进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆 401331)
全氟辛烷磺酸(Perfluorooctane sulfonate, PFOS,C8F17SO3)是全氟化合物家族中具有代表性的一种持久性有机污染物(Persistent Organic Pollutants,POPs), 被称为“工业味精”, 由于具有疏水、疏油、耐高温等特性, PFOS被广泛应用于纺织与印染、影像材料、半导体、电镀铬雾抑制剂、皮革与塑料加工、表面活性剂、泡沫灭火剂、防护涂料以及医药品等各类产品的生产中[1—5]。PFOS在环境中难以降解、易在生物体内蓄积、毒性较强[6, 7],这些特性导致PFOS在全世界范围内的各类环境介质以及动植物体内被广泛检测出[1, 6, 8]。2009年5月,PFOS作为一种新型的POPs被增列入《斯德哥尔摩公约》。2018年1月, 我国将PFOS正式列入《中国严格限制的有毒化学品名录》。
PFOS在我国水域生态系统的污染较为严重[1, 9—12]。例如, 长江上游、嘉陵江江水以及下游三峡库区江水均存在着不同程度的PFOS污染[12],不仅如此, 在长江野生鱼体内也普遍检测出了PFOS[9]。PFOS对鱼类等水生生物健康的影响以及水生生态系统安全的潜在威胁已成为当前人们高度关注的水环境问题。
PFOS具有环境内分泌干扰作用, 可以引发遗传毒性、繁殖与发育毒性、免疫与神经毒性等[2, 8, 13, 14]。近期研究表明, PFOS还具有代谢毒性,能够导致鱼类代谢水平升高、有氧运动能力以及游泳效率下降[4, 15], 尚未见PFOS对鱼类爆发游泳能力及其相关代谢特征的影响的研究报道。爆发游泳(Burst swimming)是一种快速的高能耗游泳运动,在鱼类捕食猎物、逃避捕食者、穿越激流寻找适宜生境等生存活动中发挥重要作用[16, 17]。另一方面, 由于爆发游泳主要依赖于无氧代谢供能, 其持续的时间往往较短, 力竭运动后的代谢恢复能力将直接影响到鱼类后续的爆发游泳性能[16, 17, 18], 因此对鱼类的生存适合度至关重要。
为探究PFOS污染对鱼类爆发游泳及其代谢恢复能力的影响, 本研究以长江中上游广泛分布的中华倒刺鲃幼鱼(Spinibarbus sinensis)为对象, 考察了不同浓度PFOS暴露对该物种静止代谢率(Resting metabolic rate, RMR)、爆发游泳速度(Burst swimmingspeed,Uburst)以及运动力竭后代谢恢复特征的影响, 为评估PFOS的代谢毒性及其潜在的生态风险提供参考。
1 材料与方法
1.1 实验动物与试剂
中华倒刺鲃(Spinibarbus sinensis)幼鱼购于重庆市当地鱼市, 于实验室条件下驯养适应2周。实验用水为充分曝气脱氯并经过活性炭过滤的自来水, 水温(18.0±0.5)℃, 溶解氧>8 mg/L, 光暗周期15 L∶9 D, 饲养密度ρ<0.5 g/L, 氨氮浓度<0.02 mg/L;每日投喂1次冰冻红虫, 投喂5min后, 吸去残饵。在驯养结束后, 选取大小相近、健康活泼的中华倒刺鲃幼鱼[(2.88±0.07) g, (5.68±0.04) cm,n=60]开展实验。
PFOS(纯度>99%)购自Tokyo Kasei Kogyo Co.Ltd(Tokyo, Japan), 其余化学品购自Sigma-Aldrich(St. Louis, MO, USA)。将PFOS以二甲基亚砜(Dimethyl sulfoxide, DMSO)为助溶剂, 配置成0.5 g/mL的PFOS母液, 4℃避光保存, 待用。
1.2 实验设计
采用半静态暴露法, 暴露容器为方形玻璃缸(42 cm ×22 cm ×42 cm, 长×宽×高, 实际水量为22 L)。基于前期实验研究[4, 5]并参考实际环境中可能出现的PFOS浓度(最高可达6.57 mg/L)[19], 本实验共设5个PFOS浓度梯度组, 分别为对照组(0)、0.32、0.8、2和5 mg/L PFOS暴露组, 各组DMSO浓度不超过0.001% (v/v), 暴露时长为4周。每个浓度梯度处理随机放入驯化适应后的中华倒刺鲃幼鱼12尾(n=12)。暴露期间, 每天更换含有相应浓度PFOS的水溶液50%, 所更换的新水体均在换水前新配置, 新水体PFOS浓度与实验设置浓度保持一致。除水体含有PFOS污染物外, 其余饲养状况及水质条件与驯化期间相同。污染水体经活性炭过滤后排入污水处理系统。
在暴露结束后, 依次对实验鱼的静止代谢率(RMR), 暴发游泳速度(Uburst)以及力竭运动后的代谢恢复特征(Excess post-exercise oxygen consumption, EPOC)等进行测定, 各测定参数的样本量均为n=12。
1.3 参数测定
RMR采用流水式呼吸代谢测定仪测定RMR[20]。测定前将实验鱼禁食24h, 之后将单尾实验鱼移入呼吸室(100 mL)并使其适应24h。在适应结束后, 分别于3个时间段(10:00、14:00和18:00)使用溶氧仪(HQ30, Hach Company, Loveland, CO,USA; 测量精度为0.01 mg O2/L)检测呼吸室内环境溶氧水平的变化(每个时间段测定3次), 最后将平均值用于计算。RMR以单位时间内实验鱼的呼吸耗氧量表示, 计算公式如下:
式中, ΔO2(mg/L)为实验鱼所在呼吸室和空白呼吸室(无鱼室)出水口处溶氧水平的差值;v(L/h)为呼吸室的水流速度;m(kg)为实验鱼的体重。测试水温为(18.0±0.5)℃。为了避免水体溶氧降低可能引发的生理应激, 在整个实验过程中, 呼吸室内的溶氧水平不低于水体饱和溶氧的85%。
爆发游泳能力采用鱼类游泳代谢仪测定Uburst。该设备体积3.5 L, 横截面积19.9 cm2, 其结构与工作原理详见Li等[21], 游泳管连接计算机, 管内的水流速度由编写的程序控制。测定时, 将单尾实验鱼放入游泳管中适应1h以使其适应流水环境, 适应水流为6 cm/s(约为一倍体长/s), 测试水温为(18.0±0.5)℃。在适应结束后, 将测定仪中的水流速度以0.167 cm/s2的加速度持续增加, 直至实验鱼到达运动力竭状态, 实验鱼力竭时的水流速度即为其爆发游泳速度[16]。力竭状态的评判标准为实验鱼无力前进游泳并停留在游泳管末端筛板20s以上。将Uburst除以实验鱼体长记为相对爆发游泳速度(relativeUburst,rUburst)。
运动力竭后代谢恢复特征将运动力竭后的实验鱼立即放入流水式呼吸代谢测定仪并监测呼吸室内溶氧量的变化[22], 数据采集时间分别为实验鱼放入呼吸室前(0)以及放入后的第1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、22、24、26、28和30min。依据呼吸室内溶氧值的动态变化特征, 计算得出以下参数: (1)运动后代谢峰值, 即实验鱼在运动力竭后恢复过程中观测到的最大代谢率(Maximum metabolic rate, MMR)[mg O2/(kg·h)]; (2)代谢率增量(MMR-RMR)[mg O2/(kg·h)], 即力竭运动前后代谢率的变化量也叫代谢范围(Metabolic scope, MS); (3)代谢变化倍差(MMR/RMR), 即力竭运动前后代谢率变化的倍率(Factorial metabolic scope, F-MS); (4)力竭运动后过量氧耗(EPOC)(mg O2/kg), 即实验鱼在力竭运动后恢复过程中各个时间点高于RMR的差值在时间上的积分。

1.4 数据处理
应用软件SPSS for Windows 16.0 (SPSS Inc.,USA)对数据进行统计分析。首先对实验数据进行正态性和方差齐性检验, 然后采用单因素方差分析(ANOVA)和Tukey’s HSD法检验差异显著性。各组数据均以平均值±标准误表示, 显著性水平设在P<0.05。
2 结果
2.1 PFOS对RMR的影响
暴露浓度对实验鱼RMR的影响显著(F=5.04,P=0.002), 高浓度处理导致RMR显著升高 (表 1)。
2.2 PFOS对爆发游泳能力的影响
暴露浓度对实验鱼的Uburst和rUburst均影响显著(Uburst,F=4.92,P=0.002;rUburst,F=3.59,P=0.011),高浓度处理导致Uburst和rUburst均显著降低(图 1); 然而, 在最低剂量PFOS暴露下Uburst和rUburst亦有下降的趋势(图 1), 0.8和0.32 mg/LPFOS暴露组相比,rUburst显著升高(P=0.013), 5和0.8 mg/LPFOS暴露组相比,rUburst显著下降(P=0.002)。
2.3 PFOS对运动力竭后代谢恢复特征的影响
不同浓度PFOS处理的实验鱼在运动力竭后的代谢恢复特征见图 2, 所有处理组的代谢率都快速上升达到峰值, 随后逐步下降并逐步恢复到运动前水平。PFOS对实验鱼的MMR、MS、F-MS、EPOC均无显著影响(P>0.05)(表 1)。
3 讨论
3.1 PFOS对爆发游泳能力的影响
游泳能力作为表征鱼类达尔文适合度的重要指标, 通常被用来预测鱼类的生态表现及其栖息地的生态适宜性[23—26]。在本研究中, 高浓度(5 mg/L)PFOS暴露导致中华倒刺鲃幼鱼的Uburst和rUburst分别下降了17.4%和10.8%, 提示PFOS污染将可能对鱼类捕食——逃避捕食者、穿越激流寻找适宜生境等生存关联的生命活动起到负面影响[16, 17]。前期研究表明, PFOS可对中华倒刺鲃幼鱼的临界游泳速度[4]以及快速启动游泳能力[5]等均产生重要的负面效应, 结合本研究实验结果可以看出, 该物种的多种游泳性能均对水体PFOS污染较为敏感, 可作为PFOS污染重要的生态指示。此外, 值得关注的是, 在最低剂量PFOS暴露下Uburst和rUburst亦有下降的趋势(图 1), 表现出潜在的“低剂量效应”;PFOS对rUburst的影响还表现出一定的“非单调剂量效应”, 即随着PFOS浓度升高,rUburst表现出先降后升再降的趋势。PFOS毒理学作用的非单调剂量效应已引起研究者的较大关注[27—30]。例如, 有研究发现, 己烯雌酚(Diethylstilboestrol)对小鼠前列腺发育的影响呈现低剂量增殖高剂量抑制的“倒U形”剂量-效应关系[27]; 斑马鱼(Danio rerio)仔鱼的吻宽/体长随着PFOS暴露浓度的升高, 呈现出先下降后升高的趋势, 0.1 mg/L PFOS暴露导致斑马鱼仔鱼吻宽/体长显著下降, 而1 mg/L PFOS暴露与对照组相比无显著性差异[2]。PFOS非单调剂量-效应的作用机制尚不清楚, Welshons等[31]用“游离受体假说”解释这种毒理学作用效应, 认为这些具有环境内分泌干扰作用的污染物在较低浓度下与其相对应的游离受体发生反应, 但当其相应的受体达到饱和以后,便又有可能与其他受体发生反应或引发其他方面的生物学效应。
3.2 PFOS对RMR及运动后代谢恢复的影响
RMR为鱼体在静止并且空腹状态下的代谢率,在一定程度上反映了机体运行基本生理功能的维持能量消耗和整体生理状况, 在鱼类生理生态学研究中受到广泛关注。在本研究中, PFOS对中华倒刺鲃幼鱼的RMR影响显著, 高浓度(5 mg/L)PFOS暴露导致RMR显著升高 了25.7%, 提示遭遇污染环境下的实验鱼需要花费更多的能量用于“解毒”、机体修复以及维持内稳态[25, 32]。RMR升高可能主要与PFOS暴露致使机体糖代谢功能紊乱有关。研究发现, PFOS暴露可以抑制许氏平鲉(Sebastes schlegeli)鳃组织Na+-K+ATP酶活性并降低血糖水平[33];1 mg/L PFOS暴露即可导致杜父鱼(Cottus gobio)线粒体细胞色素c氧化酶(Cytochromecoxidase)活性降低40.2%、柠檬酸合成酶(Citrate synthase)活性显著提升19.9%, 并影响鳃组织能量代谢相关的蛋白的表达[34]。值得关注的是, 尽管RMR受PFOS暴露的影响显著, PFOS对实验鱼的MMR、MS、FMS、EPOC均无显著影响。MMR的非显著性变化提示水体PFOS污染主要是改变实验鱼能量代谢水平的
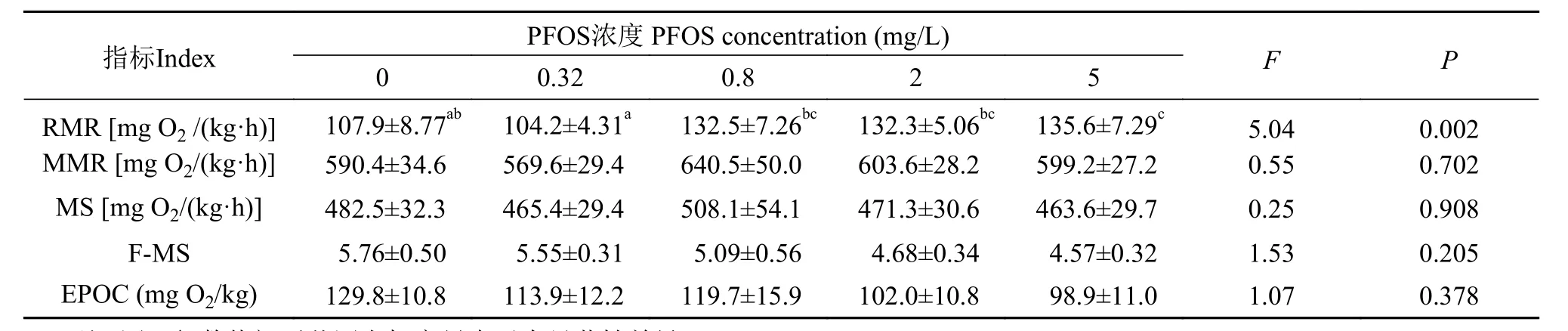
表 1 PFOS对中华倒刺鲃幼鱼RMR和力竭运动后代谢恢复的影响Tab. 1 The effects of PFOS on RMR and metabolic recovery after exhaustive swimming in juvenile Spinibarbus sinensis
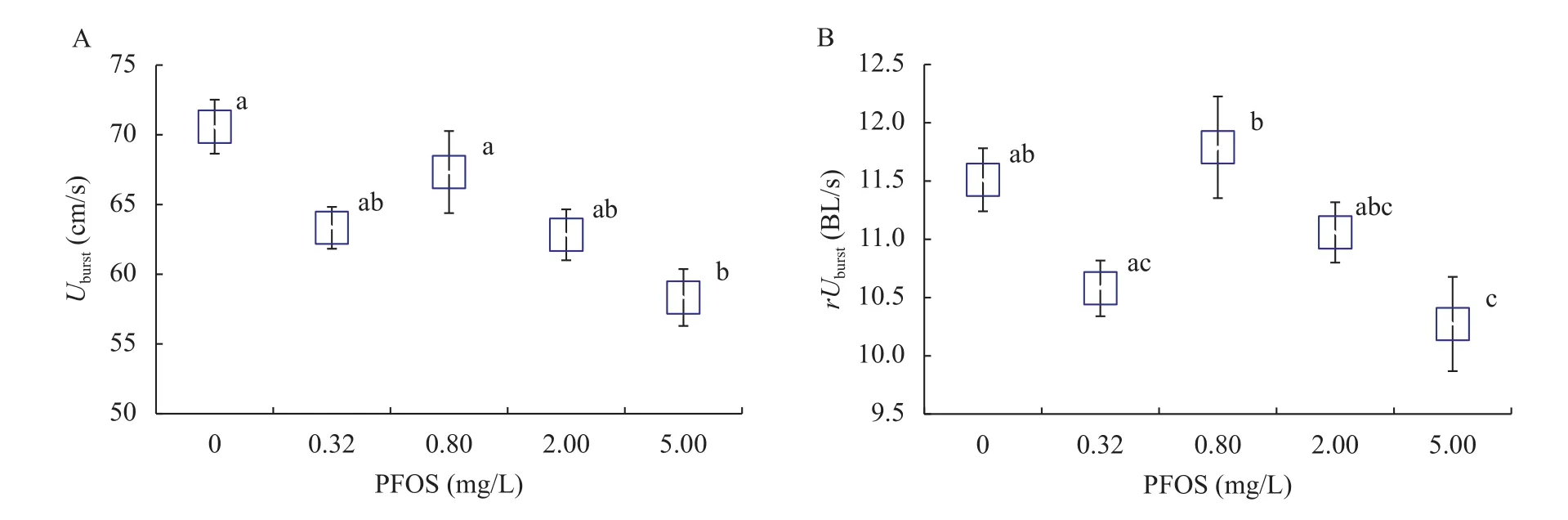
图 1 PFOS对中华倒刺鲃幼鱼爆发游泳能力的影响Fig. 1 The effects of PFOS on the Uburst (A) and rUburst (B) in juvenile Spinibarbus sinensis

图 2 不同浓度PFOS处理下实验鱼在运动力竭后的代谢恢复特征Fig. 2 Metabolic recovery after exhaustive swimming in juvenile Spinibarbus sinensis upon exposure to different PFOS concentrations
下限, 而对其能量代谢水平的上限无明显的限制性作用。MS和F-MS的非显著性变化则表明PFOS对实验鱼的代谢空间无显著影响, 研究结果与Xia等[4]一致。EPOC是动物运动后恢复期超过静止状态耗氧量水平的额外耗氧量, 体现了鱼类的无氧代谢及其代谢恢复能力; 通常EPOC越大, 鱼类的无氧代谢能力也越强[35]。力竭运动后EPOC的变化主要与鱼体白肌中能量代谢底物恢复和代谢废物的清楚速率等有关[21, 36], 在本研究中, 中华倒刺鲃幼鱼的EPOC不受PFOS暴露的影响, 提示PFOS可能对其无氧代谢关联的代谢恢复能力无显著的生态毒理效应。
