镉胁迫对东营野生大豆幼苗抗氧化系统及可溶性蛋白的影响
2019-03-11尚玉坤刘思凯陈杨晗唐学博秦宗志廖进秋
尚玉坤,刘思凯,陈杨晗,刘 鲡,唐学博,秦宗志,廖进秋
(四川农业大学生命科学学院,四川 雅安625014)
2014年四川省环保厅和国土厅联合发布《四川省土壤污染状况调查公报》[1]中指出四川省由于工业的快速发展以及农业中化肥的不合理使用,土壤环境污染状况形势严峻,攀西地区、成都平原区和川南地区等部分地区土壤重金属污染问题较突出,其中Cd是主要污染物。土壤中的Cd主要来自成土母质,含量范围一般为0.01~2 mg/kg[2]。土壤中Cd含量增加,严重威胁人们的食品安全。Cd污染地区种植水稻和小麦等农产品的Cd含量容易超标[3-4]。当Cd2+在植物体内富集到一定程度时,会影响植物体的生长,从而使植物表现出植株矮小、生长迟缓、产量下降等症状[5-7]。相关研究表明:小麦籽粒、花生幼苗和大豆中Cd含量与土壤中Cd含量呈正相关[8-9]。而大豆不同部位对Cd的吸收能力存在差异,表现为根>茎>叶>籽粒[10]。
四川省栽培大豆缺乏优良种质资源,加上无选择性的引种,经常会因为不适宜本地区的土壤和环境特征而减产,甚至绝收,给大豆相关产业造成重大经济损失[11-12]。野生大豆是大豆种质资源库中很重要的组成部分,是栽培大豆的近缘祖先种,常见的栽培大豆有些性状不能满足人们的需求,如抗逆性差。而野生大豆在长期的自然选择过程中形成了较为丰富的变异类型,如携带抗病虫害、抗旱、抗寒、耐盐碱、结荚多而密等有利基因,是栽培大豆遗传育种的重要资源,也是大豆起源、演化、生态、分类、生理等研究不可多得的育种材料,可以通过野生大豆资源进行栽培品种的遗传改良[13]。
高等植物可以耐受一定浓度的Cd胁迫,通过酶促系统降低重金属对植物细胞的损害。例如:低浓度Cd胁迫条件下,玉米幼苗可通过本身的调节机制,增强抗氧化酶活性,从而促进玉米幼苗生长,而高浓度则表现为抑制作用[14]。另外,棉花可以忍受Cd的长期毒害而不会大幅度减产,这意味着棉花具有较强的耐镉胁迫能力[15]。小麦幼苗在Cd胁迫条件下,SOD、CAT均失去活性而POD活性随处理浓度增加而增加,表明POD积极参与了胁迫条件下活性氧的清除[16]。在逆境下还可以通过可溶性蛋白渗透调节适应环境的改变,增强细胞的保水能力,对细胞的生命物质及生物膜起到保护作用[17]。但过量的Cd会通过损伤植物细胞结构、破坏酶活性、抑制根系生长、抑制水分和养分的吸收等方式抑制植物生长甚至导致死亡[18]。不同植物富集镉的能力不同[19],不同植物对镉胁迫的耐受能力差异较大[20-21],大豆是我国居民日常生活中食用油和蛋白质的主要来源,在农作物中具有较高经济价值,但是会在籽粒中积累Cd[22]。因此,研究大豆耐Cd胁迫能力,对农业生产及可持续发展具有重要意义。
野生大豆是大豆种质资源优良的基因库[23-24],不同大豆品种耐镉差异及抗镉毒害效应差异较大。例如,Cd处理条件下,综合考虑相对生物量和籽粒干重指标,桂夏豆2号、巴西3号是耐性品种。相同Cd胁迫条件下巴西10号、福豆234、华夏4号和中黄24表现出对Cd胁迫较为敏感的特征[25]。2.50 mg/L Cd胁迫条件下,湘春豆13、沔1101大豆株高及生物产量比对照组下降较少,是抗Cd胁迫能力较强的品种[26]。尽管如此,仍有很多优良基因还未被发掘。因此,对野生大豆进行研究,对合理的利用和保护野大豆基因资源具有非常重要的意义[27]。本试验采用的野生大豆采自山东省东营市的盐碱地,生存环境恶劣。为评价该野生大豆种质资源的耐镉能力,通过在不同浓度Cd胁迫条件下,对野生大豆的抗氧化酶(SOD、POD、CAT)活性、丙二醛(MDA)及可溶性蛋白(soluble protein)含量的变化情况进行测定,以期为四川地区镉污染土壤栽培大豆的安全生产提供优质的种质资源。
1 材料和方法
1.1 试验材料
试验材料为山东东营(东经118°5',北纬38°15')野生大豆。
1.2 试验方法
挑选饱满、成熟度一致的东营野生大豆种子,用砂纸摩擦破皮后,用0.1%的HgCl2溶液消毒10 min,用去离子水反复冲洗,再将种子放入去离子水中于25℃恒温培养箱中浸种12 h。然后播种于标准大培养皿,每个培养皿播种50颗,置于光照培养箱(MLR-352H-PC,日本松下)(光照14 h,温度25.0℃,黑暗10 h,温度20.0℃、湿度65%)至展开一对子叶。挑选长势一致的幼苗移栽至装满蛭石的圆柱形塑料桶(直径28 cm、深17 cm)中,每桶4株于植物培养室进行培养,光照强度350μmol/(m2·s),光照时间12 h;昼、夜温度分别为25.0℃和20.0℃;相对湿度65%~70%。利用营养液1/2 Hoagland配制Cd2+处理溶液:0、0.25、0.5、1.0、2.0、4.0、8.0、16.0 mg/L。每3天定期向每桶注入500 mL的Cd2+处理溶液,每个浓度处理3次重复。在Cd胁迫处理45天时开始收集样品,之后每隔7天收集一次样品,连续收集4 w。采集东营野生大豆顶端倒数第5、6、7片长势一致的叶片,去叶脉后约0.5 g,进行相应指标的测定。
1.3 测定方法
每个处理取0.5 g新鲜叶片于预冷的研钵中,加2 mL磷酸缓冲液研磨成浆,加缓冲液使终体积为10 mL,于10 000 r/min下离心10 min,上清液即为提取液,4℃下保存备用。
SOD活性测定采用氮蓝四唑光化还原法[28],以抑制NBT光还原的50%为1个酶活性单位(U/min·g)。POD活性测定采用愈创木酚法[29],以每分钟内A470变化0.1为1个酶活性单位(U/min·g)。SOD和POD均采用可见光分光光度计(日本,岛津,UV-1760)检测。
CAT活性测定采用紫外吸收法[30],以每分钟内A240减少0.1为1个酶活单位(U/min·g)。可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[31]。丙二醛含量测定采用硫代巴比妥酸(TBA)法[32],称取不同处理浓度的野生大豆鲜叶1 g于预冷的研钵中,加入2mL 10%TCA研磨至匀浆,再加8mL TCA进一步研磨,于4 000 r/min离心10 min,上清为样品。4℃下保存备用。以上数据均采用双光束紫外可见分光光度计(A560型,翱艺,UTA13L0006)进行测定。
1.4 数据统计方法
采用Microsoft Excel 2010整理试验数据,用Origin 9进行数据统计处理及图表制作,用SPSS 17.0软件进行单因素方差分析,采取Duncan's multiple angetest法进行显著性检验(P<0.05)。
2 结果与分析
2.1 Cd胁迫对野生大豆叶片抗氧化酶活性的影响
当用Cd处理浓度分别为0.5、2.0、4.0和8.0 mg/L的营养液处理幼苗第45天时,野生大豆SOD活性显著增加了12.7%,43.3%、49.0%、49.7%。当Cd浓度为1.0、2.0、4.0和8.0 mg/L处理幼苗第52天时,SOD活性显著增加了10.5%、43.1%、46.7%、45.2%。当Cd浓度为0.5、1.0、2.0、4.0和8.0 mg/L处理幼苗第59天时,SOD活性显著增加了11.6%、16.0%、56.5%、62.1%、57.1%。当Cd浓度为0.5、1.0、2.0、4.0和8.0 mg/L处理幼苗第66天时,SOD活性显著增加了12.7%、17.1%、46.9%、49.8%、41.7%。当Cd胁迫浓度为16.0 mg/L时,野生大豆各个处理时间段的SOD活性相比于对照分别显著性降低了20.7%、14.7%、17.3%、26.2%。在不同浓度Cd处理条件下,随着处理时间的延长SOD活性均呈显著性增加的趋势(见表1)。
当用含Cd浓度为4.0 mg/L的营养液处理幼苗第45天时,POD的活性显著增加了31.2%;当用含Cd浓度为2.0、8.0 mg/L的营养液处理幼苗第66天时,POD的活性显著降低了27.3%,24.8%。当Cd胁迫浓度为16.0 mg/L时,野生大豆各个处理时间段的POD活性相比于对照分别显著性降低了30.0%、44.2%、53.3%、44.5%。随着胁迫时间延长,当Cd处理浓度为1.0 mg/L时,POD的活性相比于对照有显著性增加,而当Cd处理浓度分别为0.25、0.5、8.0、16.0 mg/L时,POD的活性相比于对照都没有显著性变化(见表2)。
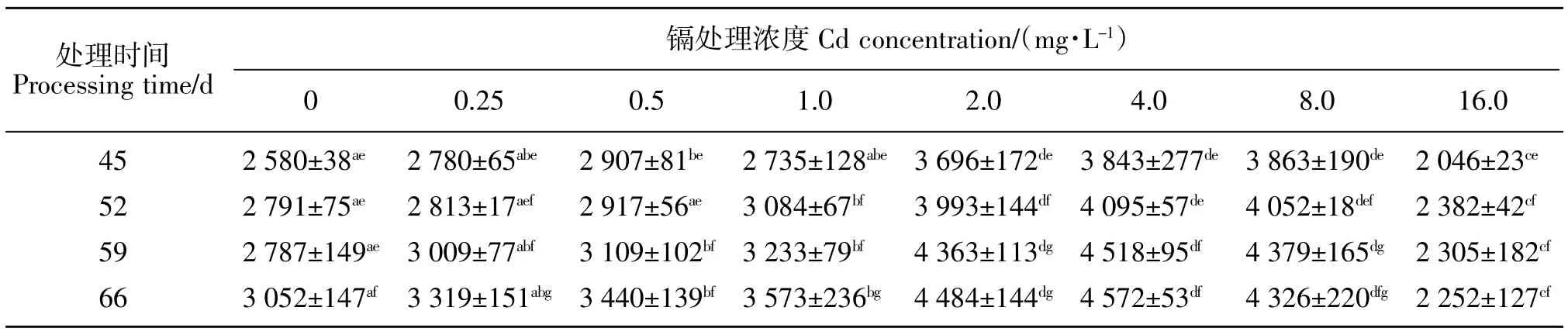
表1 不同浓度镉胁迫下野生大豆叶片SOD活性Table 1 SOD activities of wild soybean under Cd stress U·min-1·g-1

表2 不同浓度镉胁迫下野生大豆叶片POD活性Table 2 POD activities of wild soybean under Cd stress U·min-1·g-1
当用Cd浓度为1.0、2.0、4.0和8.0mg/L的营养液处理幼苗第45天时,CAT活性显著增加了50.3%、41.2%、93.9%、77.6%。当用Cd浓度为0.5、1.0、2.0、4.0、8.0 mg/L的营养液处理幼苗第52天时,CAT活性显著增加了28.0%、42.9%、77.4%、93.5%、89.3%;当用Cd浓度为0.5、1.0、2.0、4.0、8.0 mg/L的营养液处理幼苗第59天时,CAT活性显著增加了31.5%,41.5%、72.5%、81.5%、4.5%。当用Cd浓度为1.0、2.0、4.0、8.0 mg/L的营养液处理幼苗第66天时,CAT活性显著增加了26.8%、24.7%、46.8%、46.8%,而当Cd浓度为16.0 mg/L时,CAT活性显著降低了13.6%。当Cd处理浓度为16.0 mg/L时,随处理时间的延长CAT活性呈先显著降低再显著增加的趋势,而其他处理浓度则呈显著性增加的趋势,如表3所示。
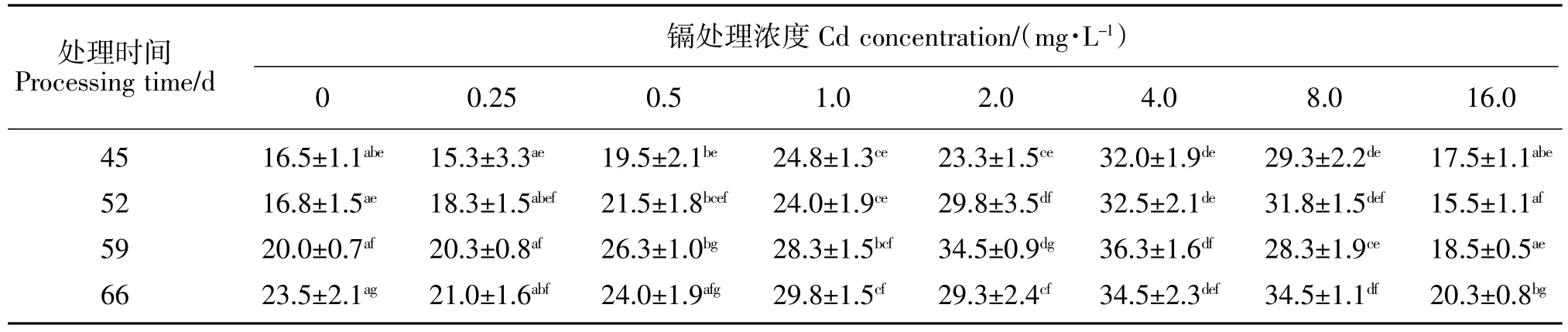
表3 不同浓度镉胁迫下野生大豆CAT活性Table 3 CAT activities of wild soybean under Cd stress U·min-1·g-1
2.2 Cd2+对野生大豆叶片丙二醛含量的影响
当用Cd浓度为8.0和16.0 mg/L的营养液处理幼苗第45天时,MDA含量显著增加了21.8%、37.1%。当用Cd浓度为1.0、2.0、8.0和16.0 mg/L的营养液处理幼苗第52天时,MDA含量显著增加了6.5%、9.5%、14.9%、18.5%。当用Cd浓度为4.0、8.0和16.0 mg/L营养液处理幼苗第59天时,MDA含量显著增加了16.4%、22.2%、31.6 %;当用Cd浓度为4.0、8.0和16.0 mg/L的营养液处理幼苗第66天时,MDA含量显著增加了18.2%、22.2%、48.3%,而当Cd处理浓度为0.25和0.5 mg/L时,MDA含量显著降低了10.2%、9.7%(见图1A)。当Cd处理浓度为0、4.0 mg/L时,随处理时间的延长MDA含量呈显著增加的趋势。当Cd处理浓度为0.25、0.5 mg/L时,随处理时间的延长MDA含量呈显著降低的趋势。当Cd处理浓度为1.0 mg/L时,随处理时间的延长MDA含量呈先显著增加后显著降低的趋势。当Cd浓度为16.0 mg/L时,随处理时间的延长MDA含量呈先显著降低后显著增加的趋势(见图1B)。
2.3 Cd2+对野生大豆叶片可溶性蛋白含量的影响
当用Cd浓度为4.0 mg/L的营养液处理幼苗第45天时,可溶性蛋白含量显著增加了76.2%,而Cd处理浓度为0.5和16.0 mg/L时,可溶性蛋白含量显著降低了4.8%、11.9%。当用Cd浓度为1.0、2.0和4.0 mg/L的营养液处理幼苗第52天时,可溶性蛋白含量显著增加了23.5%、28.4%、64.2%,而Cd处理浓度为16.0 mg/L时,可溶性蛋白含量显著降低了16.0%。当用Cd浓度为1.0、2.0、4.0和8.0 mg/L的营养液处理幼苗第59天时,可溶性蛋白含量显著增加了26.0%、27.3%、92.2%、18.2%。当用Cd浓度为1.0、2.0、4.0和8.0 mg/L的营养液处理幼苗第66天时,可溶性蛋白含量显著增加了15.9%、14.6%、84.1%、13.4%(见图2A)。当Cd处理浓度大于等于1.0 mg/L时,随处理时间的延长可溶性蛋白含量没有显著性变化。当Cd处理浓度为0和0.25 mg/L时,随处理时间的延长可溶性蛋白含量呈显著性降低的趋势(见图2B)。
3 讨论与结论
Cd是植物的非必需元素,土壤或水体中过量的Cd被植物吸收后会对植物产生一系列的毒害作用[33]。正常情况下植物体内活性氧的产生和清除处于动态平衡,不会影响植物正常生长。受Cd2+胁迫后,活性氧在植物体内的动态平衡被破坏,导致植物体的自由基代谢失衡,产生诸如O2-(超氧阴离子)和H2O2等大量活性氧[34]。O2-和H2O2的积累能够氧化生物分子,打破活性氧代谢平衡导致膜脂过氧化进而破坏细胞膜的结构和功能。丙二醛则是膜脂过氧化作用的最终产物,它的积累能够反映植物体内自由基的活动状态,其含量越高反应植物膜脂过氧化程度越高[35]。本研究中,随着Cd处理浓度的增加,MDA的含量呈显著增加的趋势,表明野生大豆植物体内活性氧大量积累,并激活了植物体内的抗氧化系统,诱导抗氧化酶活性发生了改变[36-37]。
SOD、POD和CAT是植物体内存在的一组有效清除细胞内活性氧的抗氧化酶系统。SOD、POD、CAT这3种酶活性峰值所对应的处理时间和浓度不同,说明它们通过不同的耐胁迫机理共同协作清除植物体内氧化物,减轻不利的生长条件下带来的氧化伤害[38]。SOD能够催化O2-转化为H2O2,POD和CAT能够将H2O2分解为无毒的水,三者共同作用能够在一定程度上缓解或防御镉胁迫的伤害,对保护细胞膜的完整性和防御活性氧对细胞膜的伤害有重要作用[39-40]。本试验中,当Cd浓度小于等于8.0 mg/L时,SOD、CAT活性升高,这与棉花、拟南芥等作物在Cd2+胁迫下的反应一致[41-42]。尽管在该浓度范围内MDA含量增加,但受SOD、POD、CAT的保护作用,降低了植物受到的过氧化损伤。在东营野生大豆抗氧化酶系统中可能主要由SOD和CAT清除活性氧带来的伤害,POD起辅助作用,此调节机制能使植物适应并抵抗一定程度的伤害。

图1 镉胁迫下野生大豆的MDA含量Figure 1 The MDA content of wild soybean under Cd stress
重金属离子进入植物体后,与其他化合物结合成金属络合物或螯合物,抑制植物各种代谢活动尤其是蛋白质的合成。因此,可溶性蛋白质含量是衡量植物是否发生重金属胁迫的重要指标[43]。低浓度的Cd溶液会导致可溶性蛋白含量增加,而可溶蛋白质含量的提高很可能是植物抵抗镉毒害的一种解毒机制,例如镉能诱导产生镉结合蛋白,而降低镉的毒性。可溶蛋白质含量的提高,还会增加细胞渗透浓度和功能蛋白的数量,有助于维持细胞正常代谢[44]。本研究中,当Cd浓度小于等于8.0 mg/L时,可溶性蛋白含量呈显著增加的趋势,表明东营野生大豆缓解了Cd胁迫带来的不利影响,降低了Cd胁迫带来的危害。
当Cd处理浓度为16.0 mg/L时,SOD、POD、CAT活性显著低于对照,MDA含量升高,可溶性蛋白含量降低,说明在此浓度处理下植物体内的活性氧代谢平衡被打破,活性氧自由基大量产生导致细胞膜脂过氧化加剧,野生大豆的抗氧化系统已经受到损伤[45-46]。高浓度Cd会加速原有蛋白质的分解以及破坏合成蛋白质的细胞器抑制蛋白质合成从而对细胞产生毒害作用[47]。在该浓度条件下,可溶性蛋白含量显著降低表明野生大豆中Cd进入细胞后很可能促进了蛋白水解酶的活性,加强了原有蛋白质分解,或者使蛋白质合成的相关细胞器受到损伤,抑制了新蛋白的合成[48]。本研究结果表明,当Cd处理浓度为16.0 mg/L时,野生大豆无法通过自身调节抵消Cd胁迫带来的危害,生长明显受到抑制。

图2 镉胁迫下野生大豆的可溶性蛋白含量Figure 2 The soluble protein content of wild soybean under Cd stress
综上所述,当Cd胁迫浓度小于等于8.0 mg/L时,野生大豆植株通过激活抗氧化酶系统以及可溶性蛋白含量的变化防御不同浓度镉胁迫带来的氧化伤害,减轻或缓解镉胁迫带来的不利影响,东营野生大豆能正常生长。东营野生大豆为抗Cd能力较强的种质资源。利用东营野生大豆优良基因资源,可丰富生产实践过程中的大豆基因库,为四川地区栽培大豆在镉污染地区的安全生产提供种质资源。
