Ⅱ级生物安全柜“三个保护”现场实验方法探究
2019-03-09王会如王霖战玢北京市医疗器械检验所北京101111
王会如 王霖 战玢 北京市医疗器械检验所 (北京 101111)
内容提要: 为保证使用人员、实验样品及环境不被污染,在进一步验证安全柜的生物防护性能的同时,探究出更适用于现场检验的实验方法。通过微生物法和碘化钾法的对比研究,针对产品和交叉污染保护的碘化钾实验方法进行探究。
近年来,SARS、H5N1、H7N9等传染性极高的呼吸道流行性疾病的相继出现极大地威胁了人类的生命安全。Ⅱ级生物安全柜(以下简称安全柜)作为实验室中常用的一级防护屏障,承接许多高风险、高危害、高致病性的实验任务,被大量地运用于医疗卫生机构、疾病预防与控制机构、研究院和相关医疗科研单位。因多数使用单位实验条件恶劣,实验对人员的风险,样品易污染等原因,安全柜的物理性能检测已满足不了使用单位要求,更多单位提出需要进行人员、产品和交叉污染保护现场实验。
1.微生物法与碘化钾法的概述
微生物法是将已经配制完成的不同浓度枯草芽孢杆菌菌液以喷雾器主动释放,由碰撞采样器和狭缝采样器进行收集,磷酸盐缓冲液和营养琼脂培养皿充当载体的方式,对安全柜人员、产品和交叉污染保护进行检测的实验方法。作为0569-2011的仲裁检验方法以及NSF49中唯一承认的检验方法,微生物法科学、准确、有效。碘化钾法是通过上游释放碘化钾微粒气溶胶,下游经空气采样器进行采样,采样器内置锥形头及过滤膜,锥形头用以使空气与碘化钾微粒分离后落在滤膜上。
采样结束后将滤膜浸入氯化钯试剂中,最后通过放大镜观察过滤膜上被捕捉到的碘化钾微粒数来计算“保护因子值”。
微生物法和碘化钾法的实验原理不尽相同,但又各具利弊。微生物法作为一直沿用的实验方法,能够更加全面的验证安全柜的“三个保护”性能,但此种方法对于实验环境、实验周期、实验操作性以及实验废弃物的后期处理要求严格。碘化钾法作为一种化学检验方法,受外界环境干扰较小,便捷有效,并能够短时间呈现实验结果,但目前此种方法只局限于检测安全柜的人员保护,并未涉及产品和交叉污染保护的检测。故通过微生物法和碘化钾法的对比研究,针对产品和交叉污染保护的碘化钾实验方法进行分析,进而探究出更适用于现场检验的实验方法。
2.人员保护
2.1 微生物法
微生物法是经上游喷雾器释放(1×108~8×108)/mL的枯草芽孢菌芽孢,下游由撞击式采样器和狭缝采样器进行收集[1]。撞击采样器和狭缝采样器中分别放置磷酸盐缓冲液和营养琼脂培养皿,重复实验三次。实验结束后,对磷酸盐缓冲液进行抽滤处理,并将“带菌”滤纸和狭缝采样器中的营养琼脂培养皿进行微生物培养,48h后观察菌落数是否符合要求,以判定实验结果(见图1)。

图1.微生物现场操作
人员保护(微生物法)判断标准:全部撞击式采样器收集的枯草芽孢菌菌落形成单位(CFU)数量应不超过10[1]。狭缝采样器培养皿中枯草芽孢杆菌计数应不超过5CFU,对照培养皿应呈阳性(>300CFU)人员保护(微生物法)特点:喷雾器与采集器之间有隔离(安全柜气幕及移窗),喷雾器释放一定浓度的“菌雾”,采样器收集“带菌”空气;抽滤收集的空气并进行48h微生物培养,菌落计数用以判定结果,枯草芽孢杆菌与环境菌难以用肉眼进行区分,并且实验周期较长;枯草芽孢菌不易灭活,易生长,具有极高的指示作用,但会对实验环境造成一定程度污染(见表1)。
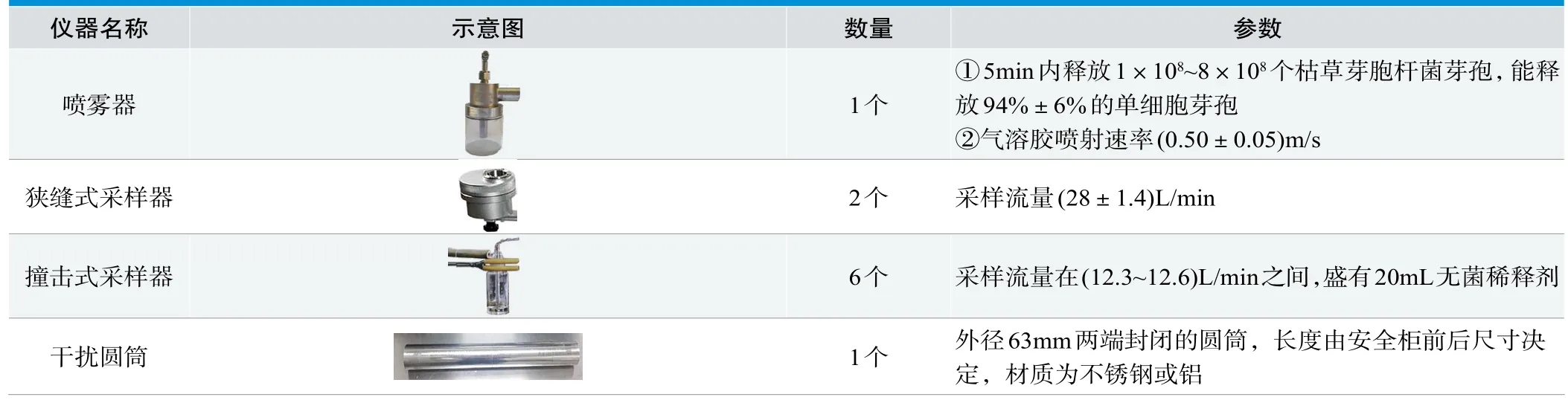
表1.微生物法检测仪器
2.2 碘化钾法
碘化钾法是经上游气溶胶发生器的涡流盘和喷嘴高速喷射碘化钾微粒气溶胶,下游通过空气采样器抽气采样,采样头内置锥形头及过滤膜,锥形头能够将比空气重的微粒沿直线通道沉积在底部的过滤膜上,实验结束后将过滤膜与氯化钯溶液充分反应,最后通过放大镜观察过滤膜上被捕捉到的碘化钾微粒数来计算“保护因子值”是否达到要求(见图2)。

图2.碘化钾法现场操作
人员保护(碘化钾法)判定标准:用公式(1)计算释放的KI粒子数N:

式中:V是气溶胶发生器分散的KI溶液的体积,单位以mL表示;3.1×107是由液滴尺寸、采样流量和涡流盘转速导出的一个常数。
用公式(2)计算由每个过滤膜得到的开口保护因子值Apf:

式中:F是采样流量,单位以L/min表示;n是过滤膜上的斑点数。
其中V=20mL,F=100L/min,保护系数Apf=6.2×106/n。碘化钾法的判定标准实则计算前窗操作口的保护因子Apf≥1×105,并可推算出过滤膜上的斑点数不能超过62个[1]。
人员保护(碘化钾法)特点:喷雾器与采集器之间有隔离(安全柜气幕及移窗),气溶胶发生器喷射15g/L碘化钾乙醇溶液,空气采样器采样空气中的碘化钾微粒;采样结束后,过滤膜与氯化钯溶液进行化学反应,并在去离子水中清洗,短时间呈现实验结果;碘化钾法对人体及环境影响较小,避免了对实验环境的污染(见表2)。
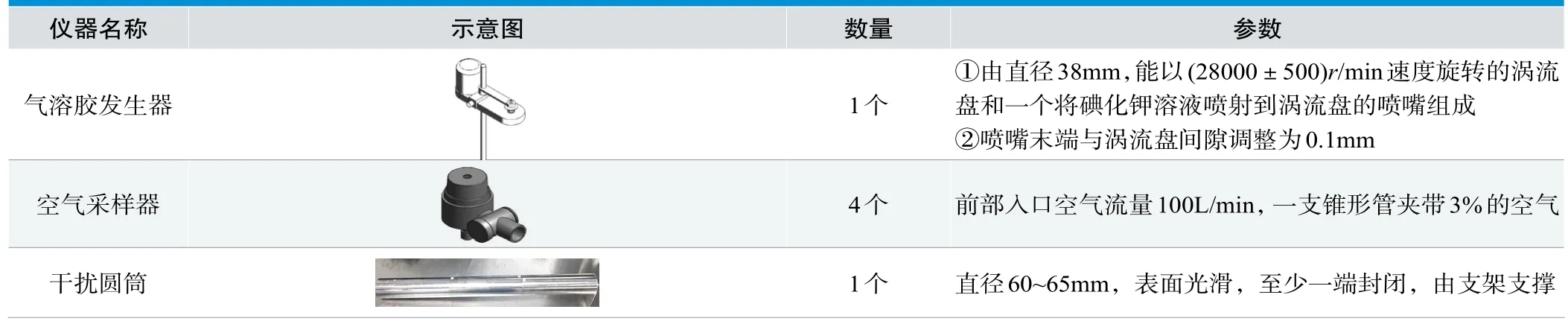
表2.碘化钾法检测仪器
2.3 微生物法与碘化钾法的对比分析
安全柜YY 0569-2011行业标准中规定,人员保护可以选择微生物法和碘化钾法进行实验。根据表3对比分析得出,人员保护的碘化钾法和微生物法,无论从测试方法还是实验原理,具有等效性,可以作为在用安全柜现场实验的替代方法。

表3.人员保护-微生物法与碘化钾法对比分析
3.产品保护
3.1 微生物法
由于安全柜产品保护实验微生物法是判断其实验结果的唯一方法,所以在分析碘化钾法是否具有可替代性之前,先要了解产品保护的实验方法、原理及特点。产品保护实验是为验证前窗气幕对外界污染物的屏蔽作用,避免内部实验样品受到外界环境的污染(见图3)。

图3.产品保护现场操作
如图3所示,将盛有55mL浓度为(1×106~8×106)/mL芽孢悬浮液的喷雾器放在安全柜外,喷雾器喷射轴在安全柜中心并与前窗操作口上沿平齐,喷雾器的喷嘴前端位于前窗操作口外100mm,喷雾方向平行于台面,正对前窗操作口处进行喷雾。柜内放置大量的培养皿,用于采样进入到安全柜内,并随气流沉降在培养皿上的芽孢。微生物培养(48h)后,观察并计算培养皿中的菌落数,从而得到“污染”物的污染程度及数量分布情况。
产品保护的判定标准:用1×106~8×106枯草芽孢菌进行实验5min后,在培养皿上的枯草芽孢杆菌芽孢应不超过5CFU,对照培养基呈阳性,重复实验三次均符合要求[1]。
产品保护的特点:喷雾器从安全柜外释放芽孢悬浮液,由操作台上摆放的琼脂培养皿作为载体进行采样,喷雾器与载体之间通过气幕及移窗进行物理隔离;产品保护是随安全柜内部气流自然沉降的方式进行采样,不涉及撞击采样器、空气采样器等自动采样仪器;需经48h微生物培养,方可判定结果;每次实验结束,用酒精或消毒液对安全柜柜体进行反复擦拭,避免影响下组实验结果。
3.2 碘化钾法
模拟产品保护微生物法的实验原理及方法,将碘化钾气溶胶发生器与空气采样器按照微生物法的实验方式摆放,如下图4~6所示,重复实验3次,保护因子不小于1×105。是否能达到与微生物法相同的效果还需进一步探究和分析。根据表4,显然在产品保护实验中,碘化钾法与微生物法在“采样方式”和“采样面积”上有所不同。仔细分析却能得出两者之间的“等同”性。
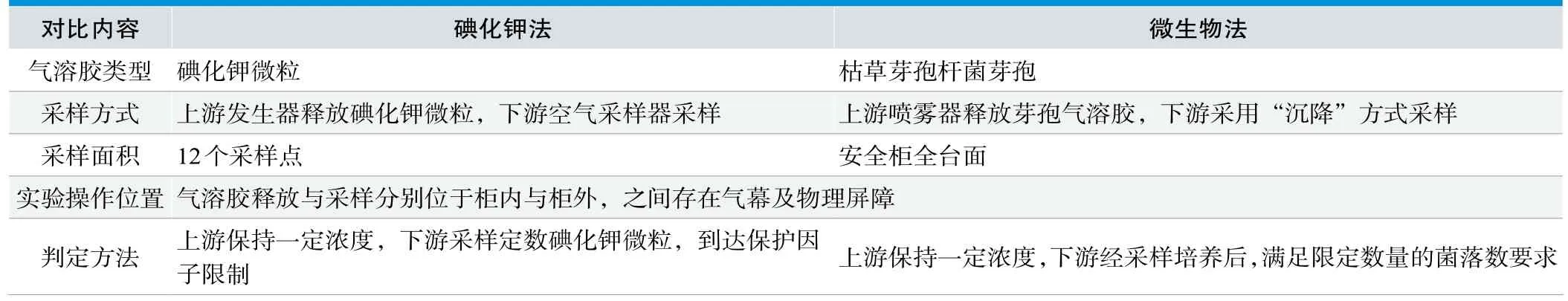
表4.产品保护实验中碘化钾法与微生物法对比分析
采样方式上分析:在微生物法中,如果有“污染因子”进入安全柜中,在安全柜气流的作用下,通过沉降的方式落在培养皿中,最终在实验结果中被“读出”。
其测试方法是典型的悬浮粒子沉降菌测试法。碘化钾法则是,如果有“污染因子”进入安全柜中,被空气采样器“捕获”,所采集到的微粒是“悬浮”在空气中,其测试方式类似浮游菌测试法。
从微粒沉降的角度上看,当其不受气流影响时的重力、惯性力和扩散三种作用力,自身运行的速度和距离是很微小的;而在运动的气流中,小微粒几乎以完全相同的速度跟随气流运动(见文献[2],6-6章节,气流支微粒运动的影响内容)。假设安全柜的送风气流流速在0.30m/s,安全柜内腔高度在0.65m左右,则不到3s的时间就会被台面上的培养皿捕获。空间中采集到的悬浮粒子基本上百分百会被气流引导而“沉降”。所以“浮游”采样一定程度可以反映“沉降”状况。

图4.对比实验操作图
根据文献[2],9-6章节,沉降菌和浮游菌关系中论述,前苏联的奥梅梁斯基公式是普遍采用的换算沉降菌与浮游菌关系的公式,该公式表示,在100cm2培养基上沉降5min所得细菌数量,与10L空气中的浮游含菌量相同。其中10L为校正值,用公式表示即:

式中:Ng——菌浓(个/L);NL——在100cm2培养基上沉降5min后的菌落数(个);10——校正值。
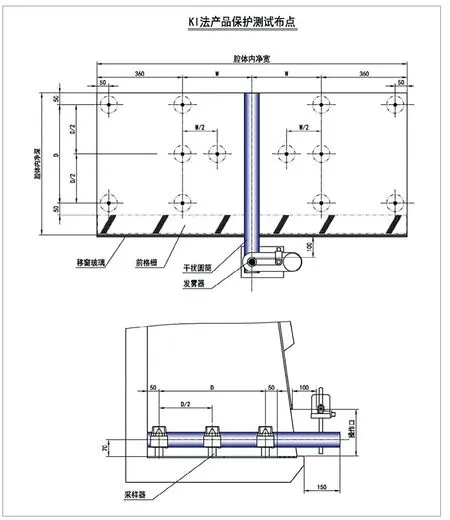
图5.碘化钾法布点位置
(3-2)式说明了浮游与沉降采样之间关系密切,一定程度上可以换算。此公式属于普遍性公式,通过大量实验比对,校正值“10”在不同条件下均要有所变化。一般规律是干净场所校正值较小,一般3~5,在恶劣条件下,可能会大于30。在安全柜内,空气洁净,且气流均匀,从微粒更容易沿气流运行的状态上看,其校值应取小值。
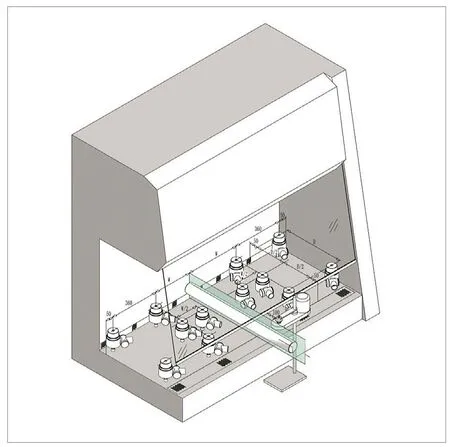
图6.空气采样器摆放位置
产生多个校正值的原因主要是(3-2)式所表达的沉降量一般公式是一个惯用的公式,在文献[2]中提到,可以用文献中(6-32)式计算校正值。
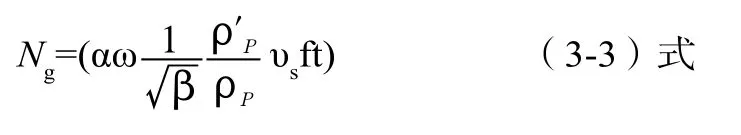
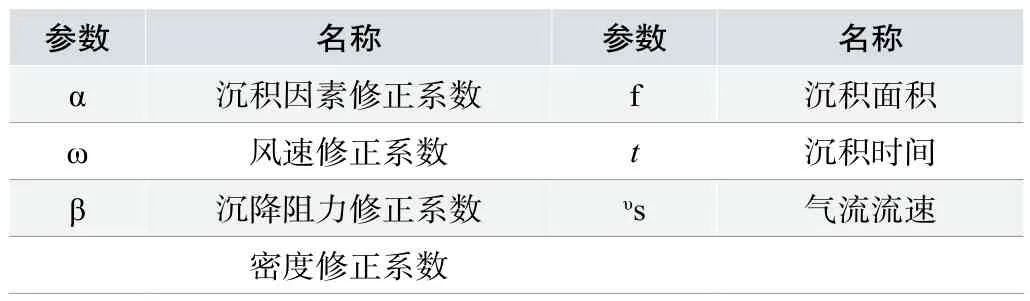
参数 名称 参数 名称α 沉积因素修正系数 f 沉积面积ω风速修正系数 t 沉积时间β 沉降阻力修正系数 υs 气流流速密度修正系数
当采用平皿测浮游菌时,可采用下面公式[3]:

式中:Nm——浮游菌浓度(个/m3);C——平均每个φ90平皿菌落(个);X——校正值,X取3;A——个沉降平皿的单位面积(cm2);T——沉降时间(min)。
例:产品保护使用φ90培养皿50个计,菌落数为5个,则5min沉降相当的浮游菌浓度为
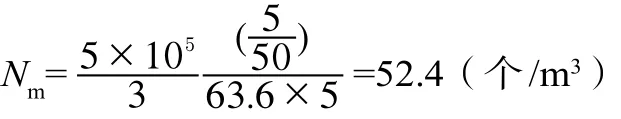
采样面积上分析:从(3-4)式看,在采样面积上完全可以通过平皿的数量来进行换算。但受到采样器数量的影响,所采集的样本空气是不是能代表柜内的“污染”情况,即涉及到采样量的确定更有关采样点的布置。这些均需要大量的实验进行论证。
采用碘化钾法替代微生物法进行产品保护实验,必须解决以下问题:①碘化钾气溶胶发生发“雾”量与生物喷雾器发“雾”量之间的换算。显然在生物实验中采用的是106级数的“菌雾”,碘化钾法是108级数“微粒雾”,这就势必要调整气溶胶发生器的参数。②结果判定时,“显影”斑点与沉降菌采样菌落数之间的关系确定。这影响至碘化钾空气采样量的重新设定等因素。通过分析,采用浮游菌采样的方法是有可能替代沉降法,但一定要解决采样量、采样布点、计算与实际值的修正等问题。那么使用碘化钾法的替代性也变成了可能。但有些换算关系、参数设定很难推导的话,则必须有大量的实验数据来支撑验证其可靠性。
4.交叉污染保护
4.1 微生物法
交叉污染保护一方面避免因安全柜操作人员的动作干扰而引起安全柜内样品之间交叉污染的测试,另一方面也是防止安全柜操作区域内左右两侧污染物进入中央操作区,污染实验样品。如图7所示,喷雾器放置于安全柜内紧靠侧壁处进行喷雾,柜内距侧壁360mm处放置培养皿作为阳性对照,360mm处放置培养皿进行采样。通过48h微生物培养,计数培养皿中的菌落数,从而得到“污染”物的污染程度及数量分布情况。

图7.交叉污染现场操作
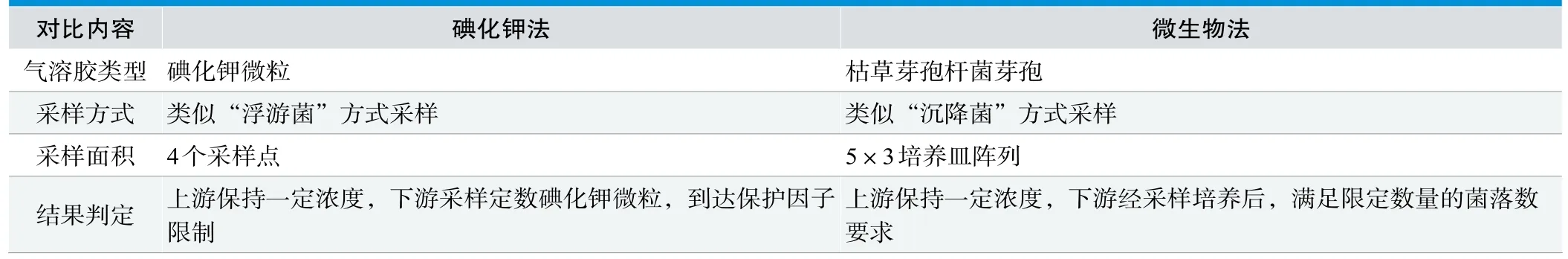
表5.交叉污染实验中碘化钾法与微生物法对比分析

图8.对比实验操作图
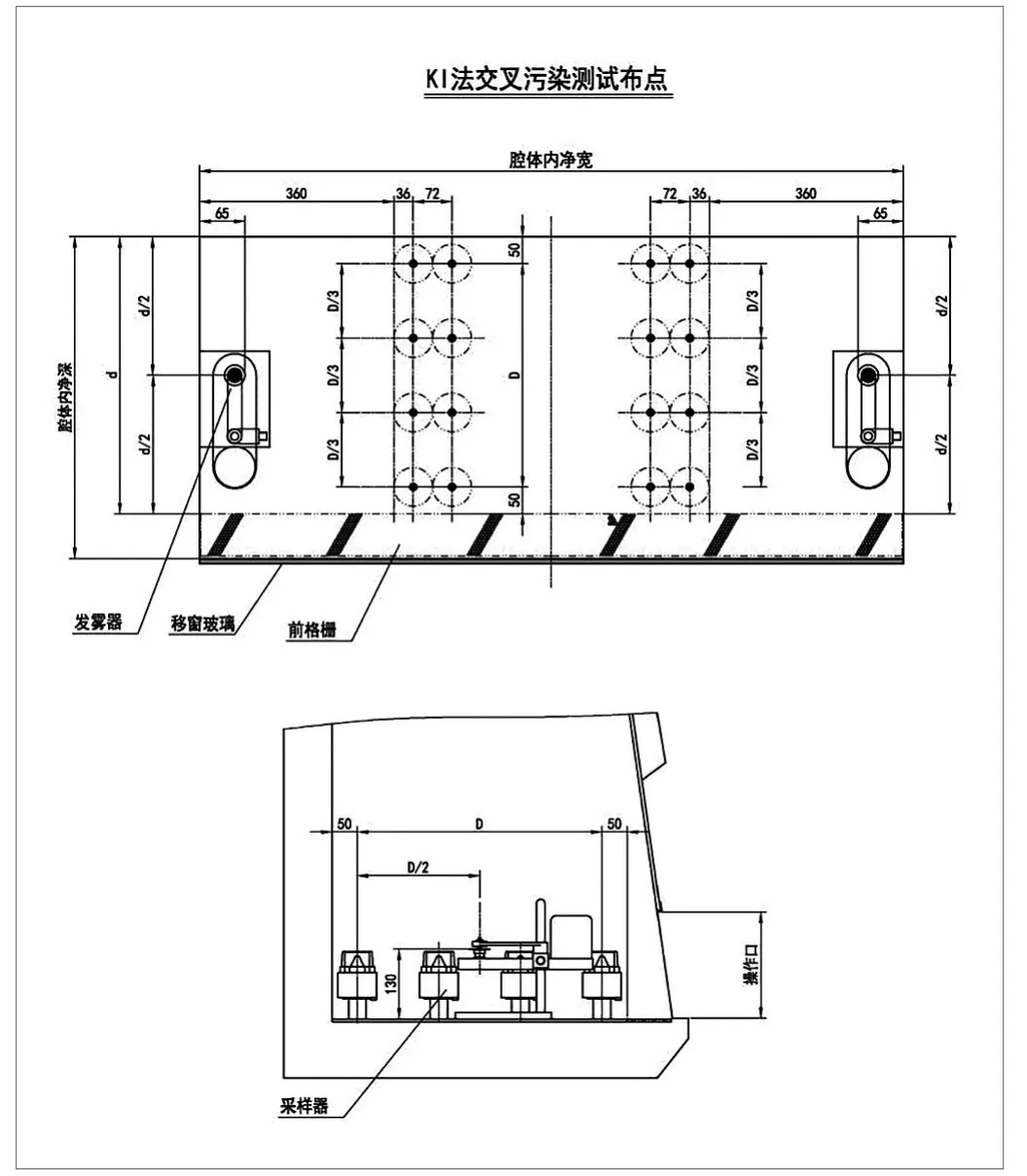
图9.碘化钾法布点位置图
交叉污染的判定标准:用(1×104~8×104)/mL枯草芽孢菌进行实验,左右两侧距被检侧壁360mm外在培养皿上的枯草芽孢菌落数均应不超过2CFU。
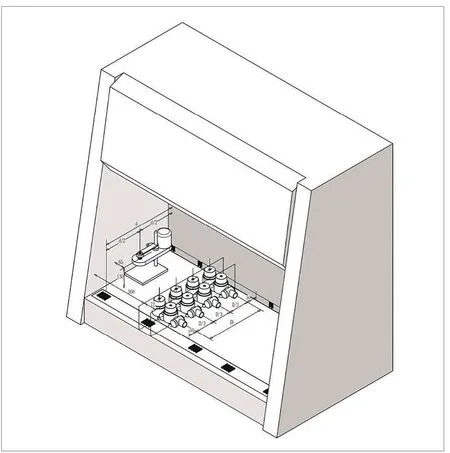
图10.空气采样器摆放位置
4.2 碘化钾法
模拟交叉污染保护微生物法的实验原理及方法,将碘化钾气溶胶发生器与空气采样器按照微生物法的实验方式摆放,如下图8~10所示,左右两侧重复实验三次,保护因子不小于1×105。是否能达到与微生物法相同的效果还需进一步探究和分析。
从表5看,如果按3.2分析内容,碘化钾法解决了“浮游”与“沉降”之间问题,完全有可能替代微生物法。可事实并非如此。人员保护、产品保护实验中,发尘单元(气溶胶发生器、喷雾器)与采样单元(空气采样头,培养皿)分别位于柜内与柜外,之间存在气动及物理屏障,即上游气流的波动对下流采样结果基本没有影响。根据本文3.2内容中关于微粒由“浮游”到“沉降”状态的分析中,微粒更易受到影响而随气流运动,在没有气流干扰的情况上,“浮游”微粒会顺利“沉降”。然而在交叉污染实验中,由于发“雾”与采样均处于同一区域,且距离较近,采样的抽吸作用会直接影响下降气流的流型,当下降气流流型被破坏,就直接破坏了“沉降”的可信度。空气采样气的“主动”抽气,会使气溶胶发生器发出的高浓度微粒被诱导抽入,便很难判定结果的真实有效性。
5.小结
为了寻求一种更为便捷、精准、科学的安全柜“三个保护”现场实验方法,分别对微生物法与碘化钾法进行论述,再将两种方法进行对比分析。碘化钾法在人员保护实验中有着实验操作方便,短时间呈现实验结果,对外界环境影响小的优点。基于它的优点,对碘化钾法在产品保护与交叉污染保护实验中的应用性进行了探索性分析。在产品保护方面是有可能发挥其特长优势。但交叉污染保护实验的可行性存在很大的问题,还需进一步探究。
