提高冶炼副产品硫酸铜主品位的生产实践
2019-03-08王有维罗劲松杨小陆曾文斌
王有维, 罗劲松, 杨小陆, 曾文斌, 钟 忠
(云南铜业股份有限公司西南铜业分公司电解分厂, 云南 昆明 650102)
0 引言
硫酸铜(CuSO4·5H2O)是铜盐中重要的无机化工原料,广泛应用于农业、电镀、饲料添加剂、催化剂、石油、选矿、油漆等各行业[1]。目前国内有70余家硫酸铜生产企业,生产方法包括:以金属铜为原料生产硫酸铜、以铜矿石为原料生产硫酸铜、以铜镍废渣为原料生产硫酸铜、以铜精矿为原料生产硫酸铜等。在铜电解过程中,阳极电化学溶解速率大于阴极铜沉积速率,Cu2+浓度会随着电解时间的增加而升高,电解液中As、Sb、Bi、Ni等杂质也不断增加,H2SO4浓度下降。为了提供优越的电解条件,需对电解液进行净化除杂。采用电解液生产硫酸铜是净液的重要手段,但实际生产中,各冶炼厂可根据自身实际、工艺差异、CuSO4·5H2O市场需求等综合评定是否生产硫酸铜。采用直接浓缩法将电解液加热蒸发浓缩后结晶得到CuSO4·5H2O是硫酸铜生产的主要方法[2],但由于蒸发浓缩过程中酸度较高,电解液中As、Sb、Bi、Ni等其他金属杂质易同时析出,导致硫酸铜质量较差。因此采取有效措施提高直接浓缩法产出的硫酸铜主品位,以达到工业硫酸铜质量新标准成为重要课题。
1 硫酸铜生产工艺简介
本厂采用的CuSO4·5H2O生产工艺为常压蒸发+夹套式立式搅拌冷却结晶。电解液进入蒸发槽经蒸汽蒸发浓缩,槽内采取通入压缩风进行搅拌,当电解液浓缩到一定比重后出料至结晶槽,冷却水循环交换热量至结晶终点,静置陈化一段时间后抽取上清液,物料放入中间槽进行预固液分离,然后用离心机彻底固液分离物料,所得CuSO4·5H2O副产品包装入库,抽离出的上清液经过滤后进入分离槽,分离槽液二次过滤后作为脱砷母液。图1为硫酸铜生产工艺流程图。
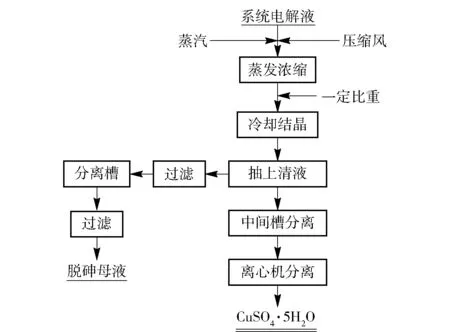
图1 硫酸铜生产工艺流程图
2 硫酸铜质量现状
目前云南铜业股份有限公司(以下简称“云铜”)硫酸铜产品质量标准为普通非农用硫酸铜HG/T 2989—1993标准,硫酸铜主品位≥94%就可广泛应用,但硫酸铜冶炼副产品YS/T94—2007标准自2008年5月1日发布后,不仅提高了对主品位的要求,而且对产品中的其他杂质含量也做出了相应要求,硫酸铜重新定级为优级品、一级品、二级品,表1为硫酸铜冶炼副产品二级品的成分要求。随着市场对硫酸铜质量要求日益提高,低品位硫酸铜不仅销售价格较低,而且出现硫酸铜产品库存积压的现象,造成财务费用升高,因此提高硫酸铜主品位已成为云铜硫酸铜生产急需解决的问题。

表1 YS/T94—2007硫酸铜新标准 %
3 提高硫酸铜品位的措施
硫酸铜晶核的成长和晶粒大小与硫酸铜在电解液中的溶解度和冷却结晶过程的操作有关,而硫酸铜溶液的过饱和度是影响结晶的主要因素,因此电解液化学成分、蒸发比重、结晶槽降温梯度、陈化时间、结晶终点温度、搅拌速度、游离酸和水分含量、产品中的钙锑等杂质含量等都是影响硫酸铜主品位的重要因素。CuSO4·5H2O的晶体属于三斜晶系范畴,较好的产品除了受化学品质约束外,还要获得粒径较大的硫酸铜晶体,因此需要对蒸发- 结晶工艺条件进行严格控制。表2是本厂生产CuSO4·5H2O电解液原料的化学成分。
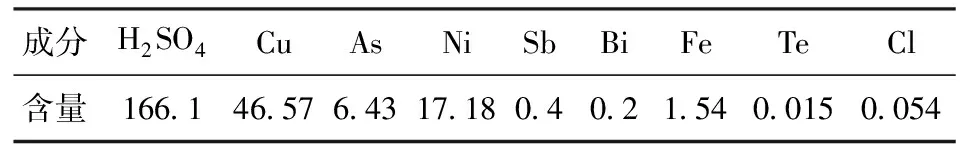
表2 电解液化学成分 g/L
3.1 蒸发比重的控制
蒸发浓缩液的比重直接决定着硫酸、铜离子浓度,高酸、高铜浓缩液也会影响杂质的行为,尤其是铁、镍离子浓度大幅度上升,条件发生变化会促使大量镍、铁析出。CuSO4·5H2O溶解度随温度的降低和硫酸含量的升高而降低,电解液中Cu2+、H2SO4浓度一定的条件下,硫酸铜结晶温度越低,结晶率越高,上清液中含铜量就越少。而结晶温度一定时,母液铜含量越高,结晶率越高,CuSO4·5H2O质量也越好。通过单因素试验找到了本厂使用的蒸发液最有利于硫酸铜主品位的蒸发比重在1.34~1.36范围内。比重试验结果见表3。

表3 比重试验结果 %
3.2 结晶槽降温梯度控制
根据CuSO4·5H2O晶核形成和长大理论,结合CuSO4·5H2O动力学和热力学理论分析可知,冷却速度随结晶温度的降低而降低,结晶过程中搅拌不均匀或不采用搅拌时,晶体较易成长,形成的硫酸铜晶体颗粒较大。冷却速度随结晶温度的升高而加快,结晶过程中搅拌均匀或搅拌强度大,硫酸铜晶核生成速度较快,晶体成长不全面,产生的硫酸铜晶体颗粒就较细,颗粒较细的结晶沉降和分离难度大。但如果硫酸铜溶液冷却速度过快,则导致CuSO4·5H2O溶液过饱和度增大过快,在冷却结晶过程中会有较多细小的硫酸铜晶体析出,由于短时间内析出的晶体小而多,较快的降温梯度下晶核不能完全长大,因此要获得颗粒较大的硫酸铜晶体,必须控制冷却结晶过程中的冷却速度才能确保硫酸铜晶核的形成和长大[3]。因此合理控制结晶槽降温梯度和搅拌速度至关重要,通过工业试验,探索出了适合于本厂系统的CuSO4·5H2O结晶降温梯度如图2所示,具体措施为冷却前期为CuSO4·5H2O晶核形成时期,先自然冷却0.5 h,再开动搅拌机搅拌0.5 h,再开冷却水,开始时水量较小,防止产生大量细碎晶核使产品颗粒太细,同时也防止槽壁出现大量的结晶,影响冷却效率。1 h后将水量逐渐开大,当温度降至结晶终点温度停止,对比线性拟合方程Y=71.33-2.925x和Y=90.71-3.78x可知:斜率-3.78<-2.925,斜率越小降温梯度越缓慢,结晶质量越好。优化降温梯度后主品位见表4。

表4 优化降温梯度后主品位 %
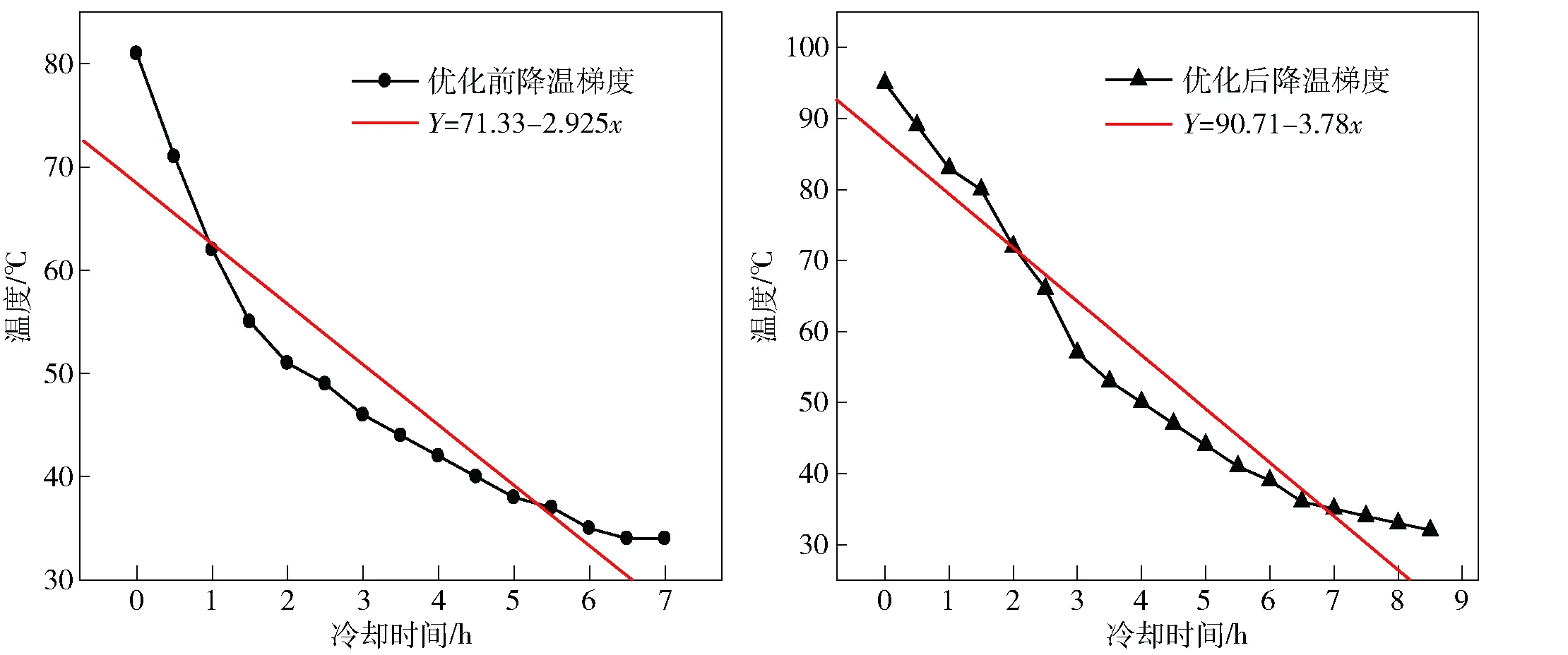
图2 优化前、后结晶降温梯度
3.3 搅拌速度控制
搅拌速度快慢也是影响硫酸铜晶粒大小的关键因素,搅拌越快生产出的CuSO4·5H2O晶体就越小,颗粒大小也不均匀。搅拌速度越慢,生产出的硫酸铜晶体颗粒就越大,颗粒大小也越均匀,搅拌慢时横向和纵向流体应力适中,硫酸铜晶体的各晶面都能按其晶核的形成和长大过程自由的发展,产出的硫酸铜晶体就有较好的物理外形,若在结晶过程中某些CuSO4·5H2O晶体面受结晶槽壁或其它晶体挤压时,易影响硫酸铜晶体的正常成长,形成CuSO4·5H2O歪晶。结晶过程中搅拌速率较低时,混合不充分,硫酸铜产生超溶解度和分配不均,易使部分CuSO4·5H2O晶体形成聚结,一般硫酸铜晶体的晶体粒径要求在1~3 mm左右,搅拌速度需保持适中。搅拌速度过快会诱导出较高的硫酸铜超溶解度,硫酸铜晶核不能在稳定的超溶解度下形成和长大,使硫酸铜产品的晶粒分布不均匀,增加了结晶过程二次成核的几率,最终减小CuSO4·5H2O主粒径。
结晶槽内的搅拌所形成的混合流体应力是影响CuSO4·5H2O结晶的重要因素之一,受影响较大。结晶槽的几何构造、搅拌速度、进液方式及搅拌桨的形状决定着混合条件,进液方式及搅拌桨的形状对于间歇或半间歇结晶过程的混合条件起决定性作用。搅拌速度快慢对整个硫酸铜的结晶过程中晶核的形成、长大等都有着持续的影响,同时CuSO4·5H2O晶体的纯度也受结晶槽内的搅拌速度制约,L.M.Matusevich研究了搅拌过程对硫酸铜晶体纯度的影响,结果表明,在硫酸亚铁浓度比较低时,搅拌速率对CuSO4·5H2O晶体纯度的影响很小,但是在其较高浓度下增加搅拌速率会降低硫酸铜晶体中硫酸亚铁的含量[4]。图3为搅拌速度与晶体大小关系。
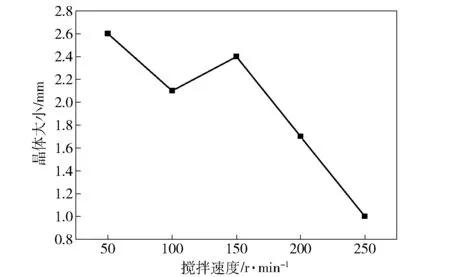
图3 搅拌速度与晶体大小关系
3.4 结晶终点温度控制
CuSO4·5H2O晶体的成核速率和生长速率随着硫酸铜结晶温度的升高而增大,成核速率的增大使晶核增多,同时减小硫酸铜产品的平均粒度,而较大的起始晶核有利于晶体长大,使硫酸铜产品的平均粒度增大。因此,在硫酸铜成核阶段降温梯度要小,而在晶体的成长阶段,温度应适当低控,才有利于获得较大的晶体的硫酸铜。
生产实践表明,硫酸铜产品的质量除了与工艺息息相关之外,还与电解液中Cu2+、H2SO4、杂质、温度等因素有关,当蒸发浓缩终点液中Cu2+和H2SO4不变时,结晶率随结晶温度的降低而升高,上清液中Cu2+含量就越少;但当结晶终点温度过低时,就会有NiSO4·7H2O析出,因此需要根据电解液母液中的Cu2+、H2SO4以及As、Ni等杂质含量对结晶终点温度进行灵活调整。随着电解液中杂质含量越来越复杂,尤其是Fe、Ni离子浓度大幅度上升,结晶终点温度控制不好会导致大量Ni、Fe析出。为确保Fe、Ni不同时与CuSO4·5H2O结晶析出,提高CuSO4·5H2O的产量,有效降低电解液的Fe、Ni含量,宜控制结晶终点温度25~35 ℃。
3.5 游离酸和水分控制
CuSO4·5H2O产品中水分和游离酸的含量是影响主品位的重要因素,产品中水分越大,酸度越高主品位越低。同时在冷却结晶过程中,硫酸铜的溶解度随着温度的降低而减小,Ca、Sb在高酸环境下形成CaSO4微溶沉淀或泥沙等杂质也随之析出或沉降。放到中间槽后夹杂在硫酸铜产品中,离心过程水洗和离心时间不恰当导致杂质含量增加,主品位下降。对CuSO4·5H2O晾晒和未晾晒进行了对比试验,结果见表5。

表5 晾晒与未晾晒对硫酸铜主品位的影响 %
从表5晾晒与未晾晒对硫酸铜品位影响的试验结果可知,硫酸铜主品位高低还受游离酸和水分影响,游离酸和水分含量高易造成硫酸铜主品位低,因此CuSO4·5H2O生产的最后离心机离心分离工序十分关键。本厂试验了研究离心过程水洗时间、离心时间、水洗后脱水时间三个因素是对主品位的影响规律,并设计三因素四水平正交试验,优化出最佳参数搭配:水洗5 min,离心10 min,水洗后离心时间10 min。离心参数优化试验结果见表6。

表6 离心参数优化试验结果 %
为了规避单一取样对试验结果造成的概率性、偶然性,采用5#优化得到的参数进行验证试验,采用优化后离心参数,硫酸铜主品位显著提高。
3.6 离心机升级改造
用离心机固液分离CuSO4·5H2O,产生的离心力随着旋转半径的变化而变化,且离心力场远比重力场大,因此采用离心分离机就可使悬浮粒子沉降速度大大加快,达到良好的分离效果。 当离心机绕轴旋转时,物料所受的离心力大小计算见式(1)。
(1)
式中:m为回转物料的质量;G为回转物料的重量;R为回转半径;v为旋转的圆周速度。

(2)
硫酸铜在离心过程中离心力的大小与转鼓转速n的平方成正比,同时与转鼓的半径R成正比。因此,用提高离心机的转速来增大离心力,比增大转鼓的半径更为有效。
电解分厂将原用离心机进行了升级改造,转速由原来的660 r/min提高至1 200 r/min,分离因素提高至850,改造后硫酸铜主品位可达96%以上。表7为离心机改造结果。

表7 离心机改造结果 %
3.7 电解液预氧化除杂实验
CuSO4·5H2O中含有不溶性杂质和可溶性的FeSO4、Fe2(SO4)3等,可对电解液进行预氧化除杂,从而降低产品中杂质的含量。FeAsO4溶度积Ksp=5.7×10-21、Fe(OH)3溶度积Ksp=4×10-38,Pb3(AsO4)2的Ksp=4×10-36,可通过氧化法除砷。首先加入适量H2O2氧化剂氧化,再加入Na2CO3溶液,调节至适当pH值使大部分Fe3+形成Fe (OH)3沉淀,同时Pb2+离子与AsO2-形成Pb3( AsO4)2沉淀。
反应方程式见式(3)、式(4)[4]。

(3)

(4)
此外电解液中杂质溶度积:KspPbCO3=7.4 ×10-14,KspZnCO3=1.4×10-11,KspNiCO3=6.6×10-9,KspCaCO3=2.8×10- 9,KspCoCO3=1.4×10-13,都很小,可通过加入Na2CO3调节溶液pH值,使它们形成碳酸盐沉淀而除去[5-6]。
表8是从自然冷却结晶上清液和氧化除杂上清液杂质含量小试结果对比,加H2O2氧化剂和Na2CO3脱杂剂后,杂质元素As降低6.75%、Pb降低11.1%、Fe降低17.7%、Ni降低3.03%。图4、图5表明在4 mol/L H2O2氧化剂和60 ℃反应温度下,除杂效果明显,此除杂方案可作为CuSO4·5H2O氧化除杂提高主品位的理论指导。

表8 除杂前后上清液杂质含量对比 g/L
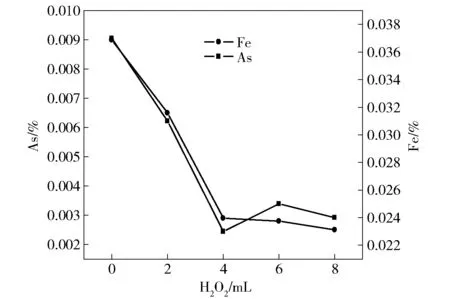
图4 H2O2用量对电解液杂质元素As、Fe含量影响

图5 反应温度对电解液杂质元素As、Fe含量影响
通过以上措施,2017年8月至2018年2月硫酸铜主品位提高了2.1%(平均主品位达96%),大幅度降低产品库存,每年节约财务费用80余万元。
4 结论
1)基于本厂生产硫酸铜的原料,通过单因素试验,找到了硫酸铜浓缩液的最佳比重1.34~1.36。硫酸铜产品中的水分和游离酸是影响主品位的重要因素,合理选择离心机的转速和分离因素并找出离心时间、水洗时间、离心-水洗时间间隔的最优参数搭配,对提高硫酸铜品位非常关键。
2) 根据生产实践,对硫酸铜结晶降温梯度进行优化,在CuSO4·5H2O晶核形成时期采用小循环水量,自然冷却1 h后再开搅拌,有利于硫酸铜晶核的形成和长大,同时搅拌方式保持慢而缓,可有效防止产生细碎硫酸铜晶核,增大硫酸铜的晶粒,提高硫酸铜的结晶率,从而提高产量。
3) 生产实践表明,硫酸铜产品的质量与电解液中Cu2+、H2SO4、杂质、温度等因素有关,当蒸发浓缩终点液中Cu2+和H2SO4含量不变时,结晶率随结晶温度的降低而升高,上清液中Cu2+含量就会减少。但当结晶终点温度过低时,会有NiSO4·7H2O析出,因此需要根据电解液母液中的Cu2+、H2SO4以及As、Ni等杂质含量对结晶终点温度进行灵活调整。
4)工业试验表明,FeAsO4、Pb3(AsO4)2、PbCO3、NiCO3、 CaCO3、ZnCO3的Ksp存在差异,采用H2O2氧化剂和Na2CO3脱杂剂处理后,通过调节适当pH可有效去除硫酸铜浓缩液中的杂质,此方法可作为CuSO4·5H2O氧化除杂提高主品位的生产指导。
5)采用上述试验研究成果后,硫酸铜主品位提高了2.1%,降低了库存,节约了财务成本。
