重楼皂苷Ⅱ联合喜树碱对肺癌H460、H446细胞凋亡及信号通路的影响*
2019-03-07郭慧敏李祎亮
郭慧敏,李祎亮,刘 振
(1.天津技术产权交易有限公司,天津 300203;2.中国医学科学院北京协和医学院放射医学研究所,天津 300192;3.中国食品营养/安全与药物化学国际科技合作基地,教育部工业微生物重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
重楼是百合科重楼属(Paridis)植物的泛称。文章所指的重楼为该属植物云南重楼和七叶一枝花,是中国著名的药用植物,易生长在潮湿的地方。已证实重楼的活性成分为重楼皂苷类化合物[1-2]。重楼皂苷具有广谱抗肿瘤活性,以重楼皂苷为主的活性提取物,体内外均显示了很好的抗肿瘤活性,在动物模型上的抑瘤率超过40%[3-5],可通过抑制基质金属蛋白酶阻止肿瘤的转移[6]。也有研究证实重楼皂苷可通过缓解炎症反应、诱导细胞凋亡和降低氧化应激反应达到抑制肿瘤生长的目的[7]。重楼皂苷I和重楼皂苷Ⅱ(PSⅡ)是重楼皂苷提取物中的主要活性成分,针对重楼皂苷I已有不少研究报道[8-9]。喜树碱(CPT)是美国化学家Wall和Wani于1966年首先从喜树中提取出来的一种五环吲哚生物碱,1966年首次从中国本土喜树中分离得到。CPT具有广谱抗肿瘤作用,被列为近年来发现并应用于临床的著名植物类抗肿瘤药之一。肺癌发病率居中国恶性肿瘤首位,近70%的肺癌患者确诊时已经为晚期,错过了最佳治疗时机,临床上主要采用化学药物治疗,但化疗药均有明显的毒副作用。文献报道PSⅡ对肿瘤细胞具有很强的细胞毒作用,但在肺癌方面的研究较少。因此,本文以两种wt EGFR类型的肺癌细胞系——人大细胞肺癌NCI-H460(H460)和人小细胞肺癌NCI-H446(H446)为模型,选择临床上常用的广谱化疗药物CPT,与PSⅡ联合用药,研究两种药物是否具有协同作用,并确定含有PSⅡ和CPT的最佳配伍用药方案,对联合用药方案的诱导细胞凋亡及相关凋亡网络通路的作用机制进行研究。
1 材料和方法
1.1 实验材料 AnnexinV-FITC/PI凋亡检测试剂盒(美国BD公司),Anti-tubulin抗体(西格玛奥德里奇中国有限公司),Anti-Bcl-2抗体、Anti-Bcl-XL抗体(天津三箭生物科技有限公司)。PSⅡ(天津士兰科技有限公司),CPT(大连美仑生物技术有限公司),纯度均大于98%。H446和H460购自中国科学院上海生物科学研究所;细胞用RPMI1640培养基培养(含1%的青霉素-链霉素溶液,10%的胎牛血清)。细胞培养每2~3 d更换培养基1次。
1.2 实验方法
1.2.1 药物抑瘤实验 PSⅡ与CPT联合抑瘤实验:取对数生长期的细胞,调整H460和H446细胞,细胞浓度为5×104cell/mL接种于96孔板上,每孔100μL,同时设置空白孔和对照孔。于37℃、5%CO2培养箱中培养24 h,分别加入终浓度为0.031 25、0.062 5、0.125、0.25μmol/L的化合物CPT,0.3、0.6μmol/L的化合物PSⅡ,以及不同浓度配比的CPT联合PSⅡ(0.03125∶0.3,0.0625∶0.3,0.125∶0.3,0.25∶0.3,0.03125∶0.6,0.062 5∶0.6,0.125∶0.6,0.25∶0.6),每孔0.5μL,每个药物浓度设置3个复孔。空白孔为仅含培养基不含有细胞、二甲基亚砜(DMSO)以及药物。对照孔仅加入含相同浓度DMSO的培养基作用于细胞。按照以上方案药物处理后,置于37℃,5%CO2恒温培养箱中培养48 h后,每孔加入5 mg/mL的噻唑蓝(MTT)溶液20μL,继续孵育4 h,终止培养。弃去每孔加入100μL DMSO,37℃,放置10 min后,充分溶解,用酶标仪(492 nm,参比波长630 nm)测定各孔的吸光度(OD)值,按以下公式计算细胞抑制率。细胞存活率(%)=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%。IC50:半数有效抑制浓度,即细胞存活率为50%时的药物浓度。根据MTT结果求直线回归方程,并计算IC50值。对CPT与PSⅡ的联合作用采用CI值法计算,应用计算机软件CompuSyn计算,CI<1表示两药联合后具有协同作用;CI=1表示两药联合后具有相加作用;CI>1表示两药联合后具有拮抗作用。
1.2.2 细胞增殖实验(平板克隆法测定克隆形成率)取对数生长期的各组细胞,分别用0.25%胰蛋白酶消化,然后把细胞悬浮在含10%胎牛血清的RPMI1640培养液中备用。将细胞悬液作梯度倍数稀释,每组细胞分别以每皿50、100、200个细胞的梯度密度分别接种含10 mL 37℃预温培养液的皿中,使细胞分散均匀。置37℃,5%CO2及饱和湿度的细胞培养箱中培养2~3周。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用磷酸盐缓冲液(PBS)小心浸洗2次。加4%多聚甲醛5 mL固定细胞15 min。然后去除固定液,加适量GIMSA染色液染10~30 min,然后用流水缓慢洗去染色液,空气干燥。将平皿倒置并叠加1张带网格的透明胶片,用肉眼直接计数克隆,或在显微镜(低倍镜)计数大于10个细胞的克隆数,最后计算克隆形成率。克隆形成率=(克隆数/接种细胞数)×100%,两株细胞分为4组,分别为空白组、加入终浓度为0.125μmol/L的CPT组、0.6μmol/L的PSⅡ组,以及两者联合组。
1.2.3 流式细胞仪AnnexinV-FITC/PI双染法检测细胞凋亡率 将细胞接种于6孔板,待细胞贴壁生长后分别向各实验孔加入加入0.125μmol/L的CPT和0.3、0.6μmol/L PSⅡ单独和联合处理24 h和48 h。继续培养24 h后收集细胞;将各孔培养液的上清和收集的底部细胞悬液混合,放入离心机以1 000 r/min离心收集细胞。用PBS溶液洗细胞3次后将细胞团块分散于细胞凋亡检测缓冲液中,在避光条件下向细胞悬液中分别加入Annexin V-FITC和PI,室温孵育15 min后用流式细胞仪检测各组细胞的凋亡率。重复实验3次。
1.2.4 蛋白免疫印迹法(Western blot)检测蛋白表达 使用Western blot法,研究PSⅡ与CPT联合用药于体外培养肺癌细胞株的分子药理学机制。将两种肺癌细胞按5×104cell/mL的细胞数量接种于10 mL平皿中,放入CO2培养箱中培养24 h后,分组加入终浓度为0μmol/L(用0.5%DMSO代替)、0.125μmol/L的CPT和0.3、0.6μmol/LPSⅡ,以考察单独和联合用药,放入CO2培养箱中继续培养24 h。按照细胞浆蛋白抽提试剂盒说明书提取蛋白,采用BCA法检测并调整各组蛋白的浓度。将等量的蛋白溶液置于12%的聚丙烯酰胺凝胶中进行电泳分离,湿法转移蛋白条带至PVDF膜上,5%脱脂奶粉溶液封闭(PBST液稀释)l h,一抗4℃孵育过夜;二抗室温孵育1 h,PBST漂洗3次,每次10 min。加显色底物孵育后,凝胶成像仪采集图像。Bandscan 5.0凝胶分析系统分析显影条带灰度确定蛋白相对表达量。
1.2.5 统计分析方法 采用GraphPad Prism5软件统计分析作图,所有的数据采用(x±s)或者百分比,多组间比较采用单因素方差分析方法,组间两两比较采用Dunnett’s检验,P<0.05为差异具有统计学意义。
2 实验结果
2.1 PSⅡ联合CPT的细胞毒作用 有研究表明PSⅡ对H460和H446细胞的IC50低于1μmol/L,笔者为了更好地分析PSⅡ联合CPT的效果,分别以CPT单独或CPT和PSⅡ联合应用于上述两种细胞株,考察了其细胞毒作用。肺癌细胞采用不同浓度的CPT(0、0.031 25,0.062 5、0.125,以及0.25μmol/L)和PSⅡ(0.3和0.6μmol/L)单独和联合处理48 h,细胞存活率由MTT测得,见图1。结果显示,药物处理的细胞相对DMSO组的细胞存活率及CPT单独使用对肺癌细胞有细胞毒活性并呈现剂量依赖性,当PSⅡ联合CPT时,对肺癌细胞的细胞毒作用强于单独应用CPT。PSⅡ联合CPT对H460和H446细胞的CI<1,表明具有协同作用;PSⅡ增加了CPT对肺癌细胞的敏感性。在随后的抑瘤分子机制研究中对H460和H446细胞应用的剂量为0.6 μmol/LPSⅡ+0.125μmol/LCPT。
2.2 PSⅡ联合CPT的抗细胞增殖作用 肺癌细胞采用CPT(0.125μmol/L)和PSⅡ(0.6μmol/L)单独或联合处理48 h后,联合用药效果明显优于单独用药组,PSⅡ联合CPT对H460和H446细胞的CI<1,表明两种药物具有协同抑瘤作用。见图2。
2.3 PSⅡ联合CPT诱导肺癌细胞凋亡的作用 采用Annexin V-FITC和PI双染细胞,应用流式细胞仪测定细胞凋亡。分别以PSⅡ(0~6μmol/L)、CPT(0.125μmol/L)、PSⅡ-CPT(0.6~0.125μmol/L)处理肺癌细胞48 h后,收集细胞,Annexin V-FITC和PI双染,Annexin V-FITC阳性和PI阴性的细胞为早期细胞凋亡(Q1-LR);Annexin V-FITC和PI均阳性的细胞为晚期细胞凋亡(Q1-UR);Annexin VFITC和PI均阴性的细胞为正常活细胞(Q1-LL)。联合用药之后,增加了H460、H466细胞的早期凋亡,尤其是对H466细胞,凋亡比例为(70.10±3.44)%,见图3。而对H460细胞,PSⅡ和CPT联合后显著增加了晚期凋亡。
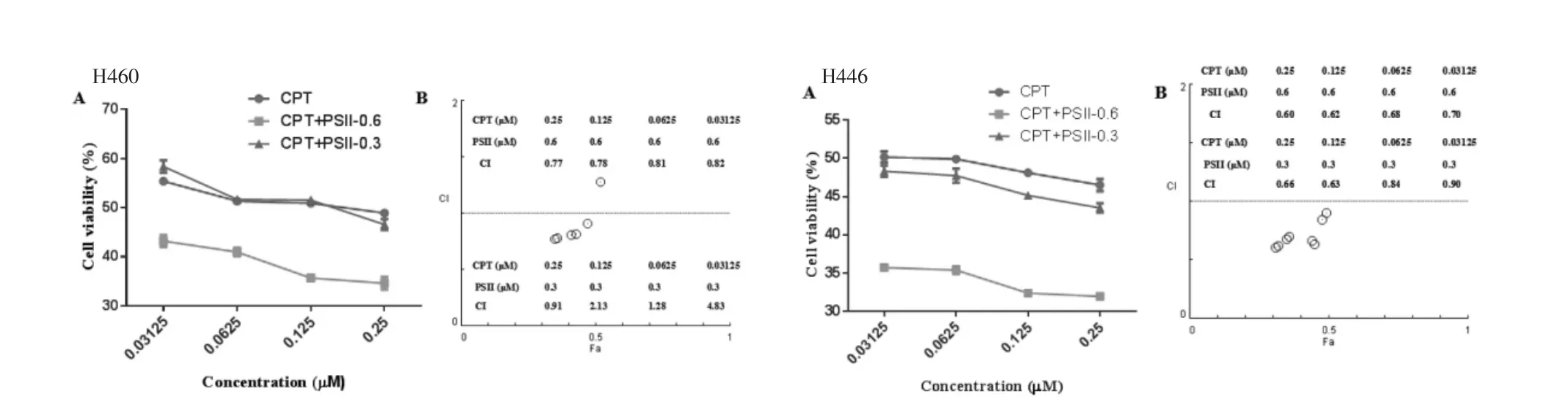
图1 PSⅡ和CPT联合作用对H460、H446细胞的细胞毒作用Fig.1 Cytotoxicity of PSⅡcombined CPT in H460 and H446 cells
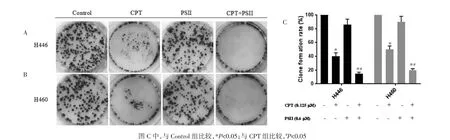
图2 PSⅡ和CPT单独或联合作用于H460和H446细胞的平板克隆形成实验结果Fig.2 Experimental result of PSⅡand CPT combined or single used in H460 and H446 cellsby flat plateclone formation test
2.4 PSⅡ联合CPT对肺癌细胞凋亡相关信号通路的作用 为了进一步研究PSⅡ联合CPT的抑瘤协同作用机制,采用Western blot方法检测了抗凋亡蛋白B淋巴细胞癌(Bcl)-2和Bcl-XL的表达情况,同时对蛋白激酶B(AKT)、细胞外信号调节酶(ERK)和p38 MAPK磷酸化蛋白的表达进行了研究。结果表明,这几种蛋白参与细胞凋亡过程。对H460而言,PSⅡ联合CPT能明显上调p38 MAPK磷酸化和ERK磷酸化的表达,对AKT磷酸化无明显作用,并下调了Bcl-2和Bcl-XL蛋白的表达。对H446细胞而言,PSⅡ联合CPT后上调了AKT、p38 MAPK和ERK的表达,并下调了Bcl-2蛋白的表达,对Bcl-XL无明显作用,见图4。
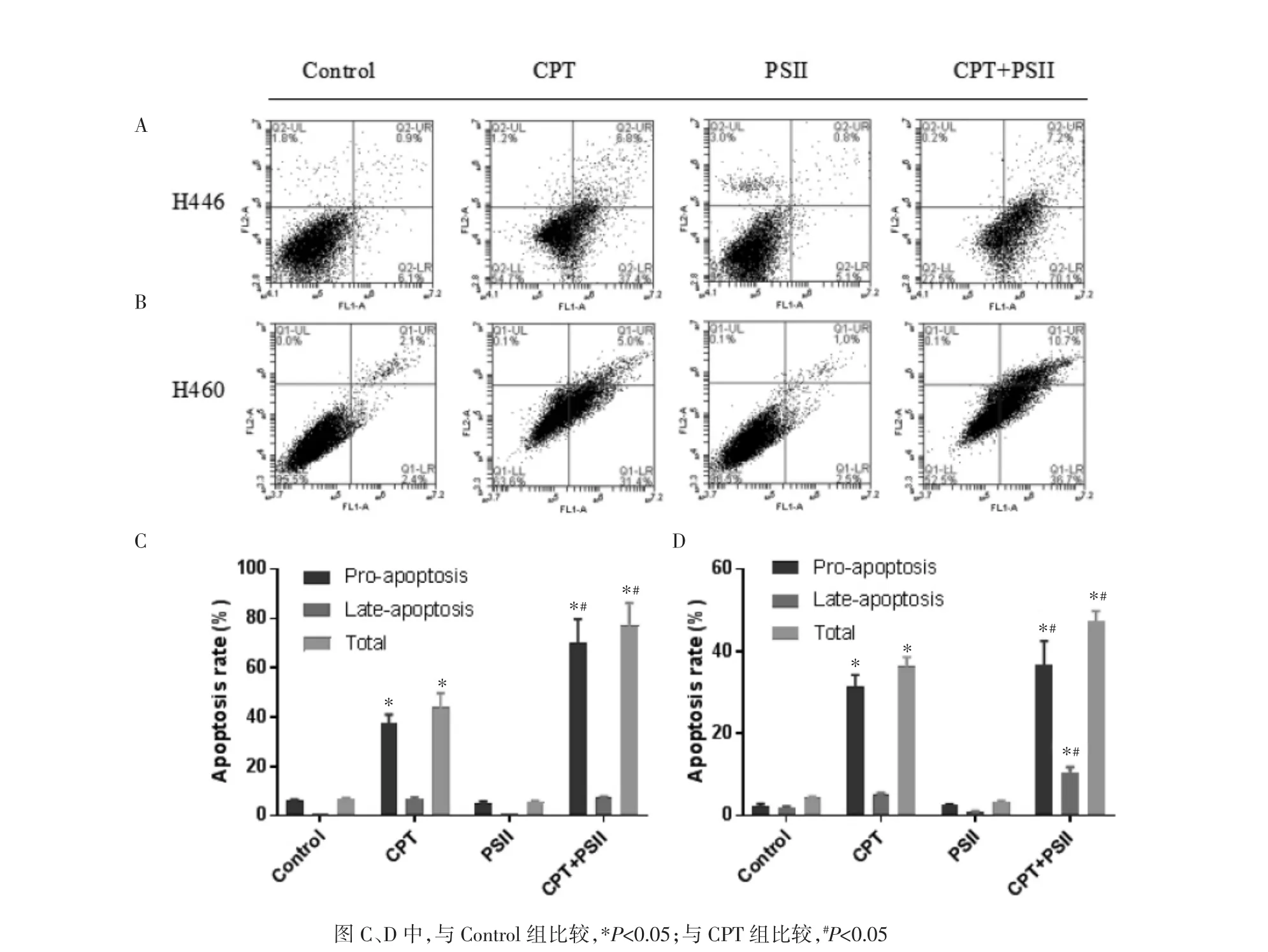
图3 PSⅡ和CPT联合给药对H460和H446细胞的诱导凋亡作用Fig.3 Effect of PSⅡcombined CPT treatment indnced apoptosis in H460 and H446 cells
3 讨论
食品药品监督管理局(FDA)批准了一些分子靶向药物如吉非替尼用于治疗晚期NSCLC患者,并确有良好的疗效,但是由于这些靶向药物分子的作用局限性、价格高以及使用一段时间后会产生耐药,临床上化疗药物依然在治疗肺癌晚期患者占据主要地位,如CPT类药物。联合用药是治疗疾病过程中常采用的方式,联合用药产生的协同作用可显著提高药物的疗效[10-11]。关于CPT联合其他类药物的研究也多有报道,如联合鬼臼毒素和雷公藤甲素对肺癌细胞系具有协同作用。前期实验发现重楼与姜黄的复合物与HCPT联合对H22肝癌模型呈现协同作用。重楼皂苷I、PSⅡ是该复方的主要活性成分,已有研究表明重楼皂苷I对H1299、H520、H460和H446肺癌细胞系具有很好的细胞毒作用,并呈现剂量依赖性,重楼皂苷I联合CPT和HCPT对不同肺癌细胞系呈现不同的作用取决于肺癌的种类[9]。因此,本文研究了PSⅡ联合CPT的协同作用,结果表明PSⅡ具有化疗增敏作用,与CPT联合对H460和H446两种肺癌细胞系具有协同作用,由于这两种细胞是不同种类的肺癌细胞系,H460为NSCLC细胞系,H446属于SCLC细胞。CPT作为拓扑异构酶I(Topo I)的抑制剂,能与Topo I-DNA形成复合物,从而引起DNA复制过程中DNA单链的断裂,进而导致细胞的死亡。近期,对CPT作用机制进行深入研究发现该类化合物对多条信号通路亦有作用,包括线粒体凋亡通路、PP2A调节通路、核转录因子-κB(NF-κB)信号通路等[12]。PSⅡ是一种很强的细胞凋亡诱导剂,可以通过调节多种信号通路如对NSCLC的AKT通路的调节以及对SCLC的ERK通路的调节。本研究中PSⅡ在低剂量下(0.6μmol/L)并不能引起H460和H446细胞的凋亡,而CPT单独使用剂量下能明显诱导H460和H446细胞的凋亡比例。当PSⅡ与CPT联合后能明显增强两种肺癌细胞系的凋亡细胞比例,这说明PSⅡ能增加CPT对肺癌细胞系的敏感性。
MAPK和AKT信号通路对来自细胞外的刺激敏感,AKT活化与肿瘤的发生密切相关,成为肿瘤治疗过程中的一个靶点;ERK通常与细胞的增殖和生长相关;而p38 MAPK是细胞应激过程中产生的,与细胞的死亡密切相关[8,13-15]。本研究发现PSⅡ联合CPT能明显上调p38 MAPK磷酸化和ERK的表达,对AKT磷酸化在不同细胞中作用不同。以上研究结果表明PSⅡ联合CPT对NSCLC和SCLC的作用机制不同,调节不同的信号通路。
线粒体是肿瘤发生过程中一种重要的调节剂,它参与细胞死亡、氧化应激、代谢等过程[16]。许多研究发现线粒体积极参与到细胞凋亡的关键环节,包括调节凋亡信号通路、线粒体膜电位的缺失、促凋亡因子细胞色素C的释放等[17]。Bcl-2家族是细胞凋亡的调节剂,并在细胞凋亡过程中起到重要作用,能改变线粒体膜电位。Bcl-2家族蛋白可分为两个亚族,其中一个是抗凋亡蛋白包括Bcl-2和Bcl-XL[18]。本文的研究结果表明PSⅡ联合CPT作用于H460细胞后,Bcl-2和Bcl-XL的表达降低。由此推测PSⅡ增敏CPT对H460和H446细胞的作用机制可能是影响线粒体信号通路产生的细胞凋亡。
研究结果显示PSⅡ可以作为化疗药物CPT的增敏剂,呈现协同作用的分子机制是抑制细胞的增殖和诱导细胞凋亡,主要的作用通路为激活p38 MAPK信号通路,同时激活AKT和ERK磷酸化蛋白的表达。本研究为PSⅡ成为化疗药物治疗肺癌的增敏剂提供了实验基础,PSⅡ联合CPT有望成为治疗肺癌的新治疗策略。
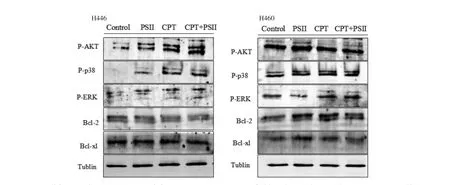
图4 PSII联合CPT对H460和H446细胞中Akt、ERK和p38 MAPK磷酸化蛋白以及抗凋亡蛋白Bcl-2和Bcl-XL的作用Fig.4 Effect of PSIIcombined with CPT in Akt,ERK and p38 MAPK phosphorylated protein and anti-apptotic protein Bcl-2 and Bcl-XL in H460 and H446 cells
