小檗碱介导LncRNA-MIAT调控自噬抑制心肌细胞肥大的机制研究*
2019-03-06曾志聪林丰夏张元贵宋银枝李亮
曾志聪,林丰夏,张元贵,吴 伟,宋银枝,李亮**
(1.深圳市宝安中医院(集团)心血管病科 深圳 518100;2.广州中医药大学第一附属医院 广州 510006)
心力衰竭(心衰)是各种心血管疾病的终末期阶段,目前的发病率及死亡率居高不下[1]。当高血压、心脏瓣膜病等致心脏压力负荷过重时,心脏会代偿性的出现心肌肥厚,表现为心肌肥大,蛋白表达的增加,以增强心室收缩功能,目的是对抗过高的压力负荷,维持心脏泵血功能的稳定[2]。虽然早期心肌肥大对于维持正常心功能具有一定的代偿意义,但是这种刺激持续存在将会引起交感神经系统和肾素-血管紧张素-醛固酮系统等神经内分泌系统的过度激活,释放血管紧张素及儿茶酚胺类等激素,造成心肌细胞氧耗量的增加,一旦心脏血供不能满足肥厚心肌的需求时,即会发生心衰,显著增加恶性心律失常、心源性猝死的风险性,严重威胁人类生命。因此,对于早期心肌肥大的抑制可以延缓其进入心力衰竭期,降低心衰的死亡率。目前认为长链非编码RNA(Long non-coding RNA,LncRNA)在心衰治疗中应用潜力巨大,其原因在于它可以通过在分子水平上的巨大调控力影响细胞的稳态,并进一步影响疾病的发展[3-5]。其中,有研究发现长链非编码RNA-MIAT(LncRNA-myocardial infarctionrction-associated transcript,LncRNA-MIAT)在病理或应激状态下,可以通过调控自噬参与心肌肥大的发展过程[6,7]。
中医药是中华民族原创的医学科学,蕴含着解决人类健康问题的宝贵智慧,为治疗心衰提供了独特见解和思路。黄连就是被历代医家广泛应用的一种传统中药材,其提取物小檗碱(Berberine,BBR)被临床工作者证实可以抑制心肌肥大,拮抗心室重构,减少心衰患者的死亡率、再住院率,在心衰治疗上具有潜力。但是小檗碱抑制心肌肥大的机制目前并不是很清楚。本研究探索了心肌细胞肥大状态下LncRNA-MIAT 与自噬通路蛋白腺苷酸活化蛋白激酶(AMPK)及自噬标志蛋白LC3Ⅱ、P62 的表达水平,进而验证小檗碱抑制心肌细胞肥大是否与其调控LncRNA-MIAT 和自噬的能力有关。

表1 干扰片段基因序列
1 材料和方法
1.1 材料
大鼠心肌细胞H9C2 购自中国科学院细胞库,盐酸小檗碱(批号A600129-0005)、血管紧张素Ⅱ(AngⅡ,批号A07852)均购自Sigam(上海)公司,DEME 培养基(批号C11875500BT)、胎牛血清(批号16000-044)、青链霉素混合液(批号15140-122)、0.25%的胰蛋白酶(批号25200-072)、一抗、二抗等主要试剂均购自碧云天生物科技有限公司,Trizol试剂(批号TR118-500)、RNA 试剂提取盒(批号Trizol)购自MRC(美国),逆转录试剂盒(批号M1705)、GoTaq® qPCR Master Mix(批号A6002)购自Promega(北京);质粒及引物的设计和合成委托上海生工生物公司完成。
1.2 主要仪器
旋涡振荡器(海门市其林贝尔仪器制造有限公司,vortex-5)、手提式高速分散器(宁波新芝生物科技有限公司,S10)、紫外可见分光光度计(上海奥谱勒仪器有限公司,UV-752P)、移液枪(Eppendorf)、紫外透射分析仪(Hema,UV-3A)、电子天平(上海精密科学仪器有限公司,JA1003N)、冷冻高速离心机(Hema,TGL-16R)、基因扩增仪(Hema,Hema9600)、倒置显微镜(NIKON)。
1.3 方法
1.3.1 H9C2心肌细胞培养与心肌细胞肥大模型建立
将获得的H9C2 心肌细胞置于DEME 培养基进行培养,当细胞数达到80-90%时,吸取培养基。用PBS洗涤细胞2 次。再加入0.25%的胰蛋白酶溶液5 mL,并放于37℃培养箱2-3 min。用倒置显微镜观察细胞形态,若细胞将要分离并呈现圆粒状时,立即倒掉胰蛋白酶溶液,并加入适量含胎牛血清的新鲜培养基终止胰蛋白酶溶液作用。用吸管上下吸放数次以打散细胞团块,混和均匀后,补足培养基,按1∶2进行传代。最后放入37℃中的5% CO2培养箱培养。当细胞数达到80-90%且状态良好时,于-80℃的低温冰箱液氮罐冻存备用。将解冻后的H9C2 心肌细胞置于DMEM培养液(10%胎牛血清)中,培养48 h 后的H9C2 心肌细胞换无血清培养液饥饿12 h 后,用稀释后浓度为10-6mol·L-1的AngⅡ溶液干预诱导48 h,用倒置显微镜观察细胞形态及单位面积下心肌细胞数量,用图像分析软件image pro plus 6.0 分析计算心肌细胞平均表面积(μm2),面积计算公式为:细胞平均表面积=总面积÷细胞个数。
1.3.2 转染质粒干扰LncRNA-MIAT
细胞消化后,接种至24孔板中,37℃、5%CO2培养箱中培养过夜。第2 d 细胞密度为80%,吸去培养基。200 pmol 干扰片段溶于250μl opti-MEM 中,混匀、静置。将1.5 μl Lipofectamine 2 000 溶于250 μl opti-MEM 中,轻轻混匀,室温静置5 min。将片段和脂质体溶液混匀,室温静置20 min,滴加至6 孔板孔中,混匀,37℃、5% CO2培养箱中培养。4 h 后,吸去转染培养基,加入2 mL完全培养基,继续培养24 h后行qPCR检测和Western blotting检测。
1.3.3 qPCR检测LncRNA-MIAT的表达
用Trizol 提取心肌细胞的总RNA,然后用逆转录试剂盒将提取的总RNA 逆转录成cDNA,反应条件:70℃5 min,冰上5 min,42℃60 min。使 用GoTaq®qPCR Master Mix 将cDNA 扩增,反应条件:热变性95℃120 s 1 cycle,变性95℃15 s,退火延伸60℃30 s,40 cycle,溶解曲线60-95°C。所用引物序列为:MIAT,F 5'-GAGGGAAGTTCTGAGCTTGG-3'and R 5'-CCTTTCTTCTGGGCTGAGAC-3',NCBI 序 号102 552664;LncRNA-CHRF,5'-CCUGCCUUGUAUUUUGUGUUG-3' and 3'-CAACACAAAATACAAGGCAGG-5',NCBI
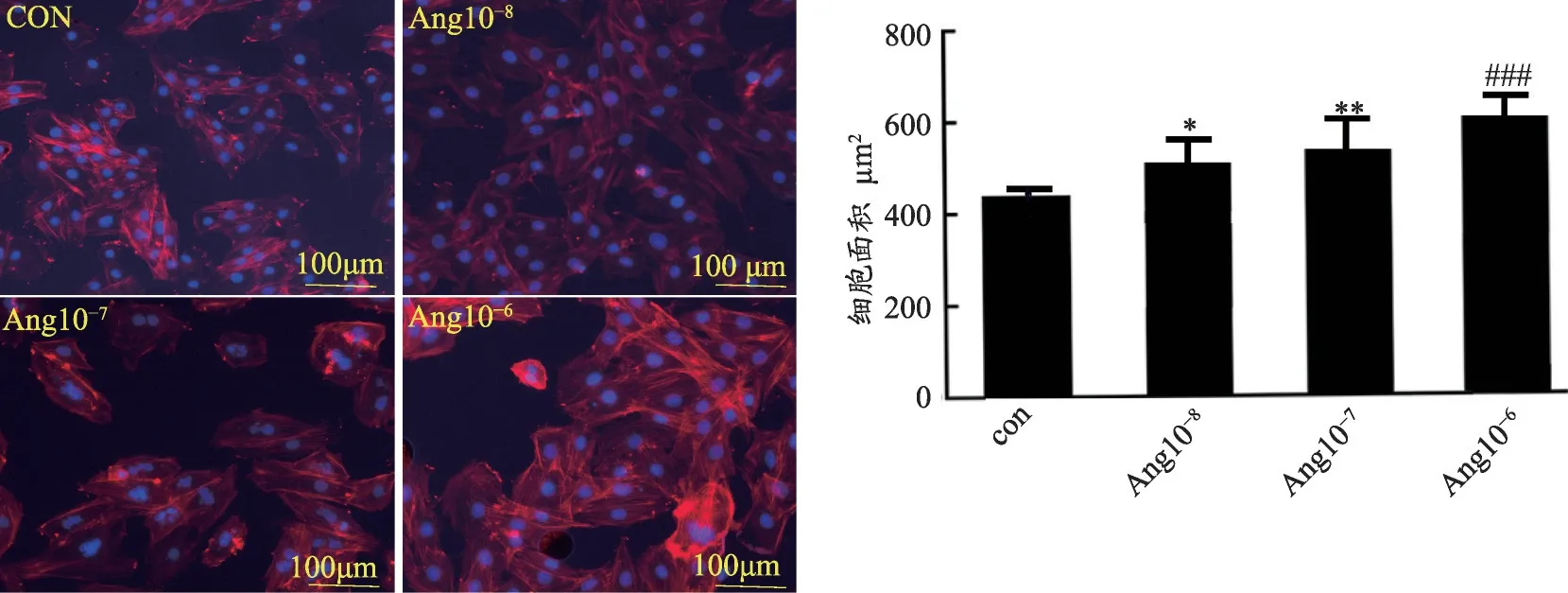
图1 不同浓度Ang度诱导H9C2心肌细胞肥大能力
序号105 463121;GAPDH:5'-GCAAGAGAGAGGCCCTCAG-3'and 5'-TGTGAGGGAGATGCTCAGTG-3'。
1.3.4 Western blotting 检测自噬相关信号通路p-AMPK/AMPK、LC3Ⅱ/GAPDH、P62/GAPDH蛋白表达
收集心肌细胞后,加入100 μl 裂解缓冲液,冰水浴置2 h,期间轻摇振荡。然后于4℃,12 000 r·min-1离心10 min,取上清液。应用Bradford 法检测蛋白浓度。每孔上样50 μg,滴加SDS 缓冲液,加热至沸点约5 min,在通过含有10% SDS-聚丙烯酰胺的凝胶电泳而分离蛋白质,将分离的蛋白转印到NC 膜,并将Tris缓冲盐溶液冲脱脂奶粉稀释至5%浓度封闭液,在25℃下封闭2 h,再加入相应抗体(1∶700)于4℃孵育放置12 h,用Tris 缓冲盐溶液反复洗膜3 次,最后滴入相应过氧化物酶印记的羊抗兔IgG 二抗(1∶4 000),在25℃下放置1 h,重复上述洗膜过程3 次,每次10 min。组后用ECL 发光显色,使用凝胶成像仪进行拍摄、描绘并进行灰度分析。以目的蛋白与β光显色,使用的吸光度比值表示目的基因在蛋白水平的表达。
1.4 统计学处理
使用SPSS19软件进行统计学分析,计量资料用均数± 标准差(±s),多组间均数的比较采用One-way ANOVA分析,P<0.05差异有统计学意义。
2 结果
2.1 血管紧张素Ⅱ诱导H9C2 心肌细胞肥大能力与浓度正相关
用浓度梯度(0、10-8、10-7、10-6mol·L-1)的AngⅡ处理H9C2 心肌细胞,48 h 后用荧光显微镜观察免疫荧光染色下心肌细胞变化情况。结果如图1所示:AngⅡ处理的H9C2 心肌细胞的细胞核与表面积增大,且这种改变与AngⅡ的浓度有剂量相关性,以10-6mol·L-1浓度的AngⅡ诱导能力最强(故后续实验我们均采用10-6mol·L-1的AngⅡ诱导心肌细胞肥大)。
2.2 小檗碱逆转心肌细胞肥大具有浓度依赖性
用不同浓度(0.5、5、50 μmol·L-1)小檗碱处 理H9C2 心肌细胞肥大模型(浓度为10-6mol·L-1的AngⅡ诱导),48 h后荧光显微镜观察免疫荧光染色下心肌细胞变化情况。结果如图2 所示,随着小檗碱浓度的增加,心肌细胞核与表面积逐渐缩小。这证明小檗碱可以逆转心肌细胞肥大,且这种作用与小檗碱的浓度正相关。
2.3 H9C2 心肌细胞肥大模型LncRNA-MIAT 表达增加,小檗碱处理后LncRNA-MIAT的表达下调
为了增加实验的成功率,我们选择了两条目标LncRNA(LncRNA-MIAT、cardiac hypertrophy-related factor,LncRNA-CHRF),然后用qPCR 技术对心肌细胞进行检测。结果如图3、图4 所示:上述2 条lncRNA在肥大的心肌细胞中均出现过表达,与正常的H9C2心肌细胞相比,其LncRNA-MIAT、LncRNA-CHRF 数量差异具有统计学意义(均P<0.01),因此,可认为LncRNA-MIAT、LncRNA-CHRF 可能是潜在的导致心肌细胞肥大的基因靶点。在用不同浓度(0.5、5、50 μmol·L-1)的小檗碱处理后,与心肌细胞肥大模型组相比,LncRNA-MIAT和LncRNA-CHRF的表达均出现有意义的下调(P<0.05),且以LncRNA-MIAT 表达差异最为显著(P<0.01),并且LncRNA-MIAT 的表达水平与小檗碱的给药浓度呈现负相关的关系(后续实验均使用50 μmol·L-1小檗碱);因此,我们认为小檗碱通过下调LncRNA-MIAT 的表达是其抑制心肌细胞肥大的机制之一。
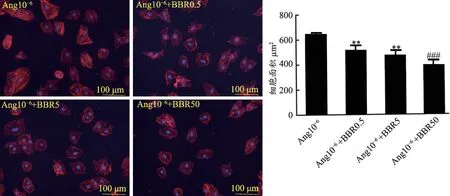
图2 不同浓度小檗碱逆转心肌细胞肥大能力
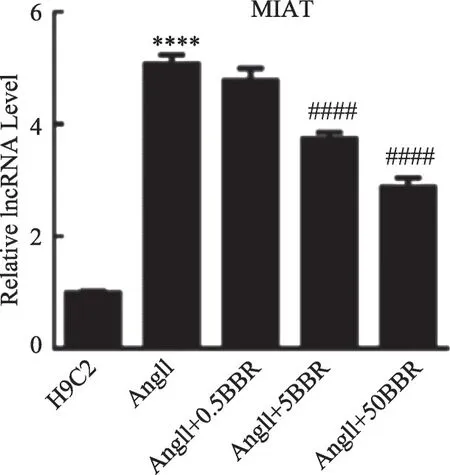
图3 lncRNA-MIAT表达情况
图4 lncRNA-CHRF表达情况
2.4 干扰LncRNA-MIAT后心肌细胞肥大出现逆转
进一步验证LncRNA-MIAT 与心肌细胞肥大的关系,用siRNA 技术干扰H9C2 心肌细胞肥大模型,免疫荧光染色后用荧光显微镜观察,结果如图5 所示:siModel 组与NC 组比较,心肌细胞细胞核与表面积均明显增大,而siMAIT 组与siModel 相比,心肌细胞细胞核与表面积明显缩小。这进一步证明了LncRNAMIAT 可以诱导心肌细胞肥大,干扰LncRNA-MIAT 功能后心肌细胞肥大可出现一定程度逆转。
2.5 沉默LncRNA-MIAT 后H9C2 心肌细胞自噬活性增加
用Western blot 检测自噬通路相关蛋白p-AMPK/AMPK、LC3II/GAPDH、P62/GAPDH 比率。结果如图6所 示:siModel 组 与BBR 组比较,p-AMPK/AMPK、LC3II/GAPDH 比值缩小,P62/GAPDH 比值增大,提示心肌肥大时自噬活性减弱,差异具有统计学意义(P<0.05);图C 中,siRNA-MIAT 组与BBR 组比较,siRNAMIAT 组P62/GAPDH 比值下调(P<0.05),与siModel组比较,siRNA-MIAT 组P62/GAPDH 比值显著下调(P<0.01),均具有统计学差异。在图D、E 中,siRNAMIAT 组与BBR 组及siModel 组比较,质粒siRNAMIAT 转染后p-AMPK/AMPK、LC3II/GAPDH 比值出现显著上调,差异具有统计学意义(均P<0.01)。qPCR技术检测LncRNA-MIAT 表达水平,结果如B 所示:siRNA-MIAT 组 及BBR 组与siModel 组比较LncRNAMIAT表达量明显下调(P<0.01)。这提示心肌细胞肥大时细胞自噬活性减弱,下调LncRNA-MIAT 能改变AMPK、LC3Ⅱ、P62的活性增强AngⅡ诱导的心肌肥大细胞自噬,小檗碱抑制心肌细胞肥大的机制可能是其通过下调LncRNA-MIAT 的表达增强自噬活性实现的。
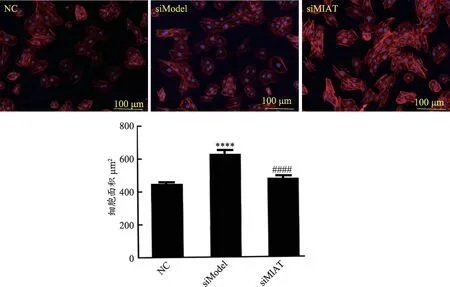
图5 siRNA技术干扰后的心肌细胞肥大情况
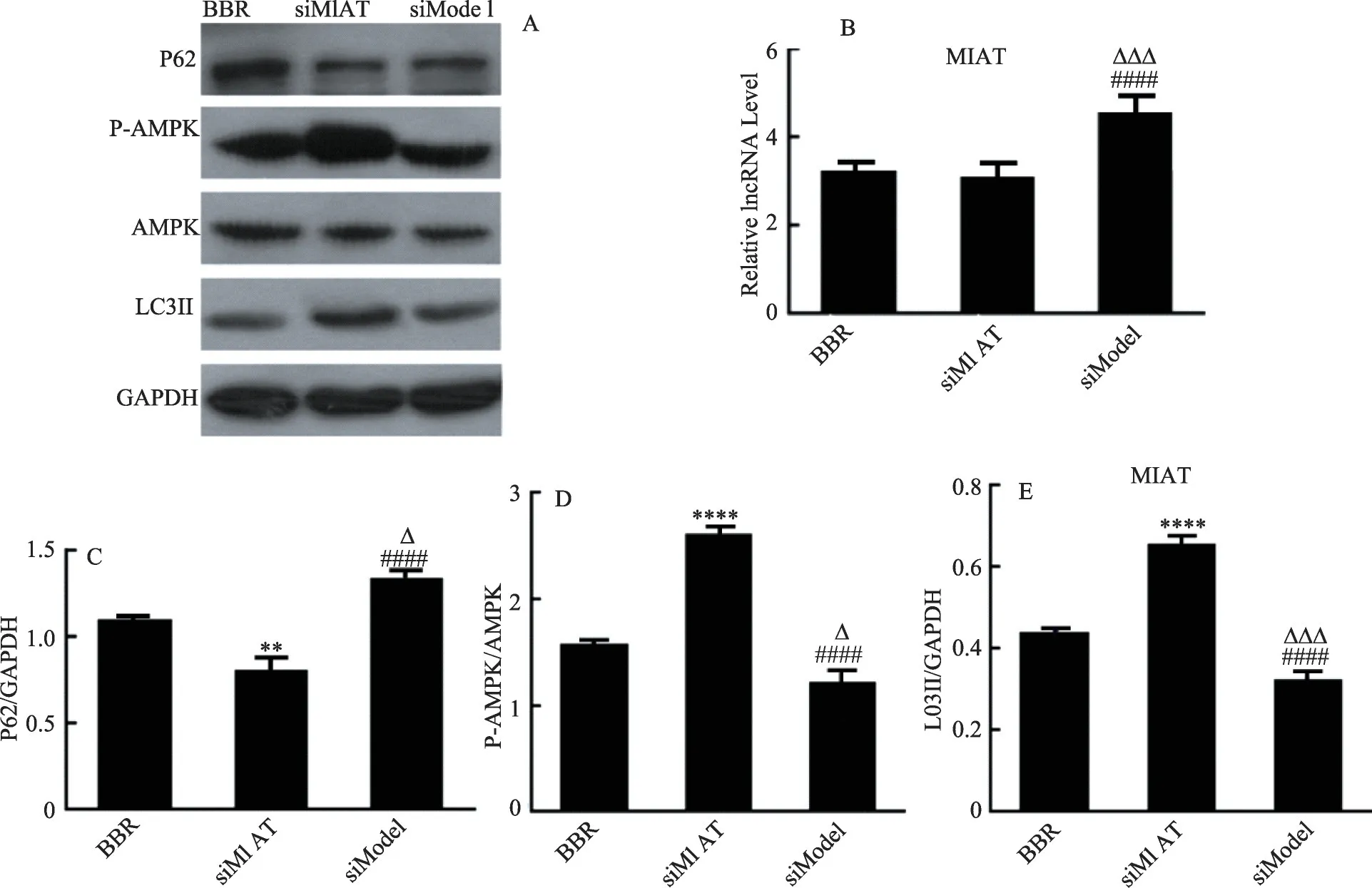
图6 Western blot检测p-AMPK/AMPK、LC3Ⅱ/GAPDH表达水平
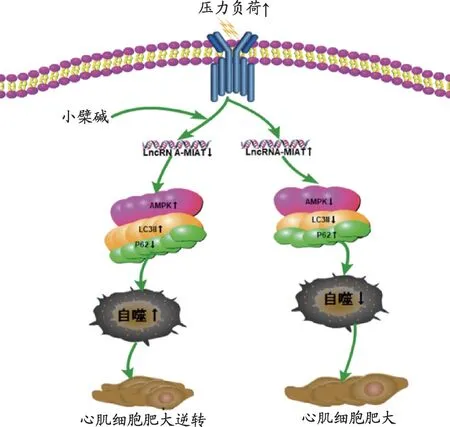
图7 AngⅡ模拟的压力信号上调了LncRNA-MIAT表达,作用于AMPK、LC3II、P62,使细胞自噬下降,心肌细胞的细胞核与表面积增大;小檗碱在压力负荷增加情况下,通过下调Ln⁃cRNA-MIAT,使AMPK、LC3II活性增加,P62活性降低,进而使心肌细胞自噬增强,心肌细胞的细胞核和表面积缩小。
3 讨论
心肌肥大是心肌细胞在外界刺激下所做出的代偿反射,当这种代偿到了一定阶段,心脏就会出现结构与功能的改变,表现为心室重塑和心功能下降,因此深入去探讨心肌肥大的病理机制与基因靶点,研究和开发抑制心肌肥大的新药物与治疗手段,对于心衰防治具有重要意义。人们对心衰治疗的探索几经波折,目前的治疗旨在改善衰竭心脏的生物学特性,应用血管紧张素转化酶抑制剂、β受体阻滞剂等在内的神经内分泌抑制剂拮抗心室重构,以降低心衰的病死率和住院率[8]。当前一种新药沙库巴曲/缬沙坦(血管紧张素受体脑啡肽酶抑制剂)被欧洲心脏病协会及加拿大心血管病协会新指南推荐用于心衰治疗,在降低心衰死亡和住院风险方面,被认为有优于依那普利的治疗效果,给心衰治疗带来新希望,但是其长期使用的安全性和疗效的稳定性仍然需要临床实践的检验[9,10]。而中医药经过长期临床积累,发现部分方药确能治疗心力衰竭,展现出了价廉效优、毒副作用小的独特优势。其中一种归属于毛茛目的草本植物,其根茎入药就是传统中药黄连,具有清利湿热,泻火解毒的功效,通过不同炮制方法,黄连功效侧重点不同,酒制善清上焦火热,姜制善清胃止呕,萸制则舒肝和胃。《本草经解》谓其:味苦无毒,得地南方之火味,入手少阴心经,气味俱降,阴也。所以善清心火,治心病[11]。药理学研究发现其治病的主要成分就是小檗碱。小檗碱具有抑菌、抗血小板、降糖、降压、拮抗心室重构、保护心肌等多种作用[12,13],有研究发现小檗碱对于正常的H9C2 心肌细胞无影响,但在缺氧复氧诱导的H9C2 心肌细胞中,细胞的活力随着小檗碱的给药剂量的增加而增加[14]。我们的研究用不同浓度的小檗碱处理H9C2心肌细胞,发现小檗碱可以逆转AngⅡ诱导的细胞肥大,且小檗碱抑制心肌细胞肥大的作用具有浓度依耐性的特点。
LncRNA 是一类长度大于200 个核苷酸的非编码RNA,具有调节基因转录、促进转录因子激活等多种生物学功能。近年来,LncRNA 与心衰的关系是临床研究热点。其在心衰应用中的巨大潜力在于:它一方面可能成为一种高敏感、高特异性检测心衰的生物学标志。例如,有学者检测了心衰小鼠的心脏、血浆及全血中LncRNA 的变化,发现有32 组LncRNA 存在特征性表达,并认为LncRNA 可能成为心衰的潜在生物标志物[15]。另一方面,LncRNA 在分子水平上有着强大的调控力,可以调控细胞的稳态并进一步影响疾病发展,其作为药物靶点的临床运用潜力巨大。Viereck J 在小鼠心衰模型与主动脉狭窄所致的心衰患者中均发现LncRNA-Chast 显著表达,在沉默Chast后,小鼠心室重构情况得到改善[4]。Tao H 等人的研究发现LncRNA 在包括心肌纤维化等多种疾病中表达,通过上调LncRNA-GAS5 可以负向调控miR-21 的表达,从而抑制心肌纤维化,改善心室重构[16]。我们的研究通过qPCR 技术证实了LncRNA-MIAT 在肥大的心肌细胞模型中表达增加,用siRNA 技术干扰LncRNAMIAT 后,发现心肌细胞肥大出现逆转,证明其能诱导心肌细胞肥大。进一步研究用小檗碱处理肥大的心肌细胞,发现LncRNA-MIAT 表达下调,心肌细胞肥大情况改善,这表明小檗碱可以通过下调LncRNAMIAT的表达抑制心肌细胞肥大。
自噬是细胞器及细胞内容物利用溶酶体被降解过程的统称,生理状态下,细胞自噬处于较低水平,其目的在于清除衰老受损的细胞器;在病理状态下,自噬会显著激活,在稳定细胞形态及结构,维持细胞正常生理功能方面起着重要作用。自噬水平的调节受自噬基因和蛋白的控制,AMPK 是生物能量代谢的关键调节激酶,LC3Ⅱ是哺乳动物细胞自噬的标记蛋白之一,其可以通过泛素样修饰作用定位于自噬小体中,其含量的高低与自噬水平呈正相关关系[17]。研究发现AMPK 激活促进了下游自噬标志蛋白LC3Ⅱ的激活,使心肌细胞逐渐适应慢性缺氧等病理状态[18-19]。P62 是LC3 下游的结合蛋白,可以看做是自噬的降解底物,其含量高低与自噬水平负相关[20]。心肌肥大与自噬关系密切,经敲除自噬相关基因Atg5和Atg7,在血管紧张素Ⅱ和异丙肾上腺素诱导的压力超负荷动物模型中,自噬受到抑制,明显加速心肌肥大及心衰的进程[21-22]。我们对比了心肌细胞肥大模型和用小檗碱、干扰质粒siRNA-MIAT 处理的心肌细胞肥大模型中自噬通路的标志蛋白表达情况,发现与对照组相比,经小檗碱、干扰质粒siRNA-MIAT 处理的模型组的p-AMPK/AMPK、LC3II/GAPDH 比值增加,P62/GAPDH比值下降,这表明LncRNA-MIAT 使AMPK、LC3Ⅱ的活性下降,P62 活性增加,进而使心肌细胞自噬减弱,这种作用经沉默LncRNA-MIAT 或使用小檗碱干预后出现一定程度逆转,表明小檗碱抑制心肌细胞肥大的作用,可能是其通过下调LncRNA-MIAT 的表达,使AMPK、LC3Ⅱ活性增加、P62 活性下降而促进心肌细胞自噬实现的。这种机制总结如图7。
综上所述,我们初步探明了小檗碱/LncRNAMIAT/AMPK/LC3Ⅱ/P62/心肌细胞肥大之间的关系。因此我们认为小檗碱下调LncRNA-MIAT 的表达水平抑制心肌细胞肥大,与其增加AMPK、LC3Ⅱ的活性,减弱P62 活性,进而促进心肌细胞自噬逆转心肌肥大,这可能是小檗碱治疗心衰有效的主要机制之一,对中医探索新的方法治疗心衰具有重要意义。然而多种LncRNA 与心肌肥大存在关系,自噬过程也受多个基因调控。但是限于条件与经费所限,我们并没有深入去挖掘是否存在其它LncRNA 在小檗碱抑制心肌肥大的过程中出现有意义的表达,也没有进一步探讨更多的自噬基因与这些LncRNA 的关系。下一步的实验我们将对其做进一步探讨。
