藿香对营养性肥胖大鼠降脂的作用及其代谢组学研究*
2019-03-06孙慧娟严小军刘红宁胡星遥卢晓南张启云尚广彬
张 洁,孙慧娟,严小军,刘红宁,胡星遥,卢晓南,张启云,尚广彬
(江西中医药大学/中医基础理论分化发展研究中心 南昌 330004)
随着社会和经济的发展,人类的饮食结构发生巨大的改变,朝着快速、营养、美味、多元化等方向发展。现代的高脂、高糖的饮食习惯导致营养性肥胖日益增多[1]。据研究统计发现,我国肥胖人数高达9 000 万,超重人数超过两亿[2,3]。肥胖症是一种由多因素引起的慢性代谢性疾病,其中营养过剩造成的营养性肥胖占多数[4],它是高脂血症、心脑血管疾病、2 型糖尿病、高血压、高尿酸血症、关节炎、癌症、骨端软骨症等慢性病的重要诱导因素,肥胖症的存在增加了患病风险,危害着人类健康[5-7]。
中医认为营养性肥胖是由于人们喜食肥甘厚腻之品、恣食生冷、内伤脾胃、脾失健运、湿浊生于内、痰湿积聚过多而形成的。肥胖的主要病理因素是“内湿”,治宜芳香化湿。
藿香是临床上常用的芳香化湿药,其味辛,温,归脾、胃、肺经,化湿醒脾,辟秽和中,解暑。《本草正义》中记载“藿香,清芬微温,善理中州湿浊痰涎,为醒脾快胃,振动清阳妙品”。现代药理学研究表明:藿香及其挥发油可以增加胃酸的分泌,调节胃肠道功能[8,9];有调节免疫的作用[10];有抗菌抗炎、镇痛作用[11];有止咳、化痰的作用[12]。但对藿香的芳香化浊、化痰降脂的作用研究较少。
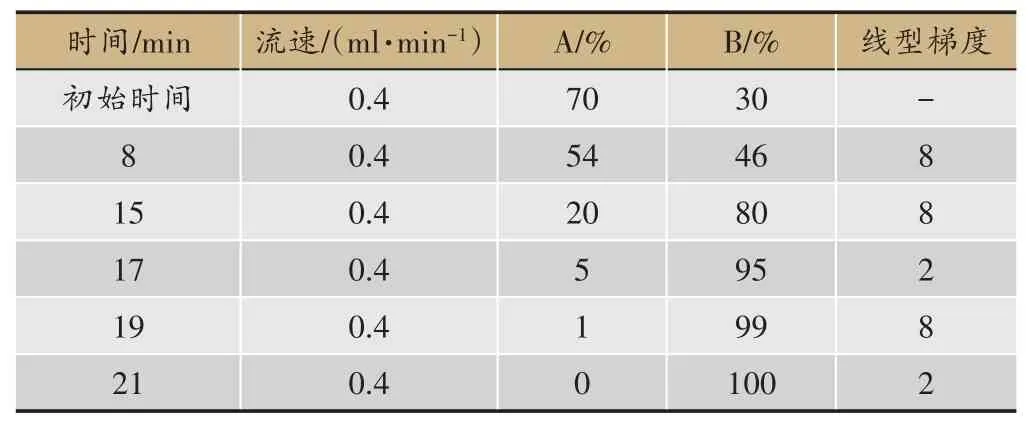
表1 梯度洗脱条件
代谢组学检测方法是通过在生物系统受到干预后测量体液中代谢产物的变化,可以识别和反映在疾病和药物影响下代谢网络的变化。它是从整体“生化表型”中掌握生物体的功能状态,并且与中医的“整体概念”本质上相容[13,14]。本研究运用代谢组学的方法研究芳香化湿药藿香干预的由饮食肥甘厚腻之品导致湿浊内生、痰湿积聚形成的营养性肥胖的降脂作用,从系统的角度分析藿香干预营养性肥胖大鼠的内源性物质代谢的变化并分析其代谢途径,应用现代科学语言阐述“内湿”的表征,对内湿证进行初步探索,为临床营养性肥胖防治提供实验依据,为内湿证提供理论支撑。
1 材料与方法
1.1 实验药物
藿香(江中中药饮片有限公司,批号:160317)。药物鉴定由本校中药鉴定教研室按2015版《中华人民共和国药典》标准鉴定,取藿香饮片500 g,加入5 L 的水,浸泡2 h,连接挥发油提取装置,大火煮沸后转小火煮15min,煮2 次,合并药汁,浓缩为1 g·mL-1,接取挥发油4℃保存。
1.2 实验动物
SPF 级雄性SD 大鼠,体质量120 ±10 g(湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2016-0002)。
1.3 实验材料
高脂饲料购自美国Research Diets 公司(货号:D12492),胆固醇(CHOL)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、葡萄糖(GLU)试剂盒购自南昌百特生物公司(批号:160201),甲醇(德国默克公司,货号:67-56-9),乙腈(德国默克公司,货号:JA031331)。
1.4 主要仪器设备
安捷伦高效液相质谱(美国Agilent,6538),全自动生化分析仪(美国Beckmancoulter,AU480),台式离心机(美国thermo,LYNX-6000),旋转蒸发仪(瑞士BUCHI,RE-220 SE)。
1.5 方法
1.5.1 建立模型、分组及给药
30 只雄性SD 大鼠,按体重随机分为正常组10 只喂以普通饲料、造模组20 只喂以高脂饲料,动态检测大鼠体重和Lee's 指数,Lee's 指数是目前在评价成年大鼠肥胖程度方面的有效指数计算,公式为LEE'S INDEX=3√(体重x1000)/体长。造模4 周后,检测大鼠生化指标。根据大鼠体重、Lee's指数和TG 含量,建立营养性肥胖大鼠模型[15,16],造模成功后,以造模组大鼠血清中TG 含量和体重为参考指标,将造模组随机平均分为模型组和藿香给药组。藿香干预4 周,用移液枪将藿香挥发油混悬液均匀加入每次灌胃剂量药汁中摇晃均匀,药物剂量为每天3 g.kg-1(根据体表面积方法换算大鼠剂量),加热至37℃进行灌胃。正常组、模型组喂每天3 g.kg-1的生理盐水。给药4周后检测大鼠血清中TG、CHOL、HDL-C、LDL-C、GLU含量。
1.5.2 血清代谢组学检测
取样品50 μL于1.5 mL离心管中,加甲醇150 μL,涡旋1 min,4℃静置3 h,4℃离心10 min•15 000 rpm-1,取上清,氮吹,加入15%甲醇溶液100 μL 复溶,涡旋1 min,4℃离心15min•18 000 rpm-1,取上清液检测分析。
色谱采集:色谱柱为Poroshell 120EC-C18柱;柱温35℃,样品室温4℃,流速0.4 mL•min-1,进样量5 μL;流动相0.1% 甲酸水溶液(A)-乙腈(B),洗脱条件见表1。
质谱条件:离子源:双电喷雾离子源(Dual ESI),正离子扫描;毛细管电压:4000 V;毛细管出口电压:120 V;锥孔电压:65 V;扫描范围:100-1000 m/z;干燥气温度:350℃;干燥气流速:10 L•min-1。
实验样品采用UPLC-Q-TOF MS 检测分析,运用MPP 软件对总离子流图分析找出精确的分子量、保留时间和峰面积。通过主成分分析法查找差异化合物。
代谢途径分析:利用MetaboAnalyst 软件(https://www.metaboanalyst.ca)和KEGG 数据库(https://www.kegg.jp)对化合物进行Pathway 分析,找出有统计学差异的代谢通路。
1.5.3 统计学方法
采用方差分析法,P<0.05 有统计学意义;应用GraphPad Prism8.0 软件对实验数据进行分析,计数资料用(±SD)表示。
表2 各组动物体重动态变化(±s,正常组n=10,造模组n=20)
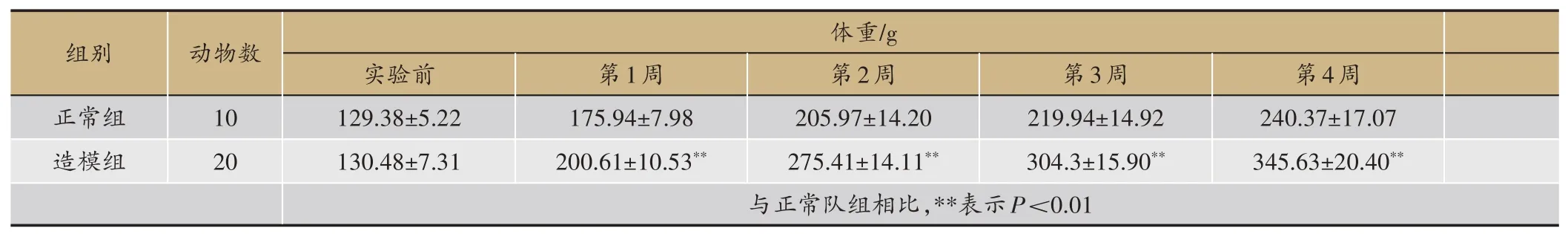
表2 各组动物体重动态变化(±s,正常组n=10,造模组n=20)
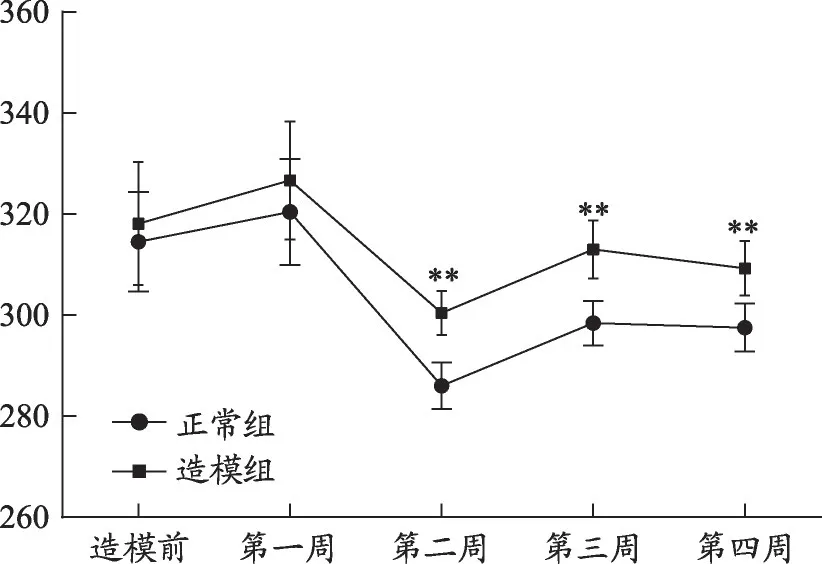
图1 造模4周大鼠的Lee's指数的变化(正常组n=10,造模组n=20)
2 结果
2.1 建立营养性肥胖大鼠模型
正常组、造模组大鼠的体重和Lee's指数动态变化(表2、图1),结果显示:造模1 周后,造模组的大鼠体重明显高于正常组(P<0.01);造模2 周后Lee's 也显著高于正常组(P<0.01)。造模第4周,造模组的大鼠体重、Lee's 指数,血清TG、GHOL、HDL-C、LDL-C、GLU 的含量与正常组相比具有显著性差异(P<0.01),见图2,模型建立成功。
2.2 藿香对大鼠生理生化指标的影响
藿香给药组药物干预4 周,实验结果显示:体重、Lee's 及血清中CHOL、HDL-C、LDL-C 和GLU 无明显改变(P>0.05),但血清中TG 含量明显下降(P<0.01)(图3)。
2.3 藿香干预营养性肥胖大鼠的代谢组学研究结果
2.3.1 血清代谢物谱的UHPLC-Q-TOF-MS分析

图2 造模4周正常组与模型组相比血清中TG、GHOL、HDL-C、LDL-C的含量变化(正常组n=10,造模组n=20)
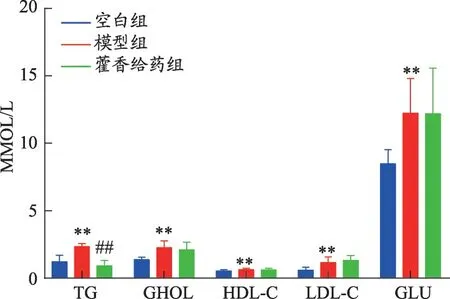
图3 藿香对营养性肥胖大鼠血清中TG、CHOL、HDL-C、LDL-C、GLU
正离子扫描模式下,对比各组总离子流图发现:3组色谱峰保留时间基本相同,峰的高度具有显著性差异,大鼠血清中代谢模式发生了显著性的变化;与正常组相比,模型组的相同时段峰的高度多处高于正常组,在11-17.5 s 之间最为明显;藿香给药组与模型组相比,在11.2 -13.9 s 时间段峰的高度降低最为显著,显示各组间代谢物质发生了显著性的改变。各组大鼠血清总离子流图谱见图4。
2.3.2 PCA聚类分析
主成分分析法(Principal Component Analysis,PCA),将多个变量通过线性变换以选出较少个数重要变量的一种多元统计分析方法。将复杂数据降维,揭示隐藏在复杂数据背后的简单结构[17],通过PCA 分析发现:各组自聚成一类,区分明显,说明造模及给药之后,大鼠血清中内源性代谢产物发生了显著变化(图5)。
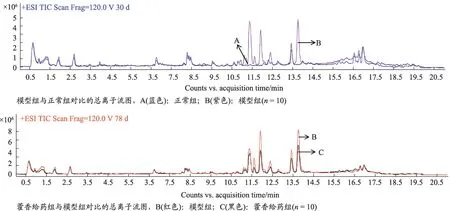
图4 各组动物血清UHPLC-Q-TOF正模式扫描总离子流图

图5 各组动物血清代谢数据分析的PCA得分图(n=10)
2.3.3 潜在生物标记物的分析
对各组大鼠的血清中代谢物检测所得的总离子流图进行分析查找差异性化合物,结果显示:藿香干预4 周后,营养性肥胖大鼠血清中查找出10 种3 组共有的内源性差异化合物(表3)。
2.3.4 代谢通路分析
分析差异化合物,匹配出11 条代谢途径,如图6所示:图中圆圈代表发挥作用的通路,颜色越深则P值越小。根据P<0.05 筛选出4 条有统计学差异的代谢途径,分别是:氨酰基-tRNA 生物合成、苯丙氨酸,酪氨酸和色氨酸生物合成、鞘脂代谢、酪氨酸代谢(表4)。
3 讨论
高脂诱导的营养性肥胖大鼠模型的病理机制与临床上“湿阻中焦、脾失健运”营养性肥胖相似,治宜芳香化湿,醒脾健运。藿香是芳香化湿类常用药,具有化湿醒脾,辟秽和中,解暑,发表之功,既往的药理学研究多集中在其抑菌、增强胃肠动力方面。本研究结果表明藿香干预营养性肥胖大鼠能够降低血清中TG 含量(P<0.01),改善了营养性肥胖大鼠的体内脂质代谢。通过血清代谢组学进一步分析发现藿香干预营养性肥胖大鼠4 周后,查找出10 种内源性潜在生物标记物,分别是:神经酰胺、植物鞘氨醇、胞嘧啶、吲哚丙烯酸、泛酸、蛋氨酸、色氨酸、酪胺、酪氨酸、尿素等。对代谢通路分析发现,这10种差异化合物主要通过苯丙氨酸,酪氨酸和色氨酸生物合成、氨酰基-tRNA生物合成、酪氨酸代谢、鞘脂代谢4种代谢途径发挥降脂作用,通路关系见图7。
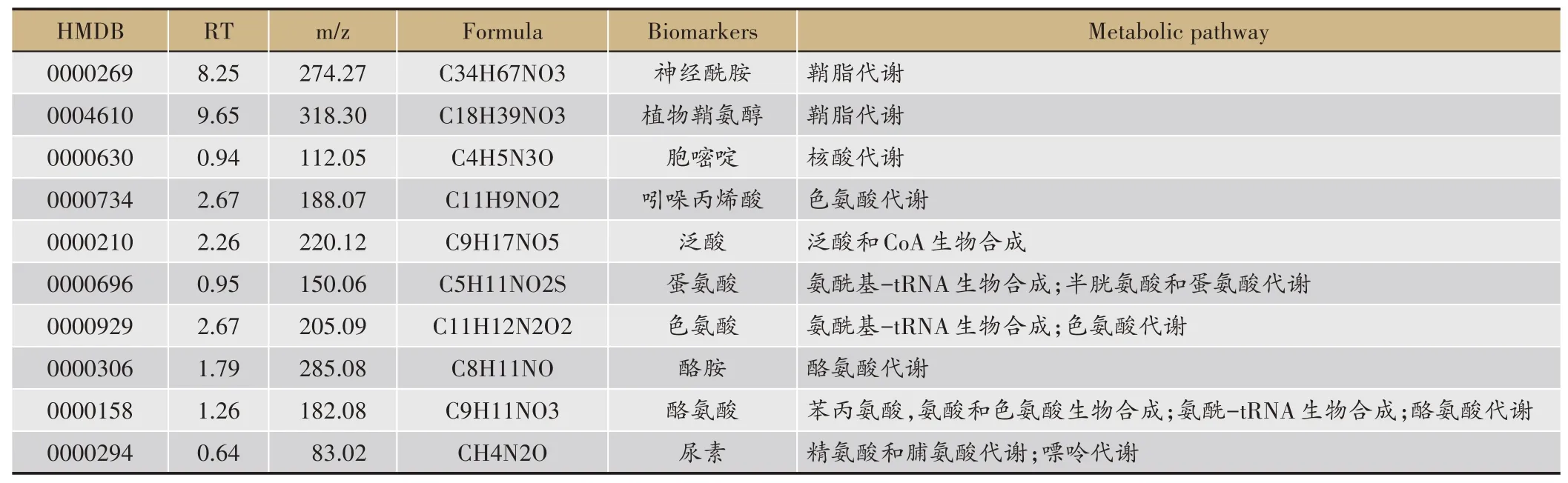
表3 藿香干预营养性肥胖大鼠4周血清中的内源性差异化合物
苯丙氨酸、酪氨酸和色氨酸生物属于芳香族氨基酸,是人体必需氨基酸与营养性肥胖关系密切。在体内经苯丙氨酸羟化酶催化作用氧化成酪氨酸,并合成神经递质和激素,干预机体的糖脂代谢[18]。酪氨酸是一种重要的营养必需氨基酸,Akinkunmi Paul Okekunle等研究表明酪氨酸与肥胖风险呈负相关[19]。
酪氨酸在酪氨酸转氨酶的催化下,生成对-羟苯丙酮酸,经尿黑酸等中间产物转变成延胡素酸和乙酰乙酸参与糖脂代谢[20]。S Bel-Serrat 等研究发现色氨酸、酪氨酸的摄入量与TC/HDL-c 比率之间呈负相关[21]。色氨酸的代谢产物5-羟色胺能够调节下丘脑中枢,减少了动物的进食量,减少能量的摄入,减少脂肪堆积[22,23]。
神经酰胺在营养性肥胖形成过程中起到了至关重要的作用。神经酰胺能够介导的胰腺β细胞的凋亡并抑制β细胞分泌胰岛素,加重肥胖[24]。减少神经酰胺的合成,能够干预脂代谢减少脂肪堆积[25]。
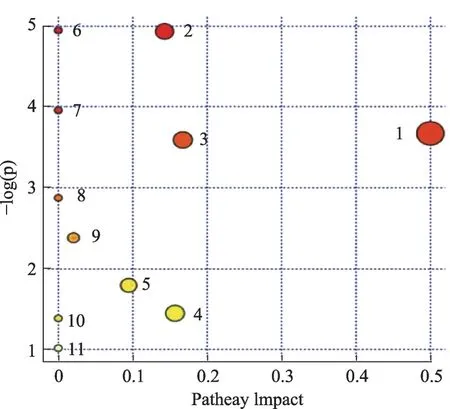
图6 通过Metabo Analyst数据库得到的通路分析概要图
综上所述,芳香化湿药藿香干预营养性肥胖大鼠具有明显降低血清TG 含量的作用,其作用机制可能是通过干预蛋白质与氨基酸的合成代谢、脂质代谢等代谢途径发挥“化湿”降脂作用,从而干预营养性肥胖的发生、发展。本实验研究表明机体内的血清TG 含量是中医“内湿”的表征之一,芳香化湿药藿香可能通过调节能量代谢、脂代谢发挥“化湿”作用。
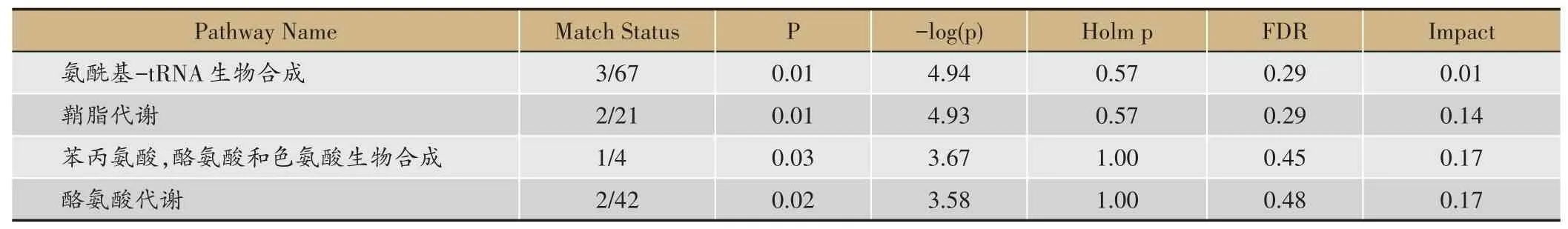
表4 MetaboAnalyst通路分析结果

图7 鞘脂代谢、苯丙氨酸,酪氨酸和色氨酸生物合成、酪氨酸代谢通路关系图
