非洲猪瘟的病毒检测
2019-03-05中国动物疫病预防控制中心
文│中国动物疫病预防控制中心
由于非洲猪瘟(ASF)缺乏预防用疫苗,为防止疫病的传播,就需要实施严格的卫生和生物安全控制措施,而这就依赖于疫病的快速、可靠的早期诊断。ASF的诊断是指确诊动物正在感染或者曾经感染过非洲猪瘟病毒(ASFV)。因此,适用的诊断技术包括检测和识别ASFV特异性抗原、DNA或抗体的技术,所获取的检测信息也是控制和根除计划的重要保障。在选择诊断技术时,分析疫病感染期非常重要(图1)。由于感染动物所处的感染期不同,因此在疫情和控制/根除计划中,需要同时检测病毒和抗体以确保准确性。
根据报道,ASF的自然感染潜伏期为4~19天。在临床症状出现的两天前,ASF感染动物开始散播大量病毒。病毒散播因所感染的ASFV毒株毒力不同而异。感染后约7~9天血清转阳,抗体阳性可持续终生(见图1)。
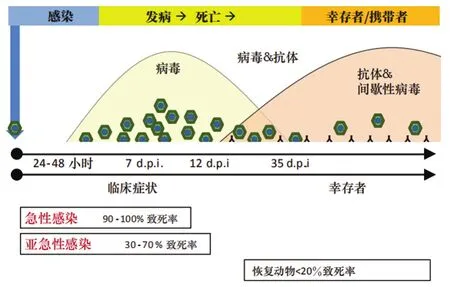
◎图1 伊比利亚半岛及西半球的欧洲家猪中观察到的血液中病毒和抗体随着时间的变化及与ASFV感染不同阶段的关系(1960—1995年)
病原学检测为阳性(即抗原)则表明,所检测的动物在取样时正在发生感染。而抗体检测阳性则表明感染正在或者已经发生,包括感染后已经恢复的动物(且可能终身保持血清阳性)。
自2015年底以来,东欧血清学流行病学调查数据显示血清学阳性动物的检出率显著增加,特别是在发生疫情的欧盟国家的野猪群体中尤为明显。这些结果表明,ASF感染耐过动物可存活超过一个月并可能出现亚临床感染的病例,就像在伊比利亚半岛、美洲和非洲之前所描述的情况。因此,抗体检测技术对于实施控制和根除计划所需的完整信息而言是必要的。
一、应用聚合酶链式反应(PCR)检测非洲猪瘟病毒基因组
PCR已成功应用于猪样品(血液、器官等)和蜱中ASFV基因组的检测。病毒DNA片段通过PCR扩增获得足以检测的量,从而实现检测。所有经过验证的PCR技术均可以在临床症状出现前实现检测。PCR能在样品到达实验室数小时内,完成ASF的诊断。PCR是可以代替病毒分离鉴定的一种灵敏、特异、快速的ASFV检测技术。同时,相比于抗原检测技术,如酶联免疫吸附试验(ELISA)和直接荧光抗体测试(FAT),具有更高的敏感性和特异性。需要注意的是,PCR 的高度敏感性使其容易发生交叉污染,应该采取适当的预防措施来减少和控制污染风险的发生。
OIE在《陆生动物诊断试验和疫苗手册》(2016年)中推荐使用的常规和实时荧光PCR得到了长期的充分验证,是常规诊断的重要工具。此外,除了OIE推荐的适用于康复动物ASF基因组检测的实时荧光PCR技术外,其他研究者建立的实时荧光PCR已经证实更为敏感。在这些分子技术中使用的引物和探针多以VP72编码区域作为靶基因设计,该基因片段是ASFV基因组中研究清楚,且高度保守的区域。应用这些PCR技术,即使在灭活或降解的样品中也可检测到已知所有22种p72病毒基因型的多个毒株。
对于特急性、急性或亚急性ASF感染病例,PCR是首选的检测技术。此外,由于PCR检测病毒基因组,即使病毒分离鉴定为阴性的,含有无感染性病毒粒子的样品,也可完成检测,这也使其成为用于检测感染低或中等毒力毒株的重要工具。虽然PCR不能提供病毒感染性的信息,但可以提供定量的信息。
二、非洲猪瘟病毒分离
病毒分离是将样品接种易感的猪源原代细胞、单核细胞和巨噬细胞而进行的检测。如果在样品中存在ASFV,则会在易感细胞中复制,在感染细胞中产生细胞病变(CPE)。细胞裂解和CPE通常在出现红细胞吸附现象的48~72小时后发生。ASFV的红细胞吸附试验是该病毒特有的检测技术,其他猪源病毒在白细胞培养物中不存在红细胞吸附特性。当病毒在这些培养物中复制时,多数ASFV毒株会产生红细胞吸附反应(HAD),在感染的白细胞周围吸附猪红细胞形成“玫瑰花环”(见图2)。
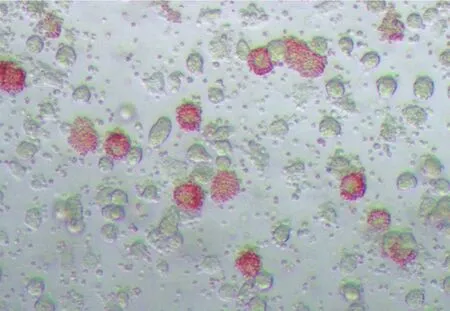
◎图2 红细胞吸附反应(HAD)
此外,需要说明的是,在没有发生红细胞吸附反应的时候出现CPE,可能是由于接种物的细胞毒性所致或者由于其他病毒(如伪狂犬病毒)感染或者由于不产生红细胞吸附反应的ASFV毒株导致。一旦发生这类情况,必须采用其他的病毒学检测技术(如FAT或PCR),检测细胞沉淀物是否存在ASFV。而如果细胞分离没有观察到任何变化,或者FAT和PCR检测为阴性,则需要将细胞培养上清-再次接种新的培养物种,连续传代3~5代,之后方可确认为ASFV阴性。
对于抗原检测(ELISA、PCR或FAT)为阳性的样品,推荐HAD为完成病毒分离和鉴定的参考试验。而如果通过其他方法已经证实ASF感染,特别是在首次暴发ASF的地区,也建议使用红细胞吸附试验鉴定病毒。此外,病毒分离对于进一步的分子生物学研究也是必要的基础。
三、直接荧光抗体法对非洲猪瘟抗原的检测
FAT可用于检测猪组织中的ASFV抗原。检测原理是通过显微观察感染脏器涂片或薄层冷冻切片上的病毒抗原实现的。使用异硫氰酸荧光素(FITC)结合的特异性抗体检测细胞内抗原。FAT也可用于检测未观察到HAD的白细胞培养物中的ASFV抗原,因此可以鉴定不产生HAD反应的ASFV毒株。FAT还可用于鉴别CPE是由ASFV感染导致的,还是由其他病毒感染或者导致的接种的细胞毒性导致的。
阴阳性对照是保证切片被正确判定的重要保障。该方法也是对特急性和急性ASF病例的高度敏感的检测技术,且可以非常快速地完成检测。虽然FAT是高效的检测技术,但目前已被PCR逐步取代,所需试剂也不再广泛使用。然而值得一提的是,在亚急性和慢性型感染中,FAT的敏感性明显降低(40%)。
四、ELISA对非洲猪瘟抗原的检测
使用ELISA检测病毒抗原,其成本比PCR更为低廉,并且可在没有特殊的实验室仪器设备的条件下,短时间内对样品的大规模筛查。然而,与FAT相似,对于亚急性和慢性病例,抗原ELISA的敏感性明显较低。同时,现地样品通常状态不佳,因此也降低了检测的敏感性。因此建议抗原ELISA(或其他ELISA)主要用于“群体”检测,并辅助以其他病毒学和血清学检测(见图3)。(注:本文节选自《联合国粮食及农业组织(FAO)动物生产及卫生手册》)
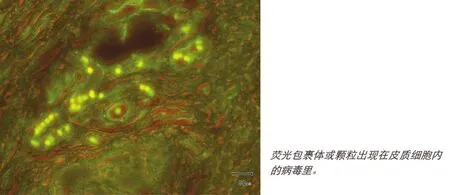
◎图3 FAT在ASFV感染的扁桃体中的定位检测
