烟草质膜ATPase4基因的克隆、表达载体构建及表达分析
2019-03-05李立芹
王 静,彭 双,胡 圣,卓 维,陈 倩,李立芹,*
(1.四川农业大学 农学院,四川 成都 611130; 2.作物科学国家级实验教学示范中心,四川 成都 611130)
质膜ATPase是植物细胞膜上非常重要的功能蛋白,被认为是植物细胞代谢和生命活动过程的主宰酶[1]。ATPase在细胞质膜上产生质子梯度,在植物生长发育中调节着许多生理过程[2]。根据位置及功能不同,植物细胞内的ATPase可分为F、P和V三大类型,其中F型ATPase主要分布在线粒体和叶绿体上,P型ATPase分布在质膜上,V型ATPase分布在液泡膜、内质网膜、溶酶体、高尔基体膜上[3]。ATPase在植物生长发育的各个时期以及胁迫响应等多种生理过程中行使重要功能[4]。近年来,关于植物ATPase基因的鉴定和功能研究取得了较大进展,ATPase由大约10个基因的家族编码[5]。Ayala等[6]研究表明,盐角草在200 mmol·L-1NaCl处理下,质膜ATPase活性增加。Binzel[7]发现盐胁迫下,番茄质膜ATPase蛋白表达量增加。也有研究表明,盐芥幼苗根、叶质膜ATPase活性在100~400 mmol·L-1NaCl处理下较对照均有不同程度的提高[8]。构树幼苗在100 μmol·L-1NaCl处理下,质膜ATPase活性达到最大值,在150 μmol·L-1NaCl处理下质膜ATPase活性有所降低,但均高于对照[9]。
烟草是我国非常重要的经济作物之一,而冷害、干旱、盐碱等非生物环境胁迫严重阻碍了烟草的产量与品质[10]。植物细胞中,质膜ATPase在细胞生长发育以及抗逆境胁迫中起着重要的作用[11]。越来越多的质膜ATPase基因被克隆,但烟草中编码质膜ATPase4蛋白的基因尚未报道。为此,本实验从烟草中克隆一个质膜ATPase4基因,运用生物信息学方法,预测ATPase4基因编码蛋白的结构和功能,同时运用qRT-PCR技术,分析该基因在烟草根、茎、叶、花等不同组织中的表达水平以及在低钾、PEG、高盐、冷胁迫等逆境下的表达模式,并成功构建ATPase4-pcambia1300过表达载体,以期为进一步研究烟草ATPase4基因的功能奠定基础。
1 材料与方法
1.1 材料及试剂
本实验使用的普通烟草品种为K326。大肠埃希菌感受态DH5α购自VazymeBiotech公司,Trizol试剂、RNA反转录试剂盒、高保真R045A酶、SYBR Green Master mix、DNA Ligation Kit 2.0等试剂购自TaKaRa,引物合成与测序由生工生物工程(上海)股份有限公司完成。
1.2 实验方法
1.2.1 材料处理
挑选籽粒饱满、大小一致的烟草种子用75%乙醇消毒1 min,然后20%次氯酸钠溶液消毒20 min,用无菌水反复清洗5~6次,在超净工作台内播种于MS培养基上,每个培养基上播种3排30粒左右,放置在16 h/8 h(光/暗),25 ℃的光照培养箱中培养15 d后,挑取长势一致的幼苗,在MS培养基上分别加入KCl(10 mmol·L-1)和5% PEG-6000、NaCl(200 mmol·L-1)进行低钾、干旱、高盐处理,同时将培养基放入4 ℃培养箱进行低温处理。处理0、3、6、12、24 h进行整株取样。
1.2.2 烟草ATPase4基因的克隆
参考GenBank收录的绒毛状烟草ATPase4序列(序列号:XM_016657566.1),采用同源克隆的方法,用Primer 5.0 软件设计引物全长引物ATPase4-F和ATPase4-R(表1)。扩增反应程序为:95 ℃预变性5 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸3 min;35个循环。目的片段纯化后与pMD19-T载体于16 ℃连接过夜,连接产物转化大肠埃希菌DH5α感受态。随后在涂有卡那霉素LB平板上进行筛选,菌落PCR检测筛选阳性克隆,送至上海生物工程有限公司进行测序。
1.2.3 烟草ATPase4基因的表达分析
根据基因序列,采用Primer Premier 5.0设计荧光定量(qRT-PCR)引物,以烟草18S rRNA为内参,引物序列为18S-F和18S-R(表1)。所有的样品都设置4个重复,反应结束后,基因相对表达水平用2-△△Ct方法进行计算。
1.2.4 构建过表达载体
重组克隆载体ATPase4-pMD19-T与表达载体pcambia1300用内切酶XbaⅠ和SmaⅠ进行酶切,酶切体系10 μL,含1 μL 10×T缓冲液,1 μL BSA,1 μLXbaⅠ,1 μLSmaⅠ,4 μLNtHA-pMD19-T/pcambia1300载体,2 μL ddH2O。回收纯化目的片段后与pcambia1300载体于16 ℃连接过夜,连接产物转化大肠埃希菌DH5α感受态,随后在涂有卡那霉素的LB培养基上进行筛选,菌落PCR检测筛选阳性克隆,摇菌提取质粒,酶切检测后送至上海生工生物工程有限公司进行测序。
1.2.5 烟草ATPase4基因生物信息学分析
利用ExPASyProtParamtoo分析ATPase4编码蛋白的理化性质;DNAMAN软件分析其编码蛋白的疏水性;运用IBCP的在线工具SOPMA预测ATPase4二级结构;SWISS-MODEL在线预测ATPase4的三级结构;SMART在线分析ATPase4基因编码蛋白氨基酸的结构域;NetPhos3.1 Server对蛋白进行磷酸化位点分析;PSORT预测ATPase4的亚细胞定位;Signal-P4.1 Server在线预测蛋白质信号肽;运用MEGA 7软件,采用邻近法构建系统进化树。
2 结果与分析
2.1 基因克隆
提取烟草叶片总RNA反转录合成cDNA,以cDNA为模板进行PCR扩增,琼脂糖电泳结果显示,在接近3 000 bp的位置上有清晰的条带(图1)。将该条带回收纯化后与载体pMD19-T进行连接,转化大肠埃希菌感受态。将鉴定出的阳性克隆随机挑选3个进行测序,结果显示,3个测序结果一致且目的片段大小为2 982 bp。
2.2 ATPase4-pcambia1300过表达载体的检测
表1引物序列
Table1Primer sequences
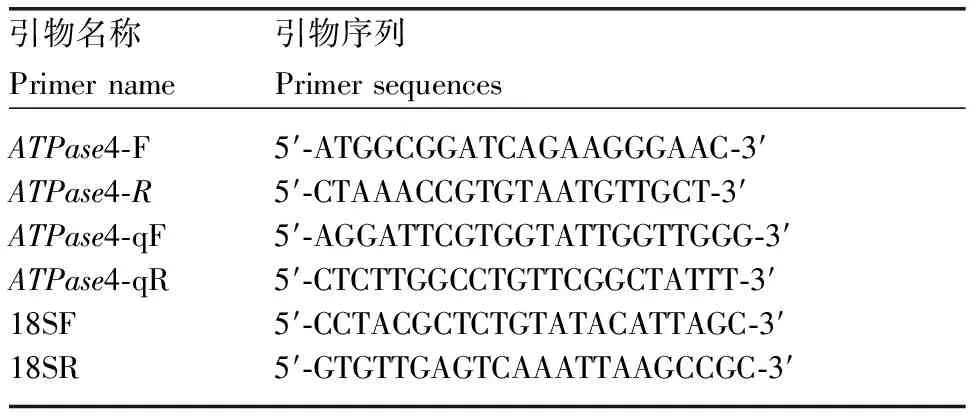
引物名称引物序列Primer namePrimer sequencesATPase4-FATPase4-RATPase4-qFATPase4-qR18SF18SR5′-ATGGCGGATCAGAAGGGAAC-3′5′-CTAAACCGTGTAATGTTGCT-3′5′-AGGATTCGTGGTATTGGTTGGG-3′5′-CTCTTGGCCTGTTCGGCTATTT-3′5′-CCTACGCTCTGTATACATTAGC-3′5′-GTGTTGAGTCAAATTAAGCCGC-3′

M,Marker 5 000 bp;1,ATPase4基因。M, Marker 5 000 bp; 1, ATPase4 gene.图1 ATPase4的克隆Fig.1 Cloning of ATPase4
将克隆载体ATPase4-pMD19-T与表达载体pcambia1300分别进行酶切,连接转化E.coli感受态,挑选单菌落进行菌落PCR,筛选构建成功的阳性克隆。利用菌落PCR筛选阳性克隆,1~8为阳性克隆,9为阴性对照(图2),阳性克隆在3 000 bp处有清晰的条带,而阴性对照没有该条带。挑取构建成功的阳性克隆,送上海生物有限公司进行测序,测序该目的条带结果大小为2 982 bp,证明ATPase4-pcambia1300载体构建成功。
2.3 ATPase4基因和蛋白序列分析
2.3.1 ATPase4的理化性质及疏水性分析
ATPase4编码蛋白的理化性质分析结果表明:含有20种氨基酸,丙氨酸Ala(94,9.8%)、精氨酸(94,9.8%)含量最高,而半胱氨酸Cys(7,0.7%)含量最少。蛋白预测的分子质量为105.88 ku,含有963个核酸残基,理论等电点pI为6.66,不稳定系数是34.76,该蛋白是一个稳定的蛋白。运用ProtScale(https://web.expasy.org/protscale)进行的疏水性分析结果显示,该蛋白总的亲水性平均指数为0.136,该蛋白属于疏水性蛋白(图3)。

M,Marker 5 000 bp;1~8,ATPase4基因;9,阴性对照。M, Marker 5 000 bp; 1-8, ATPase4 gene PCR product; 9, Negative control.图2 ATPase4过表达载体构建Fig.2 Construction of ATPase4 overexpression vector
2.3.2 ATPase4的二级、三级结构预测
如图4所示,利用IBCP(https://npsa-prabi.ibcp.fr)在线工具对ATPase4基因编码蛋白进行二级结构预测,发现该蛋白中41.12%的氨基酸参与α-螺旋(alpha helix),21.91%的氨基酸参与延伸链(extended strand),28.56%氨基酸参与无规则卷曲(random coil),有8.41%的氨基酸参与β-转角(beta turn)。所以,该蛋白二级结构的最大元件为α-螺旋(alpha helix)。运用SWISS-MODEL(https://swissmodel.expasy.org/)对ATPase4的三级结构进行分析,用RasTop软件进行显示,并将结果与二级结构分析进行对比,两者结果一致。
图3 ATPase4疏水区预测Fig.3 Prediction of hydrophobic region of ATPase4


A,二级结构;B,三级结构。A, Secondary structure; B, Tertiary structure.图4 ATPase4的结构预测Fig.4 Prediction of the structure of ATPase4
2.3.3ATPase4基因编码蛋白亚细胞定位及信号肽分析
利用PSORT(http://psort1.hgc.jp/form.html)预测的ATPase4亚细胞定位;Signal-P4.1(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白信号肽。结果表明,该基因在质膜上占0.800,在高尔基体膜占0.400,在内质网膜上占0.300,在微体(过氧化物酶体)中占0.300,因此,预测该基因可能定位在质膜上。根据神经网络方法或隐马氏模型方法预测信号肽位置及切割位点,利用mean-score来判断是否为分泌蛋白(图5),预测结果显示score值为0.093,小于0.5,说明该基因编码的蛋白不是分泌蛋白,所以不存在信号肽。
2.3.4 ATPase4编码蛋白磷酸化位点分析
利用NetPhos3.1(http://www.cbs.dtu.dk/services/NetPhos/)进行分析蛋白磷酸化位点,NetPhos3.1是利用神经网络预测真核细胞蛋白质中丝氨酸(Serine)、苏氨酸(Threonine)和酪氨酸(Tyrosine)磷酸化位点工具,NetPhos中的内设阈值为0.5,高于0.5则被认为是可能的磷酸化位点。NetPhos对ATPase4基因编码蛋白进行磷酸化位点分析显示(图6),ATPase4基因编码蛋白中含有36个丝氨酸(Ser)磷酸化位点、23个苏氨酸(Thr)磷酸化位点、6个酪氨酸(Tyr)磷酸化位点,说明该基因编码的蛋白能被激酶所磷酸化,进而参与逆境胁迫。
图5 ATPase4的信号肽预测Fig.5 Prediction of signal peptide of ATPase4

图6 ATPase4的磷酸化位点预测Fig.6 Prediction of phosphorylation site of ATPase4
2.3.5 ATPase4同源性分析
将ATPase4氨基酸序列进行Blastp序列比对,为进一步分析ATPase4蛋白与其他物种内质膜ATPase家族的蛋白相关性,将ATPase4氨基酸序列与其他物种进行比对(图7),结果显示,该烟草质膜ATPase4蛋白与其他物种质膜ATPase4蛋白序列之间具有高度的保守性。采用邻近法与不同物种做出系统进化树表明,烟草质膜ATPase4氨基酸序列与美花烟草和辣椒质膜ATPase4具有较高氨基酸序列相似性,分别为98%、94%;与榴莲和南瓜质膜ATPase4相似性较低,分别为82%和81%(图8),同源分析结果表明,该蛋白与其他物种的质膜ATPase4相似。
2.4 ATPase4的组织表达分析
提取幼苗K326的根、叶、花成熟期的总RNA,进行去除DNA基因组,然后反转录成cDNA,以cDNA为模板进行荧光定量PCR扩增,通过对ATPase4在各个组织的表达量分析(图9)的结果表明,ATPase4基因在根中表达量最高,叶和花中表达量较低。根中表达量约为叶的8.9倍,这说明ATPase4基因主要在烟草K326植株的根中表达。
2.5 ATPase4在逆境胁迫处理下的表达分析
分别选取经KCl(10 mmol·L-1)、5% PEG-6000、NaCl(200 mmol·L-1)以及4 ℃处理后的烟草K326幼苗,对其ATPase4基因的相对表达量进行分析。结果表明,在低钾和盐处理条件下,ATPase4相对表达量分别在6和12 h达到最大值,分别为对照(0 h)的1.73和5.09倍。ATPase4相对表达量在冷处理下受到抑制,是对照表达量(0 h)4 ℃处理24 h的1.99倍。这些结果表明ATPase4能够被逆境胁迫相关的信号分子调控,其表达量如图10所示。

图7 ATPase4蛋白多重序列比对Fig.7 Multiple sequence alignment of ATPase4

图8 ATPase4蛋白系统进化树Fig.8 Phylogenetic tree of ATPase4
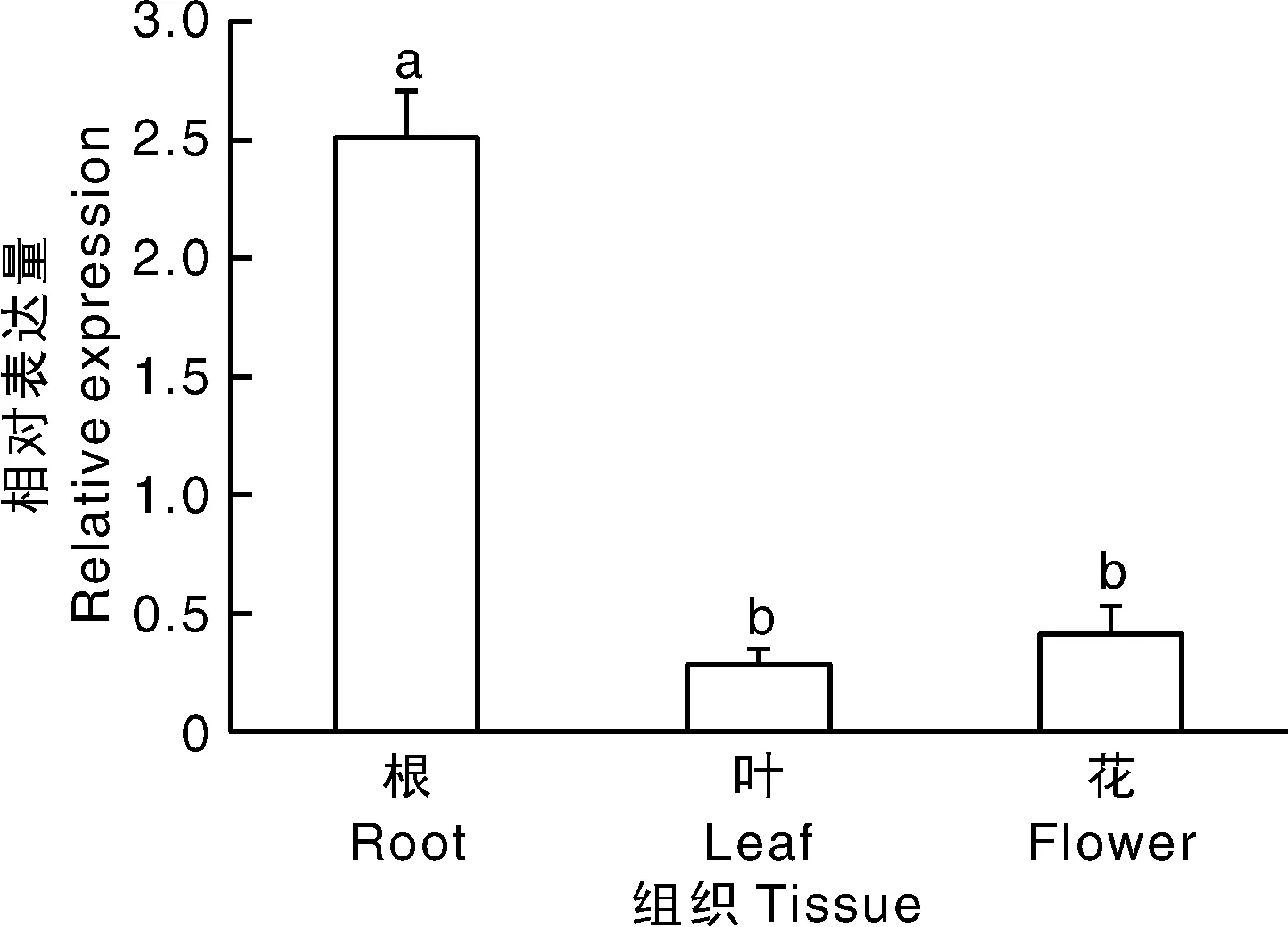
不同数据间没有相同小写字母表示差异显著(P<0.05)。The bars without the same lowercase letters showed the significant difference (P<0.05).图9 不同组织中ATPase4基因的相对表达量分析Fig.9 Relative expression analysis of ATPase4 in different tissues
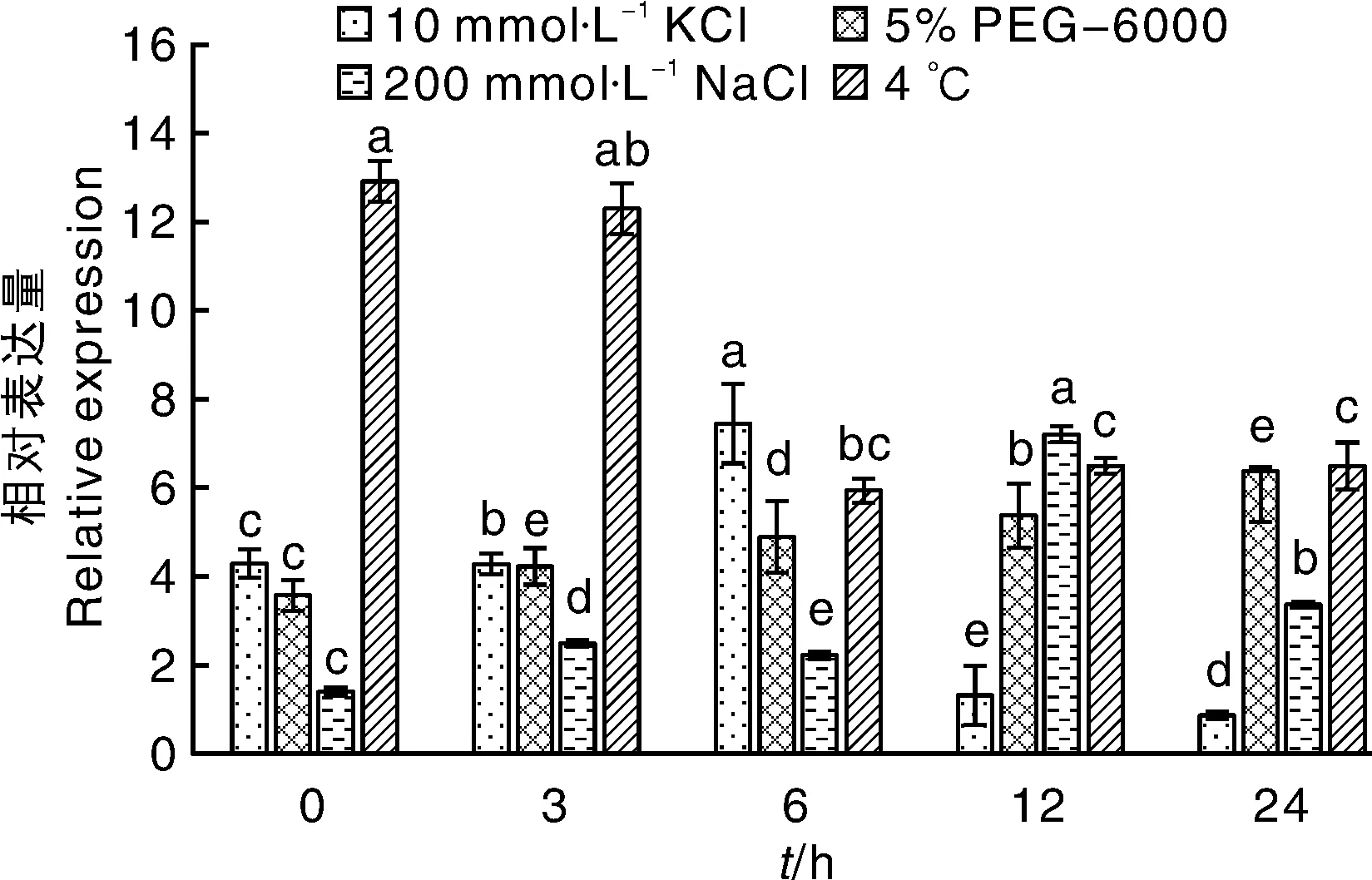
同一处理不同时间点的数据间没有相同字母表示差异显著(P<0.05)。Under the same treatment at different time, the bars without the same lowercase letters showed significance at the level of 0.05.图10 ATPase4在逆境胁迫下的表达分析Fig.10 Relative expression analysis of ATPase4 under abiotic stress
3 讨论
本实验采用同源克隆的方法,从普通烟草K326中克隆的一个质膜ATPase家族成员ATPase4基因。生物信息学分析表示,ATPase4基因编码的蛋白具有多个丝氨酸、苏氨酸和酪氨酸的磷酸化修饰位点,可能与其调节的较多功能相适应。质膜ATPase分布在质膜上,是以两个催化亚基的形式存在的,是由一个多基因家族编码的酶类,使这些家族不同的成员具有组织和器官的特异性[12]。质膜ATPase在进化上可以大致分为5个亚家族,而烟草ATPase基因表达模式分析证明为第Ⅱ家族,这种表达模式几乎在任何组织中都有表达[11,13]。荧光定量PCR结果表明,ATPase4基因在根、叶、花中都有表达,因此推测该基因可能参与了烟草生长的一系列生理反应。刘健健等[14]研究表明,质膜ATPase家族基因在番茄所有组织中都有表达,但在果实中表达较少。ATPase4基因在根中表达量最高,而在叶和花中表达量较低,与番茄质膜ATPase4基因在根中表达量最高相一致[15]。为保证植株正常生长,需从根部吸收更多水分和离子,通过细胞液中积累无机离子或合成有机溶质等方式进行渗透调节以减轻或避免伤害[16],推测ATPase4基因在烟草和番茄中可能与根中离子运输有关。
在转录水平上,质膜ATPase参与了植物生长发育过程中多种胁迫反应[17]。质膜ATPase在植物生长、发育和对外环境的适应过程中的重要作用已有相关报道,其中,在盐胁迫过程中质膜ATPase的应答功能研究较多[11-15]。qRT-PCR分析结果表明,烟草ATPase4在低钾处理6 h时达到最大值,之后又下降,因此推测ATPase4基因可能是在低钾胁迫早期的响应基因,能快速响应低钾胁迫,在后期随着时间的延长其表达受到了抑制,可能是因为植株适应了胁迫。在PEG-6000处理下,ATPase4基因表达水平在0~24 h内逐渐增加。Li等[18]用6% PEG处理大豆种子,质膜ATPase活性随着处理时间而增强,在12 h活性达到最大,此后到72 h间活性稍许下降,但仍大于对照。Yang等[19]用6% PEG处理大豆种子,与Li等[18]得出结论一致。说明ATPase4基因与干旱胁迫相关,因此推测在PEG处理后基因表达量上升使质膜ATPase活性增强。
经盐处理,ATPase4基因表达量明显提高,表达量12 h达到最大,与刘尼歌等[20]得出盐能诱导烟草质膜ATPase基因表达的结论相一致。Ballesteros等[21]分别用75和150 mmol·L-1NaCl处理向日葵3 d后,提取根的质膜微囊,测定质膜ATPase的活性,结果表明,NaCl处理的向日葵根部质膜ATPase的活性显著提高。盐胁迫条件下,抗盐品种可能累积较多的mRNA,参与作物的相关逆境胁迫,进而导致植物的代谢水平发生相应的改变[22-24]。
冷处理ATPase4基因表达量在早期(3 h)没有明显变化,在6 h时约为对照的0.49倍,说明后期冷处理抑制了ATPase4基因表达。简令成等[24]研究表明,在5 ℃低温处理番茄幼苗,12 h后幼苗子叶质膜ATPase活性显著降低。植物在适应低温时,膜脂从液态变为半结晶态,因而影响膜的流动性,使得基因表达受到抑制,进而导致相关ATP酶活性降低。
本实验结果表明,ATPase4基因在低钾、干旱、盐胁迫和冷胁迫下发挥重要作用,但其编码的蛋白的具体功能,尚待进一步研究。后续研究将进一步获得转基因烟草以及测定转基因植株的相关生理指标,进一步阐明该基因在逆境胁迫中的作用。
