青葙组培快繁与试管内开花的研究
2019-03-05刘扬李亚峰李宏杨刘国民
刘扬,李亚峰,李宏杨,刘国民
(1.海南大学苦丁茶研究所,海南海口 570228;2.三亚市南繁科学技术研究院,海南三亚 572000)
1 引言
青葙(Celosia argenteaL.)是苋科青葙属植物,别名草蒿、百日红、鸡冠苋,是一种野生药食两用植物。全株无毛;茎直立,有分枝。叶矩圆状披针形至披针形。穗状花序长3~10cm;苞片、小苞片和花被片干膜质,光亮,淡红色。胞果卵形,盖裂;种子肾状圆形,黑色,光亮。生长分布几遍全国,野生或栽培;朝鲜、日本、前苏联地区、中南半岛、菲律宾、非洲也有分布。生于平原或山坡,为旱田杂草[1]。
青葙嫩茎叶和幼苗均可食用,青葙营养丰富,口感清香柔嫩, 是一种可填补蔬菜淡季的天然无公害食品[2]。同时青葙具有止血凉血和清热解毒功之效,可降血压、去瘙痒、除白带,且具有治疗眼膜炎和角膜炎,具有预防癌症和散热消肿之功效。青葙干燥成熟种子系药典收载品种,具有清肝明目和退翳之功效。现代研究表明,青葙子具有保肝、抗糖尿病、抗肿瘤等作用。青葙种子富含必需氨基酸,油脂脂肪酸组成可制备食用调和油有较高营养保健价值[3]。随着人们需求上升以及药理药化研究不断深入青葙药用和食用量将越来越大。
植物试管内开花研究已有70 余年历史,已有过诸多报道,约有35 个科的植物被用于试管内开花研究,其中包括对青葙属植物鸡冠花(Celosia cristataL.)试管内开花有若干研究报道[4~5]。但人们对于青葙的试管内开花则研究很少。该论文系首次报道青葙离体快繁与试管内开花的研究结果。
国外试管花卉研发比较流行,已形成了一定产业,但试管花卉之商品种类很少。国外离体花卉的研究重点放在运用分子生物技术对花卉的遗传基因进行改造方面[6,7],而国内则重放在利用植物激素对试管花卉植株进行调控[8~10]。该课题的工作主要是探索青葙离体快繁和试管内开花过程所涉及的相关工艺技术和理论问题。其中工艺技术研究内容主要包括:外植体材料表面消毒及初代接种操作,茎段离体快繁的操作方法及适宜的培养基配方,成花培养过程中相关操作方法及适宜的培养基配方,以及开花后保鲜培养的操作方法及相关培养基配方等;理论探讨重点主要是解决两个方面的问题:一是探讨ABA 的不同浓度和不同处理时长的预处理中对青葙无菌苗开花百分率的影响;二是研究在成花培养阶段同时采用低浓度N 胁迫和高浓度P 胁迫条件对青葙无菌苗开花百分率的影响。试图通过这些工作为青葙的试管内开花提供植物生理学理论依据和试管花工艺技术支持。
2 材料与方法
2.1 材料
从云南省普洱市郊区的野生青葙植株上取种子作为外植体材料。
2.2 方法
2.2.1 外植体材料表面消毒及初代接种操作
将青葙种子置于200ml 三角瓶中,用30 目钢丝网封口并扎紧,然后置于自来水龙头下冲洗5h;倒去水后,加入适量5%洗洁精溶液,摇洗5min,透过钢丝网滤去洗洁精溶液,并用自来水将种子冲洗干净。如此重复,将种子摇洗3 次,每次5min,最后一次沥干水备用。
将洗净的青葙种子转移到超净工作台上,在无菌条件下,先用0.3% KMnO4将种子消毒3h,然后倒去KMnO4消毒液,用无菌水将种子清洗4~5 遍,最后一遍沥干水,再加入75%乙醇灭菌3min,倒去乙醇灭菌液,再加入0.15% HgCI2灭菌15min;倒去HgCI2溶液,再用无菌水将种子冲洗4~5 遍,最后一遍沥干水备用。
在超净工作台上用无菌的不锈钢药品勺的背面粘附经过表面消毒的无菌青箱种子,然后轻轻地将种子敲落在无菌发芽培养基的表面。每瓶接入5~6粒种子。
2.2.2 培养室的光温条件
该实验中的各个培养阶段,实验材料均置于(25±2)℃室温条件下进行培养,用日光灯照明,光照强度约为2000lx。每天照明10h(8:00~18:00)。
2.2.3 培养基的配制及灭菌方法
该实验中所采用的各种培养基,均按照植物组织培养中的常规方法配制和灭菌[11]。
2.2.4 各培养阶段所采用的培养基配方及相关操作方法
2.2.4.1 种子无菌发芽培养阶段
MS+肌醇100mg/L+烟酸1.0mg/L+ 盐酸硫胺素2.0mg/L+ 盐酸吡哆素1.0mg/L+ 甘氨酸2.0mg/L+蔗糖2.5%+卡拉胶0.7%;pH=5.8。
每瓶接入5~6 粒种子,种子萌发后,当无菌实生苗长至株高3~4cm 时,在超净工作台无菌条件下,将实验苗转接到增殖培养基进行增殖培养,或转接到附加有ABA 花芽诱导培养基上继续进行花芽诱导培养。
2.2.4.2 茎段离体快繁阶段
青葙植株的种子量很大,种子个体很小,初代培养时进行表面消毒比较容易成功,污染率较低,种子的发芽率较高。所以,在花芽诱导阶段,材料的来源可以从两个途径得以满足:一是用无菌实生苗,切除并弃去植株基部的的1/3,将中上部转接到花芽诱导培养基上即可;二是在生产单位或研发单位所掌握的青葙种子量不多的情况下,可利用少量种子先构建一批无菌材料(无菌实生苗),再将这批无菌实生苗离体快繁若干代,培养出大量丛生芽,然后取丛生芽中上部,转接到花芽诱导培养基上。
该研究中用于青葙丛生苗增殖培养的培养基如下:
MS+肌醇100mg/L+烟酸1.0mg/L+盐酸硫胺素2.0mg/L+ 盐酸吡哆素1.0mg/L+ 甘氨酸2.0mg/L+6-BA1.0mg/L+NAA0.1mg/L+ 糖2.5%+ 卡拉胶0.7%;pH=6.0。
第一次进行增殖培养时将在无菌发芽培养基上获得的无菌实生苗切除并弃去子叶、下胚轴及根系,将生长点转接到该培养基上培养30d 左右,后每隔30d 左右继代增殖一次。每次继代转接时,将每株较大的无根苗切割成带2~3 个节的茎段,较小的丛生芽则切割成单芽。每瓶接入五个茎段(或小芽)。
2.2.4.3 花芽诱导阶段
该研究中利用ABA 诱导青葙无菌苗进行花芽分化。ABA 的浓度设5 个梯度,通过浓度梯度试验筛选出最佳的ABA 浓度。各处理的编号及相应的ABA 浓度如表1 所示。

表1 青葙花芽诱导培养基中的ABA 浓度梯度设计Tab.1 ABA concentration gradients in the medium for flower buds induction in Celosia argentea L.
花芽诱导培养基的配方为:
MS+肌醇100mg/L+烟酸1.0mg/L+盐酸硫胺素2.0mg/L+ 盐酸吡哆素1.0mg/L+ 甘氨酸2.0mg/L+蔗糖3.0%+卡拉胶0.7%;pH=5.8。
青葙无菌苗在上述花芽诱导培养基上所培养的时间设以下两个处理:
处理A:限定仅用该培养基预培养15d,然后将各个在ABA 浓度梯度处理上培养的材料分别转接到后续的开花培养基上进行培养,令其在开花培养基的培养瓶内开花。
处理B:用花芽诱导培养基连续培养(中途不转接),至转接后120d 时,才统计开花植株所占百分率。
2.2.4.4 成花培养阶段
成花培养基所用的无机盐系改良MS 培养基无机盐,即在MS 培养基的基础上将N 元素的用量减至MS 原始配方中用量的1/20,P 元素的用量提高到MS原始配方中用量的5 倍;与此同时,将蔗糖浓度由MS 原始配方中的2.0%提高到3.5%。即用低N,高P和高渗条件抑制营养生长,促进生殖生长。
成花培养基的配方为:
改良MS(×1/20 N;×5 P)+ 肌醇100mg/L+ 烟酸1.0mg/L+ 盐酸硫胺素2.0mg/L+ 盐酸吡哆素1.0mg/L+甘氨酸2.0mg/L+6-BA0.5mg/L+IBA1.0mg/L+蔗糖3.5%+卡拉胶粉0.7%;pH=5.8。
将在追加了不同浓度ABA 的花芽诱导培养基上培养了15d 的青葙无菌苗,分别转接到该培养基上,培养45d 后统计开花植株所占百分率。
2.2.4.5 开花后保鲜培养阶段
由于成花培养基中的N 元素调减至MS 原始配方中N 用量的1/20,故在成花培养基上培养一个月后,大部分青葙无菌苗虽已开花,或已现蕾,但由于N 素严重亏缺,植株基部的叶片严重发黄或坏死脱落。为了提高观赏价值和延长试管花的货架期与观赏期,应该及时将已现蕾的植株(包括已开花的植株)及时转接到保鲜培养基上。转接时在无菌条件下剪去基部的所有黄叶,修除植株的全部根系,然后转接到无机盐为常量MS 的保鲜培养基上令其叶片转绿,花朵正常开放和发育,并延长花期和可用于赏花的时间。
保鲜培养基的基本成分如下:
MS+肌醇100mg/L+烟酸1.0mg/L+盐酸硫胺素2.0mg/L+ 盐酸吡哆素1.0mg/L+ 甘氨酸2.0mg/L+蔗糖3.5%+卡拉胶0.8%;pH=5.8。
3 结果与分析
3.1 种子无菌萌发情况
青葙种子接种到无菌发芽培养基上后,约经7d培养,即可观察到逐渐有种子开始萌动,首先是胚根开始突破种皮延伸到培养基表面;之后,大多数种根插入培养基内部成为基内根,并长出有须根,也有少数实生苗的根不往下扎,而是紧贴着培养基的表面生长,或形成气生根。随着下胚轴的不断延长,这种在培养基表面长根的实生苗往往会倒伏,或其顶端弯曲后再往上直立生长。青葙萌发出苗后,其下胚轴伸长较快,至接种后14d 左右时,植株株高可达1.0~1.5cm(图1)。此时子叶平展,并开始长出真叶。至接种后28d 左右时,植株的株高达3.5~4.0cm 时如果实生种苗用于快繁增殖,即可将无菌实生苗在超净工作台上的无菌条件下取出,置于无菌不锈钢盘上,切割成具2 叶2 节的茎段,并转接到增殖培养基上。如拟将初代培养获得的无菌实生苗在下一阶段直接用于花芽诱导,则可令其在无菌发芽培养基上再培养28d,即在接种后第56d 时才转接到花芽诱导培养基上(见2.2.4.3 节)。

图1 无菌萌发的青葙实生苗(播种后10d)Fig.1 Aseptically germinated seedlings of Celosia argentea L. (10 d after sowing)
3.2 青葙无菌苗茎段离体快繁的效果
将株高6~8cm 的青葙无菌苗在超净工作台的无菌的条件下切割成3~4 个带有2 叶2 节的茎段和顶芽,然后转接到文中2.2.4.2 节所介绍的增殖培养基上,经8~10d 的培养,每个离体茎段一般均会发出一个腋芽,每个顶芽则直接生长形成无根苗,或偶有1~2 条短小的根。由于增殖培养基中添加有1.0mg/L 6-BA,故由茎段及顶芽再生出的植株一般不发根,或偶见少数植株长有1~2 条短根。经25~30d 培养,由茎段再生出的植株株高可达6~8cm(图2)。此时又可再次切割成茎段进行离体快繁。每次继代繁殖,增殖系数在3~4 左右。或者将其基部的1/3 切除并弃去,将植株中上部转移至花芽诱导培养基上。

图2 青葙无菌增殖苗Fig.2 Sterile multiplication vaccine for Celosia argentea L.
3.3 不同浓度ABA 诱导花芽分化后转接到成花培养基上的开花情况
将初代培养中获得的青葙无菌实生苗,苗龄56d 左右时在超净工作台的无菌条件下从培养瓶中取出,置于无菌不锈钢盘中,切除并弃去植株基部的1/3,将中上部转接到追加有不同浓度ABA 的花芽诱导培养基的各种浓度梯度处理上(表1)培养15d,然后再转接到修改的MS 培养基上(×1/20 N;×5 P)进行成花培养。至转接后30d 时统计开花情况。实验结果如表2 所示。
从表2 可以看出:在0.00mg/L~0.50mg/L 浓度范围内,随着预处理培养基中ABA 浓度的递增,青葙无菌苗转接到修改的MS 培养基上(×1/20 N;×5 P)培养30d 后,其开花植株所占的百分率会相应提高;再进一步提高ABA 浓度,其开花植株所占百分率又会明显下降。
在无激素处理中(CK,ABA 浓度为0),虽有52%的植株能够完成花芽分化,但在后续的成化培养基上[修改的MS 培养基(×1/20N;×5P)],其花器官发育不良,花序短小。当ABA 浓度≥1.00mg/L 时,不仅开花植株百分率会急剧下降,而且即使有个别植株开花,其花器官也严重发育不良。表2 青葙无菌苗经用不同浓度ABA 预处理15d 后对试管内开花百分率的影响
Tab.2 Effects of pretreatment for 15 days with different ABA concentrations,on the percentages of flowering in-vitro plantlets ofCelosia argenteaL.
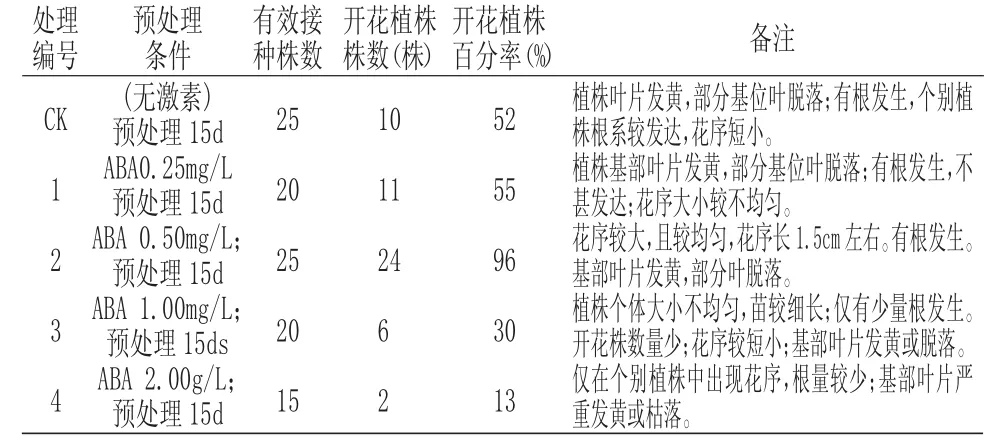
处理编号有效接种株数CK预处理条件开花植株株数(株)备注1 2 3 4(无激素)预处理15d ABA0.25mg/L预处理15d ABA 0.50mg/L;预处理15d ABA 1.00mg/L;预处理15ds ABA 2.00g/L;预处理15d 25 20 25 20 15 10 11 24 6 2开花植株百分率(%)52 55 96 30 13植株叶片发黄,部分基位叶脱落;有根发生,个别植株根系较发达,花序短小。植株基部叶片发黄,部分基位叶脱落;有根发生,不甚发达;花序大小较不均匀。花序较大,且较均匀,花序长1.5cm 左右。有根发生。基部叶片发黄,部分叶脱落。植株个体大小不均匀,苗较细长;仅有少量根发生。开花株数量少;花序较短小;基部叶片发黄或脱落。仅在个别植株中出现花序,根量较少;基部叶片严重发黄或枯落。
3.4 在花芽诱导培养基上连续培养120d 对青葙无菌苗植株试管内开花的影响
该研究中在探索用不同浓度的ABA 预处理青葙无菌苗15d,然后再将这些无菌苗转接到修改的MS培养基上(×1/20 N;×5 P)以筛选出ABA 诱导青葙花芽分化的最适浓度的同时,还考虑到如果不将这些用ABA 处理过的青葙无菌苗转接到成花培养基上再培养一段时间,这些无菌苗是否会开花?如果开花,开花植株百分率最高的又是哪一个处理?与转接到成花培养基上的相应浓度梯度处理相比较,开花植株百分率是提高还是降低?在第二批试验材料中,用同样浓度梯度的ABA 处理120d(即中途不转接到成花培养基上)。经观察和统计,试验结果如表3 所示。
从表3 可以看出:青葙无菌苗能够在试管内开花,外源ABA 不是必须的;因为在无激素处理中(CK),仍有30.91%的植株开花。无激素处理的青葙无菌苗在培养90d 之后就陆续可以观察到有植株开花。这表明,青葙无菌苗试管内开花与其内源ABA 激素和植株的苗龄有密切关系。
外源ABA 可以明显地提高青葙无菌苗试管内开花的百分率,而且呈明显的剂量关系:在0.00mg/L~0.50mg/L 范围内,开花植株百分率随着ABA 浓度的而提高;高峰范围(平台期)在0.50 mg/L~1.00mg/l,开花植株百分率维持在65.72%~67.28%之间;再增加ABA 浓度,开花植株百分率又明显下降。
无论是预处理15d 马上就转接到成花培养基上(修改的MS:×1/20;×5P),还是一直留在花芽诱导培养基上至接种后120d,ABA 的最佳浓度梯度均为0.5mg/L,但转接到修改的MS 培养基(成花培养基)上,其促进开花的效果更好,植株开花百分率由不转接的处理之67.28%提升到96.0%。而且转接到成花培养基上之后,花序较长而大,个体之间也比较均匀。
由于各个浓度梯度处理中的青葙无菌苗材料均是长期保持在同一种培养基上培养,而且中途没有经过转接,故各处理中的材料由于培养基中各种养分的不断消耗,再加上植株所产生的有害代谢产物的长期积累,导致各叶片逐渐变黄。特别是在后期,基部叶片逐渐枯落。而且,不转到成花培养基上的各个处理,其开花株的花序较短小,观赏不如转接到成花培养基上相应处理的那么高。因此,可认为:在青葙试管花培育过程中,在用0.5mg/L ABA 处理植株15d 之后,有必要及时转接到成花培养基上。这不仅有利于提高开花植株百分率,而且可以提高青葙试管花的质量。
3.5 保鲜培养的效果
将已开花的植株,或者已现花蕾的植株,转接到保鲜培养基上,约经10d 左右的培养,植株的叶片明显转绿,尚未开放的花蕾陆续开放。至培养12d~15d 时,每个植株基部会长出1~2 条根,根系不甚发达,但足以证明该试管花是一个完整植株(图3)。试管花的主体是“花”,而不是“根”。如果根系太发达,不利于突出“花”这个主体。能保证青葙试管花“花红叶绿”,而且有30d 以上的可观赏期,是旅游产品“拇指花”或“试管花”的基本要求。该研究中开发出的青葙试管花产品,其观赏期可达45d 左右,故可批量生产推向市场。

图3 在保鲜培养基上培养的青葙开花植株Fig.3 Celosia argentea L. plants (flowering) grown on fresh-keeping medium
4 讨论
4.1 关于ABA 处理时间对花芽的形成的影响问题
王志远等人研究石斛(Dendrobium spp)离体培养中ABA 对诱导花芽形成的影响时,曾报道ABA预处理的时间长短,对于花芽诱导有明显影响[12]。用0.5mg/L 预处理5d,再转到含有6-BA 的MS 培养基上培养150d,花芽形成频率为29.3%;预处理15d 培养150d 时花芽形成频率为84.4%;预处理30d 培养150d 时则未见有花芽形成。该研究中用青葙做实验材料发现:ABA 的浓度对花芽的影响更大,有明显的剂量关系,即ABA 浓度与成花频率之间呈抛物线关系。用ABA0.50 mg/L 长时间处理青葙120d 并不妨碍青葙花芽的形成,仍然呈明显的剂量关系。但如果用0.50mg/L 处理15d 之后,马上转接到修改的MS成花培养基上(×1/20 N;×5 P)则会明显提高ABA浓度梯度处理的花芽形成频率。后续的成花培养基中降低N 素浓度和提高P 素浓度才是提高花芽形成的关键因素。因为,即使一直培养在附加0.50mg/L的培养基上,0.50mg/L ABA 处理中仍有60%以上的植株开花。因此,可认为这可能与物种的种性有关。对于青葙来说,苗龄、外源激素的浓度与处理时间,以及N 素和P 素的无机营养条件,均对花芽形成有影响。但以适宜的外源ABA 浓度(0.50mg/L)对青葙无菌苗的花芽形成频率之影响最明显。即使不追加外源ABA(CK),当培养至一定时间时亦有30%以上的植株形成花芽。这表明内源ABA 水平以及苗龄亦是影响青葙植株花芽形成的重要因素。
4.2 关于试管花相关应用技术的研发意义
自从中国学者罗士韦首次报道田野菟丝子(Cusouta compestris)在试管中开花以来,迄今为止,已有35 个科,共计100 余种植物实现了试管内开花,包括园艺作物、药用植物和田间杂草,但其中以花卉的研究最多[13]。从实生苗、器官、组织,到原生质体,均可以作为外植体,在人工控制的试管条件下获得花芽分化。但从已发表的有关试管开花植物的报道来看,绝大部分研究者是从基础理论的研究角度来进行研究[14~15]。目前,关于试管花卉的观赏性、货架期、保鲜期,以及配套的培养瓶与包装材料方面,很少有学者涉及。市面上试管花的商品形式主要靠各个商家自行研发,尚缺少科研单位的系统研发报道。实际上,试管花卉在国外已形成一个较大的产业,尤其是在欧美国家,情人节来临时试管玫瑰花的销量尤为火爆。因此,研究试管花的保鲜期,货架期,外观包装以及包装材料等等,具有重要意义,这有助于将试管花产品推向更广阔的市场。
