已上市HIV整合酶抑制剂及其合成介绍
2019-03-04徐靖坤王瑞陈小峰
徐靖坤,王瑞,陈小峰,田 磊
(安徽贝克联合制药有限公司,安徽阜阳236626)
1981年,美国纽约和旧金山的医生同时发现一种奇怪病症,患者被诱发出现一些常见于有免疫缺陷人群的感染和癌症。因此该病症被称为获得性免疫缺陷综合症(Acquired Immune Deficiency Syndrome),简称艾滋病(AIDS)[1]。1984年,美国和法国科学家找到了致病的人体免疫缺损病毒(Human Immunodeficiency Virus,简称HIV,亦称艾滋病毒)[2]。AIDS传播速度快,死亡率高,如何阻止艾滋病毒入侵免疫细胞,恢复艾滋病患者的健康,一直是医药工业界的重要课题[3]。
自首个治疗HIV药物齐多夫定(Zidovudine)上市以来,目前用于临床的HIV药物主要以核苷/非核苷类逆转录酶抑制剂、蛋白酶抑制剂、融合酶抑制剂为主。而整合酶是HIV复制过程中的四个关键酶之一[4]。HIV-1整合酶是由病毒的3’端pol基因编码的含288个氨基酸残基的蛋白质组成,折叠成3个结构域,即N端(N-terminal) 结构域、核心 (core) 区域和 C端(C-terminal)结构域[5]。整合酶在人体细胞中没有同源蛋白,所以整合酶抑制剂极有可能无毒副作用[6]。
HIV通过整合酶将自身的遗传物质整合到受感染的细胞中,病毒脱氧核糖核酸(DNA)进入宿主基因结合为一体,利用宿主细胞基因复制的功能和原料完成HIV的复制和感染[7]。过去十几年来,以整合酶为靶点的整合酶抑制剂一直是HIV药物学家们的研究热点[8]。以整合酶为靶点,艾滋药物研发者开发出了一系列的整合酶抑制剂,临床表现良好。其通过抑制HIV整合酶,有效抑制HIV在体内复制,具有较高的选择性和较低的毒性。
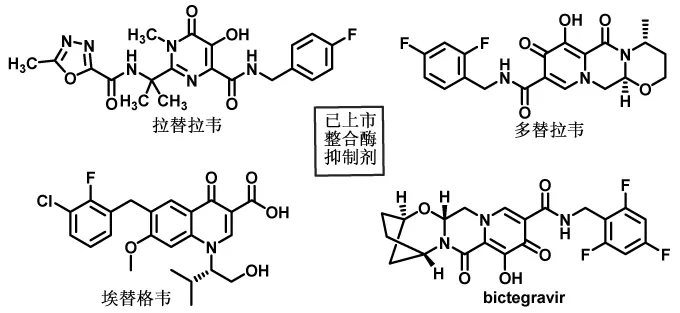
图1 四种已上市的整合酶抑制剂
经查询,已作为药物上市的艾滋病毒整合酶抑制剂一共有四种,分别是拉替拉韦、多替拉韦、埃替格韦和最新的bictegravir(图1),其或作为单方制剂应用于艾滋病患者,或作为鸡尾酒疗法——多联复方制剂应用于HIV的治疗。下面将分别介绍这四种整合酶抑制剂的情况及其化工企业可行的制备方法,旨在为HIV整合酶抑制剂药物研究和开发者提供整理资料和参考依据。
1 拉替拉韦
第一个被美国FDA(美国食品药品管理局)批准上市的整合酶抑制剂为拉替拉韦(Raltegravir),商品名为Isentress,由Merck公司开发,是第一个应用于临床的HIV-1整合酶抑制剂,于2007年10月份被美国FDA批准上市[9]。2009年7月,拉替拉韦被批准作为治疗HIV-1的一线药物[10]。目前市场上在售的处方类型只有拉替拉韦钾盐的单方制剂。临床试验证明拉替拉韦在治疗成人HIV患者时,已体现出迅速、高效的抗病毒特点。拉替拉韦与其他抗逆转录病毒药物联用显示出良好的疗效。但是其本身也存在不足之处,服药需2次/天,与现有的1次/天的抗艾滋病毒药物相比,患者日常服药不够方便[11]。
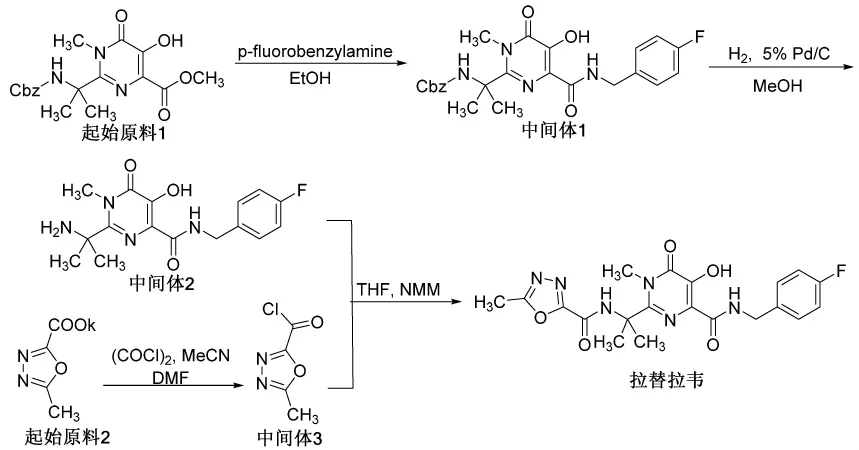
图2 拉替拉韦合成路线
拉替拉韦工业化的合成路线如图2[12]。起始原料1(1,6-二氢-5-羟基-1-甲基-2-[1-甲基-1-[(苄氧基羰基)氨基]乙基]-6-氧代-4-嘧啶甲酸甲酯)首先溶解在乙醇溶剂里,与对氟苄胺发生酯的胺解反应,缩合生成中间体1,中间体1的Cbz(苄氧羰基)保护基在钯碳、氢气条件下解离脱除。起始原料2的羧酸钾盐基团与草酰氯氯化反应生成酰氯中间体3。最后,中间体2与中间体3在NMM(N-甲基吗啉)碱与THF(四氢呋喃)溶剂作用下,胺基亲核取代氯原子,缩合生成拉替拉韦原料药。该路线的起始原料、反应试剂商业可得,并且操作简单,无特殊复杂操作步骤。反应路线含四步操作,其中有三步反应需要分离纯化中间体,符合原料药申报的相关法规要求。经进一步的优化与杂质研究后,可作为工业生产路线进行该原料药的批量生产。
有文献指出[13],将中间体2上的羟基用PivCl(三甲基乙酰氯)保护后,可以使反应体系的收率提高,反应干净,减少了中间体3的用量(图3),并且PivCl保护基也很容易在后续反应中脱除。
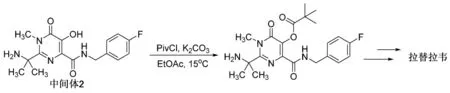
图3 拉替拉韦合成路线改进
2 多替拉韦
多替拉韦(Dolutegravir)是由葛兰素史克(GlaxoSmithKline)和ViiV Healthcare共同研发,于2013年8月12日获美国FDA批准上市,之后于2014年1月16日获欧洲药物管理局(EMA)批准上市,于2014年年3月24日获日本医药品医疗器械综合机构(PMDA)批准上市,2015年12月30日获中国国家食品药品监督管理总局(CFDA)批准上市,由ViiV Healthcare负责在美国、欧洲和中国上市销售,由上述两家公司联合负责在日本上市销售,商品名均为Tivicay。美国FDA官网上显示,目前市场上在售含多替拉韦的药物处方有三种,分别是多替拉韦钠盐的单方制剂、阿巴卡韦/多替拉韦/拉米夫定三联方复方制剂和多替拉韦/利匹韦林二联复方制剂。
多替拉韦的作用机理也是通过阻断HIV病毒DNA整合至人免疫细胞(T细胞)的遗传物质中,从而限制HIV的复制。这个过程对HIV周期性复制很重要,也是慢性感染建立的重要环节[14]。该药与其他抗逆转录病毒药联用,用于治疗成人和12岁及以上青少年及体重至少超过40 kg儿童患者的HIV-1感染[15]。
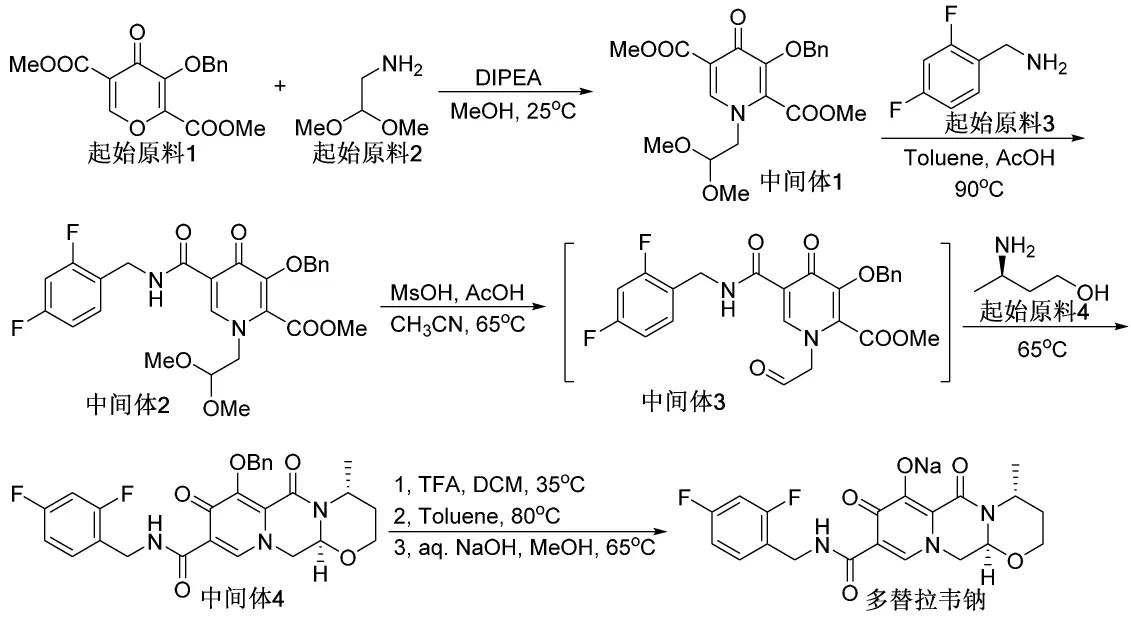
图4 多替拉韦钠合成路线
2018年5月,FDA和EMA提出关于Tivicay的安全警告称:在受孕时或者怀孕初期接受Tivicay治疗的HIV-1感染女性患者,其生下的婴儿有严重的先天性神经管缺陷等较高风险。因该原因,多替拉韦未来的市场销售增长情况存在极大的不确定性。
多替拉韦钠的合成路线见图4[16]。首先起始原料1(4-氧代-3-苄氧基-4H-吡喃-2,5-二甲酸二甲酯)与起始原料2(氨基乙醛缩二甲醇)在DIPEA(二异丙基乙基胺)碱作用下,开环关环生成中间体1。起始原料3(2,4-二氟苄胺)进攻中间体1的甲酯基团,发生酯的胺解生成酰胺中间体2。由于中间体1与苄氧基团邻近的甲酯基团两侧位阻较大,所以反应优先进攻位阻较小的酯基,从而主要得到中间体2。缩醛在甲磺酸与醋酸条件下水解生成醛中间体3,中间体3不需要分离,直接与起始原料4((R)-3-氨基-1-丁醇)反应关环,生成中间体4。最后通过TFA(三氟乙酸)脱去苄基保护基,与氢氧化钠反应生成钠盐,得到最终的多替拉韦钠盐原料药。该路线使用的起始原料市场可得,各步反应操作温和,未使用过渡金属或剧毒试剂,是目前合成多替拉韦原料药的化工企业中所选择的实施方案之一。
3 埃替格韦
埃替格韦(Elvitegravir)是由日本Tobacco公司研制,美国吉利德(Gilead)公司开发的药物,于2013年11月13日获欧洲EMA批准上市,之后于2014年9月24日获得美国FDA批准上市,由吉利德在欧洲和美国上市销售,商品名为Vitekta。埃替格韦是美国FDA批准的第一个喹诺酮类HIV药物,具有良好的耐受性[17]。美国FDA官网显示,目前市售的含埃替格韦的药物有三种,分别是Vitekta、Stribild和Genvoya,这三款都是美国吉利德公司的药物产品。
埃替格韦作为人类免疫缺陷病毒1型(HIV-1)整合酶抑制剂,与蛋白酶抑制剂利托那韦以及其他抗逆转录病毒联用,用于治疗成人患者的无任何已知的埃替格韦抗性相关突变的HIV-1感染。当埃替格韦作为复方制剂Stribild的一部分时,四种药物分别为:埃替格韦,HIV整合酶抑制剂;Cobicistat,细胞色素P450 3A抑制剂;恩曲他滨(FTC)和富马酸替诺福韦二吡呋酯(TDF),HIV核苷类逆转录酶抑制剂,这四种药物联用是成人HIV-1型感染患者的抗逆转录病毒初始治疗的完成方案[18]。新一代的鸡尾酒药物Genvoya与Stribild配方基本相同,只是将TDF换为更优的替诺福韦艾拉酚胺(TAF)。
埃替格韦原料药的合成路线如图5。起始原料1(5-溴-2,4-二氟苯甲酸)上的羧基官能团经二氯亚砜作用生成酰氯。反应不经分离,直接与起始原料2(3-(二甲氨基)丙烯酸乙酯)反应,生成中间体1。手性伯胺起始原料3进攻中间体1得中间体2。中间体2在DBU(1,8-二氮杂二环十一碳-7-烯)碱的作用下,烯基胺取代氟原子,关环得到中间体3。为了保证后续反应的正常进行,中间体3上的羟基通过TBDMSCl(叔丁基二甲基氯硅烷)保护,生成硅基醚中间体4,防止羟基发生副反应。中间体4与有机锌试剂起始原料3在零价钯、三苯基膦为配体的条件下发生偶联,得到中间体5。氢氧化钠碱性条件下脱除硅保护基,生成的中间体6在甲醇钠进攻下取代氟原子,最终生成终产物埃替格韦。从反应路线图可知,埃替格韦的合成路线较复杂,并且反应过程中运用了过渡金属钯,涉及到原料药中重金属的残留问题研究,但这是目前工业主要的合成路线方法,期待有更好的突破性路线出现。
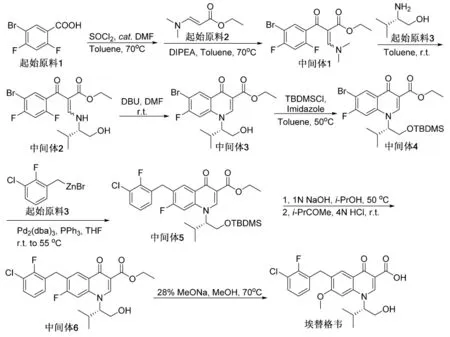
图5 埃替格韦合成路线
4 Bictegravir
2018年2月8日,吉利德科学(Gilead Sciences)宣布美国FDA批准了其新药Biktarvy上市,作为每日一次的单片片剂疗法,治疗HIV-1感染。
Biktarvy 由 bictegravir(50 mg)、恩曲他滨(200 mg)与替诺福韦艾拉酚胺(25 mg)三种成分组成。与吉利德的另一款抗HIV药物Descovy(恩曲他滨/替诺福韦艾拉酚胺)相比,Biktarvy多了bictegravir这个成分。这是一款全新的无助推(unboosted)整合酶链转移抑制剂(INSTI)。Evaluate Pharma预期bictegravir/恩曲他滨/替诺福韦艾拉酚胺在2022年销售额将会超过50亿美元。该药物是吉利德科学最新开发的艾滋病药物。该公司首席执行官John Milligan认为,这将会是有史以来最好的药物。Milligan称bictegravir/恩曲他滨/替诺福韦艾拉酚胺组合将成为艾滋病市场“最重要的产品”。总之,吉利德公司以及市场都对该产品极度看好,未来会加大对Biktarvy的销售推广。
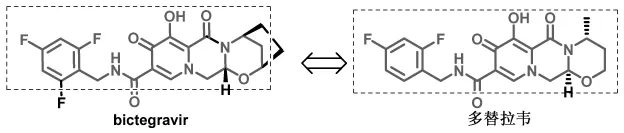
图6 虚线框内线体颜色稍淡部分代表结构相同之处
目前市场上关于bictegravir整合酶抑制剂的药物,只有四联复方制剂,没有bictegravir的单方制剂销售。该款最新的整合酶抑制剂在结构上与多替拉韦有许多相似之处(图6),bictegravir应该属于多替拉韦的me-too药物。其具体疗效与市场情况也有待时间的考验。
Bictegravir的合成路线如图7[19]。首先起始原料1在甲磺酸、醋酸两个酸条件下,缩醛水解,生成醛的水合物。中间体1不经分离,直接加入含两个手性中心的顺式氨基环戊醇,起始原料2与中间体1先生成缩醛结构,再关环,得到含四个环结构的中间体2。中间体2上的羧基和起始原料3(2,4,6-三氟苄胺),在碱二异丙基乙基胺(DIPEA)、多肽缩合试剂(HATU)作用下,生成酰胺中间体3。最后,溴化镁脱除甲基生成bictegravir原料。比较多替拉韦与bictegravir的合成路线可以发现,两者的合成思路基本相同,都是几个相似的起始物料片段合成,但是在组合顺序上有所不同。多替拉韦是先与苄胺生成酰胺后再关环;Bictegravir是先与氨基环戊醇关环后再与苄胺反应。这两种合成线路方法的区别主要体现在产物的分离与纯度的区别上。虽然这两种整合酶抑制剂结构相似,但细微的差别,就会影响到具体的实验结果。
5 结论
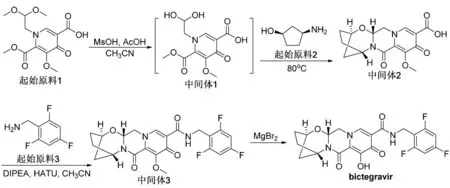
图7 bictegravir合成路线
HIV整合酶是艾滋病药物研发的一个重要靶点,并且未来几年,以整合酶抑制剂为核心的复方制剂必将成为HIV治疗的主流药物,其主要原因在于:①整合酶是HIV病毒复制机理中的一个关键酶;②人体细胞中没有类似物,从而可以避免对人体的毒副作用[20];③目前只有少数几种整合酶抑制剂进入艾滋药物市场,并且都有较好的市场表现。
上述四种整合酶抑制剂药物,拉替拉韦、多替拉韦、埃替格韦和bictegravir,或作为单方制剂,或作为复方制剂出现在艾滋病毒药物市场上,为艾滋患者以及对逆转录酶抑制剂和蛋白酶抑制剂产生耐药性的艾滋患者带来了希望。为了使患者能得到更加廉价与优质的产品,也为了研发出对环境影响最小的工艺路线,国内的化工生产企业也在不断地升级改进这些整合酶抑制剂的合成路线。
以这四种整合酶抑制剂为模板,国内抗病毒药物学家也可以此为参考,设计出me-too,me-better甚至于first-in-class的新型整合酶抑制剂。这需要有机化学工作者、药物化学工作者、工艺专家等的共同努力,励志攻克艾滋病,尽早为世界上正在遭受艾滋病痛苦的患者提供治疗方案。
