实验室项目建设对省级医疗器械检验机构发展的意义
2019-03-02朱睿杨晓辉
朱睿,杨晓辉
吉林省医疗器械检验所 (吉林长春 130000)
目前,医疗行业迅猛发展,检验机构发展的核心在于快速发展与能力建设,但受地方产业、场地建设、资金投入、人员配备等多方面因素制约,省级医疗器械检验机构与全国同行业先进检验机构比较存在一定差距[1]。省级医疗器械检验机构急需强化技能、注重人才培养、提升自身技术能力,而基础设施建设是检验工作的基础保障,只有两者兼顾,扩宽思路,才能为产品注册、上市后监管、生产过程控制及质量体系考核等工作提供有力的技术支撑。
1 全国医疗器械检验机构实验室基础建设情况
随着2003年《医疗器械检验机构资格认可办法(试行)》的实行,全国陆续建立了53家医疗器械检验机构,其中国家中心级检验机构10家,并通过了原国家食品药品监督管理总局的资格认证。共38家隶属于药监管理部门,药监系统内省级独立挂牌14家,省级(食药检机构加挂医疗器械检验检测牌子)8家。
经过“十一五”“十二五”的集中发展,各检验机构的检验能力有了较大提升,尤其是医疗器械产业发达地区,如广东、江苏、浙江等。在人员配置、设施环境及实验室建设等方面,均以十大中心建设情况较好。2017年中检院对全国医疗器械检验机构的调研数据统计分析,按十大中心及23个省级医疗器械检验机构分类,在房屋面积、实验仪器配置、特殊实验室建设方面,每一项数据省级医疗器械检验机构都远低于十大中心。许多省级医疗器械检验机构实验室老旧,场地局促,设备配置不全,影响日常检验工作开展,加之各省份产业发展情况差距较大,实验室基础建设落后,检验能力差距悬殊。见表1。由于经济水平发展差异,各省对医疗器械检验机构资金支持力度也存在差距,加之历史投入不足、设施环境等条件制约,在医疗器械通用安全及基本性能检验方面还存在着项目覆盖不全、能力不足的问题,很多省级医疗器械检验机构实验室建设、项目检验能力等已无法满足辖区内医疗器械产业发展需求。2014年医疗器械电磁兼容检测标准强制实施,而电磁兼容实验室建设成本较高,且对建设场地及空间有一定要求,很多省级医疗器械检验机构自身无能力自主建设,并且受经济发展环境制约,难以找到合适的电磁兼容实验室开展合作,导致项目无法开展,无法真正实现“放管服”中的“服”,一定程度上制约了辖区产业发展,需要政府及相关部门加大扶持力度,以促进区域内医疗器械产业发展为目标,推动省级医疗器械检验机构能力建设项目落实[2]。
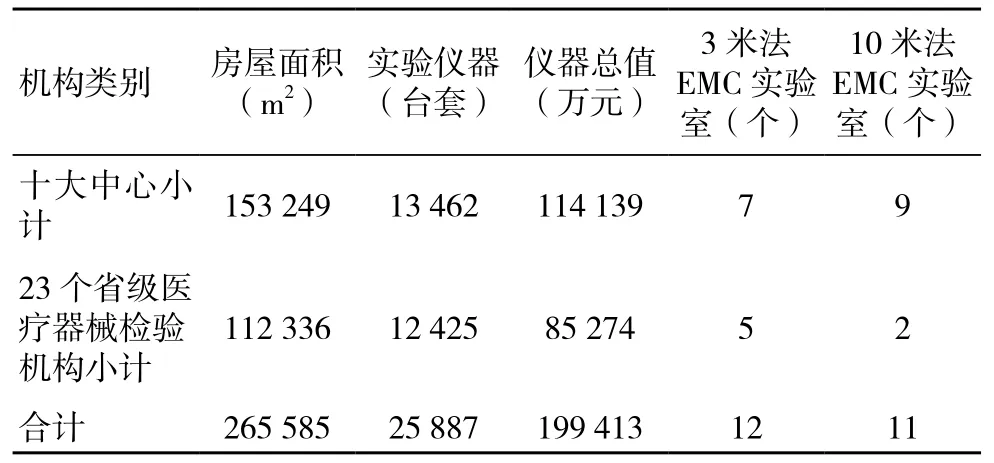
表1 医疗器械检验机构基础建设情况
2 实验室项目建设对省级医疗器械检验机构发展的必要性
医疗器械产业发展已成为促进各省经济建设一个新的增长点,是公认的朝阳产业。以吉林省为例,目前,吉林省共有医疗器械生产企业296家,其中上市公司共有5家(含2家新三板)。医疗器械注册产品共涉及分类目录中的17个类别450个品种,医疗器械产品注册总数为935个。体外诊断试剂、血型试剂、全自动生化分析仪、尿液试纸、激光类产品和可吸收骨板(钉)、康复理疗产品、肿瘤热疗机、腹膜透析机等产品在国内及国际具有一定的竞争力,发展势头良好。但是,由于实验环境条件等多方面因素的制约,省内检验机构的检验能力已无法完全满足需求,实验室项目建设迫在眉睫。
2.1 满足医疗器械产品特性需求
医疗器械是指单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需要的软件。医疗器械的种类繁多,包括用具、人工植入物、体外诊断试剂及标准物质、软件、材料等,涵盖了声、光、电、磁、化学、机械、材料学和生物学等基础科学和纳米技术、高能聚焦、超声、核物理等高新技术领域。医疗器械的复杂性和特殊性使其对检验实验室建设场地、结构等均有特殊要求,不能与普通实验室建设相比较。如电磁兼容检测实验室,防护服检测实验室,X线机、CT机和核磁共振设备检测实验室及各种环境检测实验室,均需要较大建筑面积的开间。同时,检验所用试剂、标准品、易制毒、气体瓶、易燃易爆危险品等需要专业和专门的库房进行储存和放置。这些都对实验室的建设提出了特殊要求。
2.2 满足服务监管及医疗器械产业发展需求
医疗器械监督管理条例第十一条规定第二类、第三类医疗器械产品提交的产品检验报告应当是医疗器械检验机构出具的检验报告。此外,第五十七条规定食品药品监督管理部门在执法工作中需要对医疗器械进行检验的,应当委托有资质的医疗器械检验机构进行。而各省级医疗器械检验机构基本上属于省内唯一具备资质的医疗器械检验机构,承担着全省范围内医疗器械产品注册检验、质量监督抽验及相关技术支撑工作。由于省级医疗器械检验机构设备、设施、场地建设等配置不足,很多省级医疗器械检验机构检验能力尚不能完全覆盖辖区内医疗器械产业领域,不能够出具完整的注册检验报告,影响省内产品注册,进而制约了地方医疗器械产业的发展,也限制了对医疗器械突发事件的应急处置能力及在监管方面发挥的技术支撑作用[3]。
2.3 满足新常态下医疗器械检验能力提升需求
2017年4月1日,国家停止注册检验工作的行政性事业收费,医疗器械检验机构面临诸多问题,影响了产品委托检验工作开展和检验完成时效,给企业及检验机构带来了一定的影响。一方面,很多生产企业大量增加新产品和规格型号,检验量急剧上升,现有人员难以满足增加的检体量,一部分检品形成积压。另一方面,不收取检验费后,导致原外部检验机构委托检验的产品回流,而这部分产品中包括很大比例的原省级医疗器械检验机构无能力开展的检验项目,如不及时解决,可能造成辖区内注册产品检验“无处可检”的局面。急需开展实验室建设,满足项目检验场地、设施、环境及能力需求,将这部分产品检验工作承接起来。
2.4 满足标准体系的建设、完善对实验室建设的需求
我国医疗器械上市前的注册检验依据的是产品技术要求,而产品技术要求规定主要是依据强制性或推荐性国家标准、行业标准制定的。近年来,随着原国家食品药品监督管理总局对医疗器械标准体系建设的不断完善,目前已发布医疗器械现行有效国家标准208项,行业标准1 037项,大量的医疗器械产品标准得到修订,对环境设施和设备都提出了新的要求。开展实验室项目建设,满足目前医疗器械产品标准对实验室环境设施等方面的需求,是推动检验标准体系建设的基础。
3 项目建设的意义
3.1 提升服务监管的技术支撑能力
省级医疗器械检验机构实验室建设项目,是对省级药监系统基础设施建设的补充、完善与强化,项目完成后,将极大提高省级医疗器械监督管理能力,有利于医疗器械行业的规范监督,提升对医疗器械突发事件的应急处置能力,促省内医疗器械产业的合理配置及健康发展,对保障公众用械安全和身体健康意义十分重大。
3.2 强化医疗器械安全使用的质量保障
我国是人口大国,政府历来都十分重视医疗器械质量安全并把它作为一项事关人民安康、社会稳定和经济发展的大事来抓。项目建设完成后重点提升辖区内医疗器械等相关项目(参数)的检验能力,满足国家标准、行业标准对医疗器械相关参数检测需求,提升医疗器械产品质量监督的技术支撑能力,对保障公众用械安全具有重要意义。
4 结论与建议
2017年,由原国家食品药品监督管理总局主编的《医疗器械检验检测中心(院、所)建设标准(建标188-2017)》已正式发布,医疗器械检验机构实验室项目建设自此有了统一的标准,在项目建设方面,建议国家药监局及省政府支持,推动项目建设落实,解决省级单位在场地、设施环境等方面存在的实际困难,使检验机构能够充分发挥技术支撑作用,服务于医疗器械监管大局,严格规范检验,增强检验公信力,进一步提升检验能力,更好地促进省内医疗器械产业发展,为公众用械安全提供坚强的技术保障。
