靶向大鼠Vegf/Vegfr基因siRNA的基因沉默效应研究
2019-03-01陈林中日殷冬来赵泽婷韦芊含张雨梅
陈林中日 , 殷冬来 , 赵泽婷 , 韦芊含 , 陈 昕 , 张雨梅 ,2
(1. 扬州大学比较医学研究院, 扬州 225009;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心, 扬州 225009)
血管内皮生长因子(VEGF)是血管生成、血管新生中的关键调节因子[1]。VEGF与其受体(VEGFR)特异性结合, 能调节血管发生、形成, 参与造血以及淋巴管生成,也能通过改变肿瘤内环境而增加毛细血管通透性[2]。新血管的形成是肿瘤生长和转移过程中的一种基本活动。肿瘤的生长、转移依赖于肿瘤血管的新生, 且肿瘤细胞分泌VEGF。由于VEGF及VEGFR途径在肿瘤血管生成中的中心作用,已成为肿瘤学领域药物研发和基础研究的焦点[3]。近几年,VEGF家族成员及其相关的通路被认为是实体肿瘤重要的抗血管治疗靶点[4]。
RNA干扰(RNAi )是一种能特异性使得序列在转录后沉默的技术,具有高度特异性、高效性、高稳定性的特点。其方法是将外源双链小分子RNA转染进细胞,通过与目的基因mRNA特异性结合并使其降解,从而使目的基因表达降低,该技术广泛用于基因功能的研究[5]。本文根据大鼠Vegfa、Vegfr的基因序列,设计合成相应的小干扰RNA(siRNA), 转染大鼠血管内皮细胞, 通过RT-PCR和Western blot检测内皮细胞中VEGF及VEGFR的表达,筛选出有效沉默Vegf/Vegfr基因的siRNA序列,为进一步应用靶向Vegf/Vegfr基因RNA干扰抗血管生成的研究奠定试验基础。
1 材料与方法
1.1 实验动物
清洁级6周龄雄性Wistar大鼠, 体质量180 g左右。扬州大学比较医学中心提供[SCXK(苏)2017-0004],饲养于屏障系统中[SYXK(苏)2017-0044]。实验动物的使用及研究方案获扬州大学动物伦理委员会批准。
1.2 主要试剂
DMEM、Opti-MEM培养基, 美国Gibco公司;胎牛血清(FBS), 美国Hyclone公司; 重组大鼠VEGF165, 美国 Peprotech 公司; EntransterTM-R4000转染试剂,北京英格恩生物公司; 兔抗大鼠VEGF多克隆抗体、小鼠抗大鼠β-actin单克隆抗体、HRP标记IgG, 武汉博士德生物有限公司; 青链霉素、明胶、胰蛋白酶、兔抗大鼠FLK1多克隆抗体、兔抗大鼠FLT1多克隆抗体, 上海生工生物工程有限公司; BCA蛋白溶度测定试剂盒、PMSF、RIPA强蛋白裂解液、BSA粉、Tris-base、SDS、Tween-20、30%丙烯酰胺、TEMED、过硫酸胺等, 碧云天生物有限公司; PrimeScriptTMRT reagent Kit with gDNA Eraser、DL1000 DNA Marker、RNA提取试剂盒,TaKaRa (大连宝生物)公司。
1.3 主要仪器与设备
Leica DM3000倒置显微镜,德国Leica公司;Synergy小型纯水系统、0.22 mm Millex-GP过滤器,美国默克密理博公司; 多功能酶标仪,美国BioTek公司; PCR仪、Proteah电泳仪、凝胶成像系统,美国Bio-Rad公司; THZ-82A摇床,金坛市白塔金昌实验仪器厂; 细胞培养板,丹麦Corstar Corning公司。
1.4 方法
1.4.1 靶向Vegf/Vegfr基因siRNA序列的设计与合成 根据NCBI中大鼠Vegf-a ID-83785、Flt1(Vegfr1) ID-54251、Flk1 (Vegfr2) ID-25589基因序列,由上海吉玛生物有限公司分别设计合成三条候选siRNA序列,以及一条与目的基因序列无同源性的阴性对照序列(NC),和带有5-羧基荧光法(FAM)荧光标记的阴性siRNA序列(表1)。
1.4.2 大鼠内皮细胞培养 大鼠胸主动脉内皮细胞分离、纯化及鉴定方法参照文献[8]。Wistar大鼠的胸主动脉分离、清洗后, 用手术刀切成1 mm×1 mm的血管块, 移至铺好明胶的细胞培养瓶中, 使得血管内膜贴壁,加入1 mL的完全培养基后, 置于37 ℃,体积分数5%CO2恒温培养箱中培养,5 d后于倒置显微镜下观察,待有星形的内皮细胞迁出并生长良好时,弃去植块。当细胞长至80%时,弃去原培养基并用PBS洗2遍后,加0.25%胰蛋白酶1 mL,用差速消化法[8]去除杂细胞,终止消化,制成单细胞悬液后分瓶培养。经CD31免疫组化鉴定为血管内皮细胞后收集第3代血管内皮细胞用于以下的转染实验。
1.4.3 siRNA转染条件的筛选 将细胞密度调整为5×104个/mL的内皮细胞接种于24孔板中,每孔400 μL。次日分别取50 nmol/L, 80 nmol/L, 100 nmol/L的FAM标记的阴性siRNA加入50 μL的opti-MEM无血清培养基混匀, 制成RNA稀释液; 分别取0.4 μL,0.5 μL, 1.0 μL的EntransterTM-R4000转染试剂,加入50 μL的opti-MEM无血清培养基充分混匀制成EntransterTM-R4000稀释液。将EntransterTM-R4000稀释液和RNA稀释液进行单因素交叉试验筛选转染复合物的条件。将100 μL的转染复合物滴加到400 μL的完全培养基中,放入培养箱中培养。转染后6 h,弃去孔内培养基,PBS洗3遍后,于倒置荧光显微镜下观察荧光情况,确定转染效率。同时以未转染组(只加siRNA)作为阴性对照组。根据绿色荧光数确定转染效率较好的转染条件。

表1 靶向大鼠Vegf/Vegfr 基因siRNA序列及阴性对照序列Table 1 The siRNA sequences target on rat Vegf/Vegfr genes and negative control
1.4.4 靶向大鼠Vegf/Vegfr siRNA的转染 根据
1.4.3 中确定的转染条件, 以及24孔板与6孔板表面积的换算, 确定在6孔板中向内皮细胞转染Vegf/Vegfr siRNA的条件为: 6孔板中细胞数为1.4×104个/孔,使用100 nmol/L的siRNA与2.5 μL的转染试剂混合进行转染。试验分组如下: 正常组、只加转染试剂组(mock 组)、Vegf siRNA 组(si1157、si1263,、si1323)、Flt1 siRNA 组(si326、si2703、si3365)和Flk1 siRNA组(si1046、si1292、si1406)。于转染后24h检测细胞中Vegf/Vegfr的mRNA水平; 转染后48 h进行细胞中VEGF/VEGFR蛋白表达的检测。
1.4.5 靶基因沉默效应检测
1.4.5.1 Western blot检测VEGF/VEGFR的表达 转染细胞后48 h,加入含有PMSF蛋白酶抑制剂的RIPA裂解液于冰上裂解细胞2 min后,细胞刮刮取细胞裂解产物,12 000 r/min 4 ℃离心10 min,小心吸取上清即为蛋白样品。按BCA蛋白浓度试剂盒的说明书,测定样品中的蛋白浓度并调整至相同。加入6×上样缓冲液(loading buffer),沸水浴煮沸10 min,-20 ℃保存备用。
SDS聚丙烯酰胺凝胶电泳中,VEGF的分离采用5%浓缩胶和10%分离胶;FLT1和FLK1的分离采用5%的浓缩胶和8%的分离胶。待测样品加样15 μL,80 V恒压电泳约30 min,当溴酚蓝前缘进入分离胶后电压提到110 V至结束。300 mA恒流120 min进行转膜。转膜后,5%BSA室温封闭2 h,分别加入TBST稀释的VEGF,FLK1,FLT1及β-actin一抗(β-actin,VEGF抗体1∶300稀释;FLT1和FLK1抗体1∶800稀释),4℃孵育过夜。次日,TBST洗涤,100 r/min, 5 min×5次。加入1∶2 000稀释的二抗,室温孵育2 h。TBST洗涤,100 r/min,5 min×5次。然后加入ECL发光液,置凝胶成像系统拍照。使用Image J软件对条带的灰度值进行分析。
1.4.5.2 RT-PCR检测Vegf/Vegfr的mRNA水平 根据NCBI中大鼠Vegf、Flk1、Flt1、β-actin基因序列,使用premier5.0软件设计PCR引物,引物序列由上海生工生物有限公司合成。引物序列及产物片段大小如表2。
内皮细胞转染后24 h,弃去细胞培养液,PBS洗涤一次后加入350 μL的裂解Buffer RL(加入50 ×DTT Solution),按RNA提取试剂盒说明书操作,将裂解液转移到gDNA Eraser Spin Column中,12 000 r/min离心1 min; 向2 mL Tube中加入等体积的70%乙醇使溶液混合均匀。将混合液转到RNA Spin Column 中, 12 000 r/min 离心 1 min, 弃滤液。将RNA Spin Column放回到2 mL Collection Tube中。将400 μL的Buffer RWA加入至RNA Spin Column中, 12000 r/min 离心 30 s, 弃滤液。将 400 μL 的Buffer RWB加入至RNA Spin Column中, 12000 r/min离心30 s, 弃滤液。在RNA Spin Column膜中央处加入50 μL的不含RNase的蒸馏水室温静置5 min,12 000 r/min离心2 min,收集RNA。取1.0 μL RNA溶液,于260 nm和280 nm处测定吸光度(A)值,并计算A260/A280,检测RNA的纯度。并调节各样品中RNA浓度保持一致。

表2 RT-PCR扩增Vegf/Vegfr的引物Table 2 Primers of RT-PCR for Vegf/Vegfr genes
利用TaKaRa反转录试剂盒将mRNA反转录为cDNA, 预变性反应体系为及dNTP Mixture(10 mmol/L)1.0 μL,Oligo Primer(5 μmol/L) 1.0 μL,模板 RNA 600 ng,不含RNase蒸馏水加至10 μL。 cDNA合成条件为上述变性后反应液10 μL, 5×Prume ScriptⅡBuffer 4.0 μL, Prime ScriptⅡRTase 0.5 μL (20U),RNase Inhibitor (40μ/ μL) 1.0 μL,不含 RNase蒸馏水加至 20 μL。
RT- PCR反应体系为25 mL,正反向引物各0.5 μL, dNTP 2.0 μL, 酶 0.15 μL, 10 × buffer 2.5 μL,DNA 模板 1.0 μL, 蒸馏水 18.35 μL。RT-PCR 反应条件为95 ℃,5 min; (95 ℃,30 s; 56 ℃,40 s;72 ℃,45s)× 35; 72 ℃,5 min。RT-PCR 反应产物4℃保存。
1.5 统计分析
采用 Graph Pad Prism 5.0 统计软件进行数据处理,结果均以x- ± s表示。One-way ANOVA 用于显著性分析,P<0.05为差异有统计学意义。
2 结果
2.1 靶向vegf/vegfr基因siRNA对大鼠内皮细胞转染条件的筛选
FAM标记的阴性siRNA在转染6 h后的部分图片见图1。正常未转染组在荧光显微镜下无荧光,而100 nmol/L siRNA与0.5 μL或1.0 μL转染试剂时, 相比较于其他组合其荧光亮度及具有荧光细胞数较多, 转染效率较好(图1D,E)。选择100 nmol/L siRNA与0.5 μL转染试剂的组合为正式试验的转染条件,用于以下目的基因的转染试验。
2.2 蛋白水平筛选siRNA有效沉默序列
从图2可见,转染Vegf siRNA的三条siRNA序列(si1157, si1263, si1323)都对内皮细胞中 VEGF蛋白的表达起到了极显著的沉默效果(P<0.001)。对VEGF蛋白表达的抑制率,si1157约48%,si1263约60%,si1323达69%,si1323序列对VEGF蛋白表达的沉默效果最好。转染试剂组与对照组相比无统计学差异。
转染Flt1 siRNA的三条序列中,si326与si3365序列对FLT1蛋白的表达起到了明显的抑制作用,而si2703序列对FLT1蛋白的表达无明显影响。si326序列对FLT1表达的沉默效率约27%, si3365序列达70%,si3365序列对FLT1蛋白表达的沉默效率最好。转染试剂组与对照组相比无统计学差异。
转染Flk1 siRNA的三条序列中,si1292序列和si1406序列对FLK1蛋白的表达起到了显著的抑制作用(P<0.01),沉默效率si1292约62%,si1406序列约33%,si1292序列对FLK1蛋白表达的沉默效率最好。si1046序列对FLK1的表达无明显影响,转染试剂组与对照组相比无统计学差异。
2.3 mRNA水平筛选siRNA有效沉默序列
从图3可见,转染Vegf siRNA的三条siRNA序列(si1157,si1263,si1323)中,si1263和si1323都对内皮细胞中Vegf mRNA表达起到了极显著的沉默效果(P<0.001)。对Vegf基因表达的沉黙效率,si1263约47%,si1323序列达51%,si1323序列对Vegf mRNA表达的沉默效果最好,与正常组相比差异极显著(P<0.001)。
转染Flt1 siRNA的三条序列(si326,si2703,si3365)中,si2703序列与si3365对Flt1基因的表达起到了沉默效果。对Flt1 mRNA表达的沉默效率,si2703约16%,si3365序列达71%。si3365序列对Flt1基因表达的沉默效率最好,与正常组相比差异极显著(P<0.001)。
转染Flk1 siRNA的三条序列(si1046,si1292,si1406)中,只有si1292序列对Flk1基因的表达起到了极显著的沉默效果(P<0.001)。
3 讨论
靶向大鼠Vegf/Vegfr基因的siRNA序列,转染内皮细胞的最佳转染条件为100 nmol/L siRNA与0.5 μL的转染试剂组合。筛选出可以有效沉默Vegf基因的两条siRNA序列si1263和si1323,其中si1323序列的沉默效果更好; 靶向Flt1 基因的si3365可以有效沉默Flt1,而靶向Flk1 基因的si1292可以有效沉默Flk1基因。筛选出的靶向大鼠Vegf及Vegfr基因的siRNA有效序列,可作为血管生成及血管生成相关因子研究中的一种有效工具,为应用RNAi技术进行Vegf/Vegfr基因沉默研究奠定实验基础。
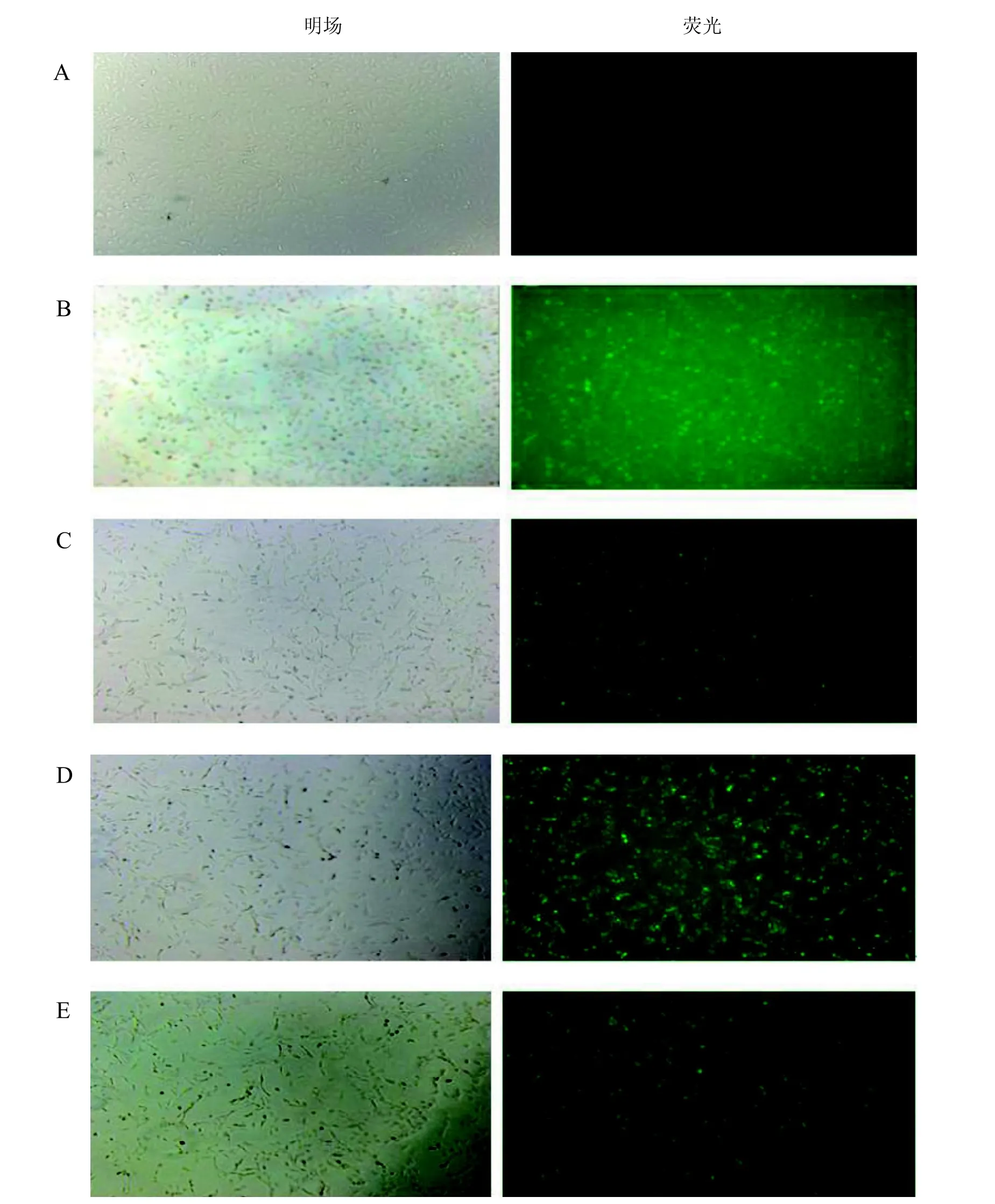
图1 不同剂量siRNA与转染试剂的转染效率Figure 1 Transfection effect of different dose siRNA and transfection reagent

图2 Western blot检测转染后VEGF/VEGFR的表达Figure 2 Western blot analysis for VEGF/VEGFR in endothelial cells transfected

图3 RT-PCR检测Vegf/Vegfr mRNA水平Figure 3 The mRNA levels of Vegf/Vegfr genes detected by RT-PCR
RNA干扰是一种在进化过程中存在的高度保守、由双链RNA分子诱发同源mRNA高效特异性降解的基因转录的沉默现象[7]。其中21-23nt的siRNA是RNAi中的关键因子[8]。由于RNAi具有高度特异性、可遗传性、高稳定性等优点而被广泛用于细胞内信号转导途径的分子机制研究。
RNAi提供了一种高效、方便、经济的干扰特异性基因表达的研究手段,并逐步发展成为肿瘤基因治疗、遗传性疾病治疗的重要方法。但随着研究的深入,许多研究表明并不是所有针对靶基因mRNA序列随机设计的siRNA都能起到有效的基因沉默,因此干扰靶序列的选择至关重要。本实验由上海吉玛针对大鼠Vegf/Vegfr基因设计3条siRNA序列,以确保至少有一条siRNA能够高效抑制靶基因的表达。同时设计一条阴性对照siRNA序列,并使用FAM荧光标记的阴性siRNA作为“阳性对照”观察转染效率,筛选出转染效率最高,细胞毒性最小的EntransterTM-R4000转染试剂的量(0.5μL)和siRNA的溶度(100 nmol/L)。使用转染试剂将靶向Vegf/Vegfr基因的siRNA按照筛选出的最佳终溶度100 nmol/L转染大鼠血管内皮细胞,经RT-PCR及Western blot方法检测mRNA水平和蛋白水平的沉默效果。结果表明靶向Vegf基因的3条siRNA序列中si1263和si1323序列对靶Vegf基因的沉默效果最佳; 靶向Flt1基因的3条siRNA序列中si3365序列沉默效果最佳; 靶向Flk1基因的3条siRNA序列中si1292序列干扰效果最好。
