利用CRISPR/Cas9技术构建环指蛋白126基因敲除小鼠
2019-03-01高梦樵艾东旭范君文孙兆增
高梦樵, 艾东旭, 李 钰, 孙 菲, 王 进, 范君文, 袁 征, 刘 源, 孙兆增
(1. 军事医学研究院实验动物中心, 北京 100071;2. 塔里木大学生命科学学院, 阿拉尔市 843300)
环指蛋白 126(ring finger protein 126, RNF126)是一种E3泛素连接酶, 与泛素激活酶E1、泛素结合酶E2共同参与真核生物体内特定蛋白的泛素化,从而诱导蛋白的降解。近期研究[1-4]表明, RNF126在许多肿瘤性疾病的发病中起关键性作用。抑制人类舌癌细胞SCC9与SCC25中RNF126基因的表达可以使癌细胞的增殖能力和活性下降[3]。在人乳腺癌组织中RNF126高度表达,并可同时作为判定侵润性乳腺癌预后不良的生物标记物[4]。有研究[5]显示在脑胶质瘤组织中,RNF126的表达显著高于正常脑组织。Rnf126位于小鼠的第10号染色体,其表达产物可通过促进产生非同源末端连接(NHEJ)以及同源重组(HR)的方式加快修复内源性或外源性因素造成的DNA双链断裂(DSB)[6]。但目前对于RNF126基因的作用靶点和作用机制的相关信息有待深入研究。
继锌指核酸酶(ZFNs)技术以及转录激活因子样效应物核酸酶(TALENs)技术两种基因定点修饰技术之后,CRISPR/Cas9[clustered regularly interspaced short palindromic repeats (CRISPR)/CRISPR-associated(Cas9)]技术以简单易行、成本低廉以及高效率等优点成为了近年来的热门基因编辑技术,并被应用于基础研究、生物工程、疾病模型构建以及基因治疗等领域[7]。该项技术的原理是, 由20~24个可变碱基组成的sgRNA以RNA-DNA配对的方式定位[8], 引领Cas9核酸内切酶[9]通过识别靶点处的PAM(protospacer adjacent motif)序列,同时核酸内切酶对靶序列进行切割,随后机体以NHEJ或HR的方式修复后产生精确且永久的突变[10]。本研究拟利用CRISPR/Cas9技术,建立Rnf126基因缺陷的小鼠模型,为进一步分析研究RNF126基因可能的作用靶点和作用机制奠定了基础。
1 材料与方法
1.1 实验动物
3.5~4 周龄雌性C57BL/6小鼠30只; 8~12周龄雄性C57BL/6小鼠1只; 8~12周龄ICR结扎雄鼠15只; 8~12周龄ICR母鼠15只,均来自军事科学院军事医学研究院实验动物中心[SCXK(军)-2017-0004]。
1.2 主要实验试剂及仪器
MEGA shortscriptTMT7 High Yield Transcription Kit(LOT:00652532)、mMESSAGE mMACHINETMT7(LOT:00642281)、MEGAclearTMKit(LOT:00672844)、PurelinkTMQuick Plasmid Miniprep Kit(LOT:00653130)均购自美国Invitrogen公司。SacI(LOT:AGY0812A)、ApaI(LOT:AGX0144A)、DraI(LOT:K355AA)限制性内切酶均购自日本TaKaRa公司。BsaI(LOT:0371509)限制性内切酶购自美国New Englant BioLabs公司。2× ES Taq Master Mix(LOT:01031/50301)、Mouse Tail Genomic DNA Kit(LOT: 50142)均购自康为世纪生物科技有限公司。Gel ExtractionKit(LOT:00D2500010000H01P026)购自美国Omega公司。BMTOP10 Competent Cell(LOT: 725964FF)、Golden View(LOT: 191847BB)以及相关引物均购自博迈德公司。注射用孕马血清激素(PMSG)以及注射用人绒毛膜促性腺激素(hCG)(生产批号: S180115, S171208)均购自宁波三生生物科技有限公司。体视显微镜(型号: smz-168TLED)购自德国麦克奥迪公司。显微注射用显微镜(型号:DP71)购自日本奥林巴斯公司。拉针仪(型号P-1000)购自美国Sutter公司。
1.3 实验方法
1.3.1 Rnf126基因敲除引物设计以及sgRNA表达载体的构建 根据NCBI中提供的参考基因组可知鼠源Rnf126基因全长8 497 bp(NC_000076.6),利用crispr.mit.edu网站在Rnf126基因的第四外显子内设计一对互补的敲除引物(引物序列为: 5'-CCAGTCTCGGCATCGGTACG-3'),并为引物添加黏性末端序列(上游5'端添加“TAGG”, 下游3'端添加“AAAC”),以用于连接pUC57载体。以逐步降温的方式使引物退火形成双链,并用质粒提取试剂盒提取pUC57质粒,然后使用BsaI对pUC57质粒进行酶切,胶回收后获得线性化pUC57载体。将退火后引物与线性化pUC57载体进行连接,并将连接后的重组质粒转化到感受态细胞中,通过卡那抗性固体培养基平板筛选菌株,后挑取单克隆菌株培养并取部分菌液送以测序。
1.3.2 sgRNA以及Cas9 mRNA的获得 使用质粒提取试剂盒提取构建好的sgRNA表达载体,用DraI对表达载体进行酶切并进行回收。同样从含有pST1374-N-NLS-flag-linker-Cas9质粒的菌液中提取Cas9质粒,后用SacI以及ApaI对质粒进行双酶切并使用乙醇沉淀法回收酶切产物。分别用MEGAshortscriptTMT7 High Yield Transcription Kit以及mMESSAGE mMACHINETMT7对线性化后的sgRNA表达载体以及Cas9质粒进行体外转录,并使用MEGAclearTMKit获得纯度及浓度良好的sgRNA以及Cas9 mRNA。
1.3.3 小鼠超数排卵、显微注射以及胚胎移植 通过腹腔注射的方式向预先准备好的30只3.5~4周龄雌性C57BL/6小鼠注射PMSG以及hCG,每只的注射剂量约为10 U, 两次注射时间间隔为48 h。将注射激素后的雌鼠以及1只8~12周龄C57BL/6雄鼠在给药后18 h处死,分别收集雌鼠的输卵管膨大部和雄鼠的附睾,在体式显微镜下分别取出卵子和精子。使精子在获能液中获能后,取液体边缘精子滴加入短暂培养的卵细胞中,体外受精3~4 h。将制备好的sgRNA与Cas9 mRNA分别用无RNA酶水稀释至25 ng/μL和50 ng/μL。通过显微注射的方式将RNA导入到受精卵的细胞质中,并移植到与结扎雄鼠合笼的见栓ICR母鼠输卵管膨大部,缝合后将移植母鼠饲养于IVC环境中。
1.3.4 子代工程鼠的基因型鉴定 仔鼠出生后约21 d,对其进行耳号标记, 并剪下0.5 cm鼠尾组织, 使用Mouse Tail Genomic DNA Kit提取鼠尾基因组。并利用引物设计软件设计一对鉴定用PCR扩增引物(上游引物序列:5'-CCGGCAGCCATTTGAGGTGAG-3',下游引物序列: 3'-TTCGGAATT GGGAGTGCTACA-5',产物长度603 bp)。使用2× ES Taq Master Mix构建PCR扩增体系, 并在PCR仪上运行如下程序: 95 ℃5 min, 94 ℃ 30 s, 58 ℃ 40 s, 72 ℃ 1 min, 34 次循环扩增, 72 ℃ 5 min。对扩增结果进行克隆测序。
1.3.5 工程鼠的饲养与扩大繁殖 通过对F0代工程鼠的鉴定,筛选出基因完全敲除的Founder鼠,并与野生型C57BL/6小鼠进行交配。在所获得的F1代小鼠中,利用上述鉴定方法再对其敲除情况进行鉴定,筛选出敲除情况相同且性别不同的小鼠进行近交,以达到规模化繁育的目的。
2 结果
2.1 成功构建针对小鼠Rnf126基因的sgRNA表达载体
从菌液的测序结果(图1)可知, 菌液中携带的重组载体中插入了针对鼠Rnf126基因所设计的敲除引物序列, 成功获得了Rnf126基因 sgRNA表达载体。
2.2 成功获得sgRNA以及Cas9 mRNA
通过体外转录及纯化回收,成功获得了高浓度且纯度良好的sgRNA及Cas9 mRNA,浓度约为1 200 mg/L和800 mg/L, 电泳检测结果如图2所示。
2.3 子代工程鼠基因型鉴定
显微注射后,收获了82枚受精卵,将这些卵移植至3只见栓代孕ICR母鼠的双侧输卵管膨大部。待其生产后,共获得F0代仔鼠11只。对其进行基因型鉴定后,选出一只单链缺失62个碱基的敲除鼠作为Founder鼠,其PCR产物峰图及序列比对图如图3和图4所示。该鼠缺失位于Rnf126基因的4849~4910处。在其出生后70 d与野生型C57BL/6雌鼠1∶2合笼。所得F1代仔鼠基因型PCR鉴定结果如图5所示, 杂合子电泳结果可在约600 bp的位置清晰可见两条电泳条带,而野生型仅有一条。证明该缺失可被稳定遗传。
2.4 氨基酸序列预测分析

图1 sgRNA表达载体测序结果
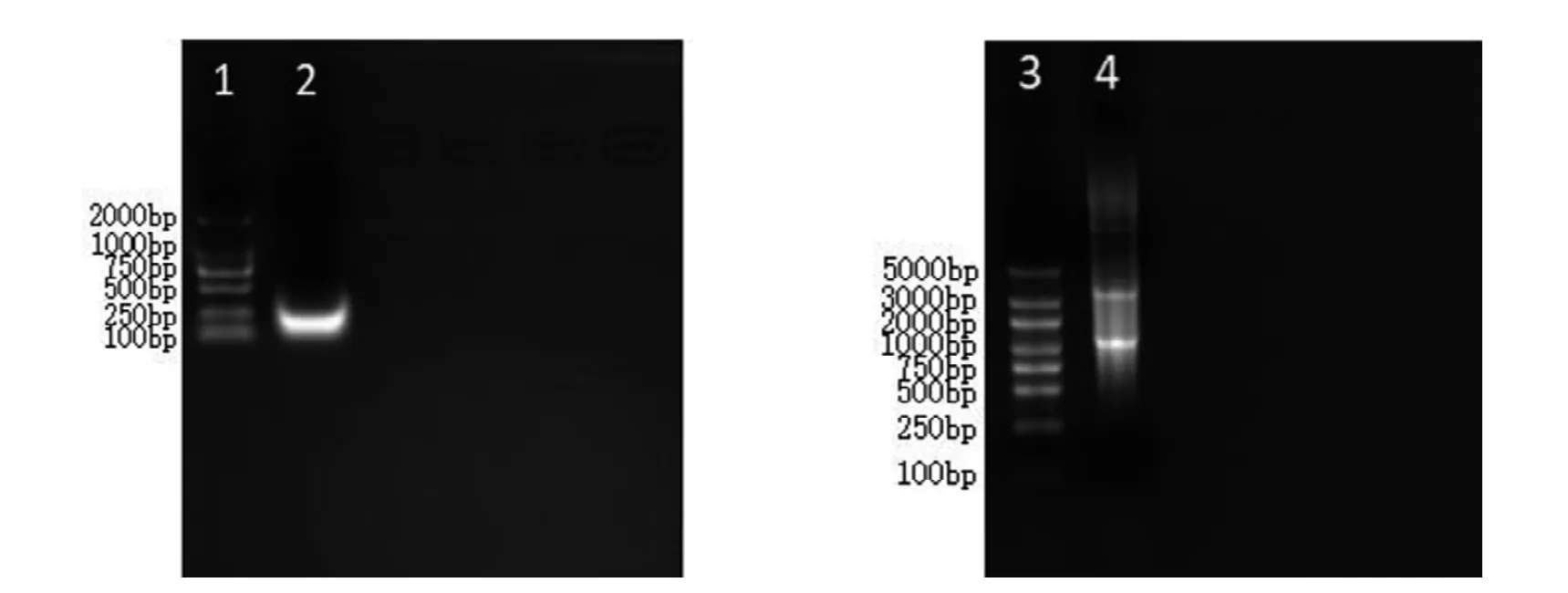
图2 Rnf126 sgRNA以及Cas9 mRNA电泳图
利用ORF Finder网站(http://www.bioinformatics.org/sms2/orf_find.html)对基因敲除前后所编码的氨基酸序列进行分析。从分析结果可知,野生型小鼠的Rnf126基因编码313位氨基酸。敲除鼠因发生了移码突变, 导致从第122位密码子起, 编码的氨基酸出现改变。突变还导致在该基因的第178位密码子后提前出现终止密码子。
3 讨论

图3 Founder鼠Rnf126基因相关区域的测序结果

图4 Founder鼠与Rnf126基因序列比对图
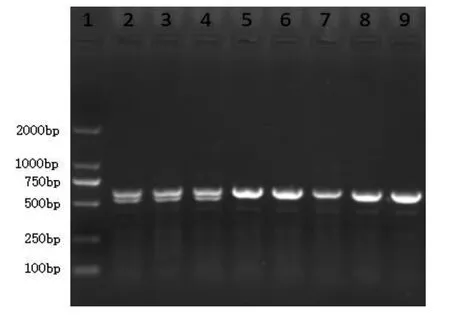
图5 F1代工程鼠PCR鉴定图
近年来,RNF126基因的生物学功能研究成为热门。许多癌变组织中都检测到了RNF126的高度表达。RNF126基因之所以与肿瘤细胞的增殖密切相关, 可能有两方面原因。首先, RNF126的作用底物主要包括p21等肿瘤抑制因子, 通过降解这些底物从而促进了肿瘤细胞的增殖[11]。其次,RNF126与另外一种E3泛素连接酶BCA2有着相似的蛋白质结构, 而BCA2与乳腺癌的发病有着密切的联系, 故推测RNF126可能与BCA2有着相似的生物学功能[12]。同时,RNF126是一种DNA双链断裂修复蛋白,在放疗和化疗过程中细胞内的RNF126会以促进同源重组或非同源末端连接等易错修复方式进行修复,这也给癌症疾病的预后造成了不良影响[4]。在本研究中,针对小鼠Rnf126基因的第四外显子内设计了一对sgRNA敲除引物,利用CRISPR/Cas9技术,通过显微注射的方式将体外合成的sgRNA以及Cas9 mRNA导入到小鼠受精卵中,成功建立了Rnf126基因缺失的C57BL/6小鼠模型,为探寻RNF126与肿瘤疾病的关系这一研究方向上提供一种全新的哺乳动物模型,便于更加系统、全面地研究RNF126基因及其表达产物的生物学功能。
本研究利用CRISPR/Cas9技术在C57 BL/6小鼠的Rnf126基因中实现了62个碱基的敲除。在前期获取RNA的实验中,我们均采用乙醇沉淀的方法去纯化回收体外转录所需的线性化模板,该方法具有以下优点: ①可以保证模板的回收效率。切胶回收虽然可回收特定的DNA模板但是无法达到很高的回收浓度,较高的回收浓度对获取高浓度、可储存的RNA是必需的。另外对于体外转录实验,无需单一回收特定的线性化模板,使用该方法回收全部产物后,转录酶会去特异地识别载体上的启动子序列,仅对特定的模板进行转录。②可以更好控制模板的回收纯度。通过使用体积分数75%乙醇对回收产物进行一次或多次的洗涤,可以很好获得高纯度的模板,保证了体外转录实验的成功率;在显微注射的准备工作中,我们将用于注射的RNA样品进行高速离心以使杂质沉淀,这样可降低堵针的概率并提高注射后受精卵的存活率。
在进行基因筛选时,我们选取一只单链缺失62个碱基的雄鼠用于其后的建系繁育。经分析,该缺失全部位于小鼠Rnf126基因的第四外显子内,且缺失数非3的倍数,在缺失了大量碱基的基础上还造成了移码突变。通过对氨基酸序列的分析可知,该突变导致Rnf126基因从第122位密码子起,编码的氨基酸发生改变,发生改变的氨基酸共计57个,且在第178位密码子后提前出现终止密码子,从而沉默了135个密码子的表达,严重干扰了RNF126蛋白的正常合成。在对F1代工程鼠的基因型鉴定中,我们发现杂合缺失小鼠的数量与野生型小鼠的数量大致呈1∶1,证明该突变被稳定遗传。在F2代小鼠的基因型鉴定中,由于用于繁育的阳性小鼠数量较少,暂时没有得到双链缺失的纯合子个体。待得到纯合子后,拟检测纯合子小鼠及野生型小鼠之间RNF126蛋白的表达差异并进行其相关生物学功能研究。
