基于临床肿瘤标本的胃癌转移模型建立
2019-03-01王洁赵宁宁张彩勤赵勇谭邓旭吴朋朋赵菊梅师长宏
王洁,赵宁宁,张彩勤,赵勇,谭邓旭,吴朋朋,赵菊梅,师长宏*
(1. 延安大学医学院,延安 716000; 2. 空军军医大学实验动物中心,西安 710032)
胃癌是我国常见的恶性肿瘤,多数患者就诊时已达到进展期,甚至出现远处转移,从而给胃癌的根治性治疗带来困难[1]。因此,胃癌的侵袭和转移机制已成为胃癌防治研究的关键环节。成功建立真实模拟人胃癌组织细胞侵袭和转移生物学行为和特征的动物模型已成为胃癌研究的重要前提。将人体新鲜的肿瘤组织移植到免疫缺陷小鼠体内建立的胃癌患者异种移植(patient-derived tumor xenograft,PDX)模型,较好的保持了原发瘤的异质性[2],但该类模型主要移植于裸鼠皮下,很难发生与临床相近的转移特征[3]。将肿瘤移植到与人体原发部位相应的动物器官形成的原位移植可获得与原发瘤相似的微环境,促进原发肿瘤的基因和生物学特性的表达,模拟胃癌体内演进过程[4-5],从而可能形成个体化的转移模型。因此,本研究拟通过将胃癌PDX模型的瘤组织原位移植,期望筛选获得相应的转移模型,从而为胃癌的转移研究提供良好的动物模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性BALB/c裸鼠10只,6 ~ 7周龄,体重22 ~ 25 g,购自北京维通利华【SCXK(京)2016-0011】,饲养在空军军医大学实验动物中心屏障设施内【SYXK(陕)2014-001】。环境温度23 ~ 25℃,相对湿度40% ~ 60%,12 h昼夜交替,饲料经辐照处理,饮用水经高压灭菌处理,动物自由摄食和饮水。
1.1.2 临床材料
临床胃癌标本来自第四军医大学西京医院消化病医院,肿瘤标本的取得经过患者本人及家属同意,并签署知情同意书,相应实验通过西京医院医学伦理委员会的批准,批准编号:2015432。动物实验通过了第四军医大学实验动物福利及伦理委员会批准(14013)。
1.1.3 实验试剂
组织基因组DNA提取试剂盒由北京天根生化科技有限公司提供。肿瘤移植所用基质胶(Matrigel Matrix)由美国BD公司生产。胎牛血清购自浙江天杭生物科技股份有限公司,苏木精和伊红染色液购自北京Leagene生物技术有限公司。七甲川花菁近红外荧光(near-infrared fluorescence,NIRF)染料MHI-148由美国Cedars-Sinai Medical Center,Leland Chung教授提供[6],异氟烷麻醉剂购自深圳市瑞沃德生命科技有限公司。
1.2 方法
1.2.1 皮下移植建立PDX模型
将临床获得新鲜的胃癌手术标本剪碎为3 mm3,混合适量的基质胶,利用穿刺针移植到裸鼠背部皮下,成瘤后当体积生长至800 m3~ 1000 m3时(命名为P1代),异氟烷麻醉小鼠,手术获取肿瘤组织在另一只裸鼠皮下进行传代,命名为P2代,以此类推。每代冻存肿瘤组织(冻存液成分为:10% DMSO + 90%胎牛血清)。取P3代瘤组织,部分移植裸鼠皮下,连续测量肿瘤体积,肿瘤长度(l)和宽度(w),肿瘤体积(V),公式为:V=1 /2 ×(w2×l),绘制肿瘤生长曲线[7];部分肿瘤组织,4%多聚甲醛固定,石蜡包埋切片,进行HE染色,光学显微镜下观察。
1.2.2 肿瘤组织溯源性检测
利用组织基因组DNA提取试剂盒按照说明书提取P1代肿瘤组织的DNA,将提取的DNA通过BioTek公司的微孔板酶标仪检测DNA含量。将10 ng/μL含量的DNA送至西京医院医学鉴定中心进行STR检测。
1.2.3 原位移植模型的制备
实验前裸鼠禁食6 h,异氟烷麻醉裸鼠,腹部碘伏消毒,手术切开并暴露胃,进一步切开胃部肌层,将P1代肿瘤组织1 mm3包埋于肌层,手术缝合并关腹。持续观察小鼠的体征状态。
1.2.4 活体成像检测转移的发生
移植一月后,编号为C19751的小鼠出现明显消瘦症状,NIRF染料MHI-148腹腔注射小鼠,剂量为每只10 nmol,24 h后使用Caliper Lumina II小动物光学成像系统测定小鼠肿瘤部位NIRF强度ROI(regions of interest, ROI)[8]。
1.2.5 转移瘤的分析
待小鼠持续消瘦,施于安死术,立即解剖,观察各个脏器的转移的情况,取部分转移灶4%多聚甲醛固定,石蜡包埋切片,进行HE染色,光学显微镜下观察;部分转移灶移植裸鼠皮下,动态测量肿瘤体积的变化,待体积生长至800 mm3~1000 mm3时,取部分组织进行STR基因分型检测。
1.2.6 PCR-Array分析
Trizol法提取原发瘤和转移瘤组织样品中的RNA,随后用RNeasy® MinEluteTM纯化试剂盒(Qiagen)对提取的RNA进行纯化,使用NanoDrop® ND-1000测定RNA浓度和纯度后,按SuperScript. III Reverse Transcriptase(Invitrogen)说明书进行cDNA合成,用RT2ProfilerTMPCR Array Human Tumor Metastasis试剂盒(Qiagen,PAHS-028Z)进行实时定量PCR(Real-Time PCR)分析[9]。实验过程和结果分析均由上海康成生物工程有限公司完成。
1.3 统计学方法
2 结果
2.1 胃癌 PDX模型的生长特征及组织形态学观察
根据PDX模型肿瘤生长情况,连续测定肿瘤体积,绘制标本C19751移植瘤的生长曲线,记为C19751-Con。进一步将肺部和肝转移灶皮下移植裸鼠,结果仅有肺部转移灶形成明显的实体瘤,肝部没有形成实体瘤,同时绘制肺转移瘤皮下生长曲线,记为C19751-Met。结果见图1A。生长曲线显示肿瘤呈现指数生长趋势,符合肿瘤生长的特点。且转移瘤与原发瘤相比,没有显著差异。瘤组织HE染色后,结果见图1B,肿瘤组织腺体生长丰富,肿瘤细胞处于增殖旺盛阶段,符合胃腺癌的特征,小鼠移植瘤与原发瘤基本保持相同的形态结构。
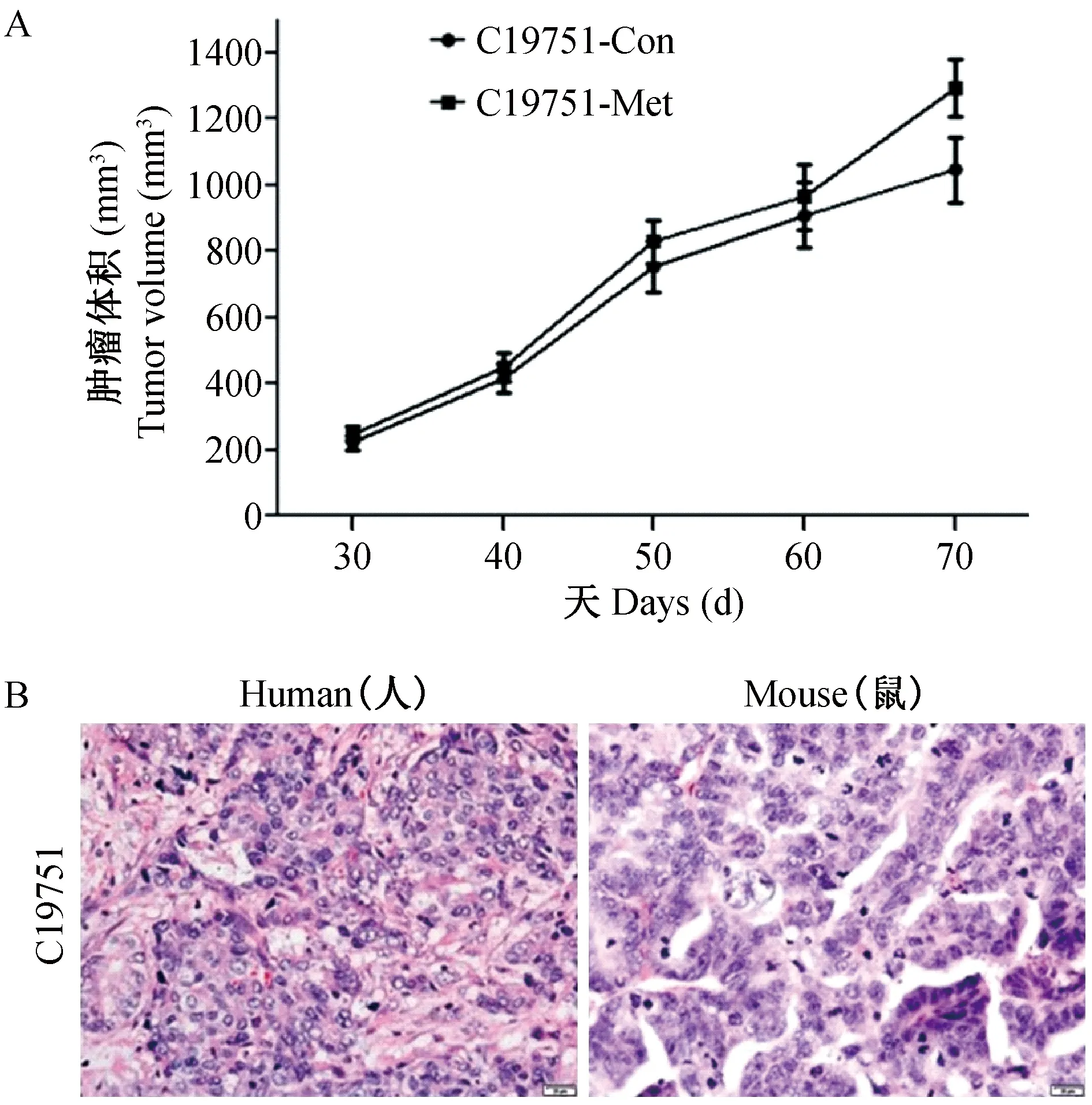
注:A. C19751(原发瘤/转移瘤)生长曲线(Con为原发瘤,Met为肺转移瘤); B. 组织学特征。(标尺=20 μm)图1 PDX模型的生长曲线及组织结构(H&E染色,×400)Note. A. Growth curves for the C19751 mouse (Con is primary tumor, Met is metastatic tumor). B. Histologic characteristics (bar=20 μm).Figure 1 Growth curves and histologic characteristics of the PDX models (H&E staining,×400)
2.2 肿瘤组织溯源性STR检测
STR(short tandem repeat)检测所选取的16个位点具有种属特异性,是从人类的23对染色体中所挑选的等位基因,多态性程度高。STR由2 ~ 6个碱基构成一个核心序列,核心序列串联重复排列,序列和重复次数决定多态性[10]。检测结果表明,从人类染色体上选取的16个位点均检测到信号,原始患者组织、小鼠皮下移植瘤、小鼠胃癌原位移植组织及小鼠肺转移瘤同源性为99.99%(图2)。

注:A. 小鼠皮下移植瘤; B. 小鼠肺转移瘤; C. 原始患者组织; D. 小鼠原位移植组织。图2 PDX模型STR检测Note. A. Mouse xenograft. B. Mouse lung metastasis; C. Primary patient tissue; D. Mouse orthotopic xenograft.Figure 2 STR detection of the PDX models
2.3 转移模型的特征
将3例临床胃癌手术标本采用裸鼠皮下移植的方法成功建立了PDX模型,进一步原位移植一个月后,C19751模型组显著消瘦,注射肿瘤靶向性NIRF染料,活体成像结果显示MHI-148染料特异性集聚在肿瘤部位;并同时在胃部、肝部和肺部出现荧光信号(图3A)。解剖小鼠后,肉眼可看到部分小鼠在肝部有肿瘤病灶、部分小鼠在肺脏有肿瘤病灶(图3B和3C),进一步固定组织进行HE染色,观察到肺和肝组织中出现明显的肿瘤侵入形态结构(图4)。进一步将肺部转移瘤组织裸鼠皮下移植,大约3个月便可形成肺转移瘤,转移发生率高达到90%。
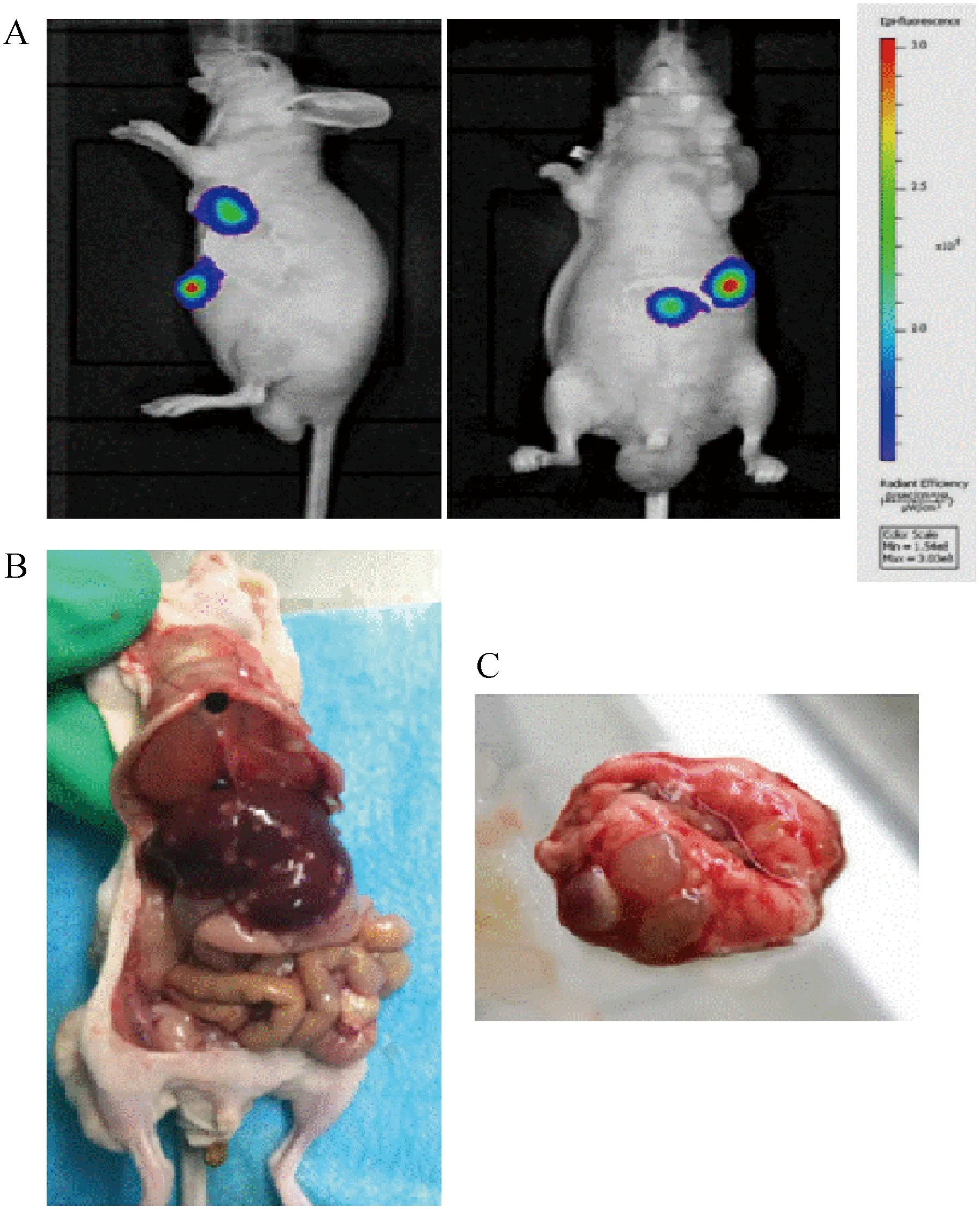
注:A. 近红外荧光活体成像结果; B. 肝转移灶; C. 肺转移灶。图3 近红外荧光活体成像及转移灶Note. A. NIRF optical imaging. B. Liver metastatic lesions. C. Lung metastatic lesions.Figure 3 NIRF optical imaging and metastatic lesions
2.4 胃癌转移相关基因的分析
RT2ProfilerTMPCR Array Human Tumor Metastasis试剂盒含有84个SYBR® Green优化的肿瘤转移相关基因引物,并含有相应的反应体系质量控制。实时定量PCR(real-time PCR)结果分析采用ΔΔCt 方法。首先计算每个处理组中的每个转移相关基因的ΔCt(ΔCt=average Ct-average of HK gene Ct),随后计算两组PCR Array中每个基因的ΔΔCt(ΔΔCt=ΔCt组2-ΔCt组1,组1是原发瘤,组2是转移瘤),最后通过2-ΔΔCt计算组2与组1对应基因的表达。分析结果见图5。有三个基因表达显著上调,涉及CXCL12,IGF1和MMP2,上调倍数分别达到(18.09 ± 3.8),(13.30 ± 2.66)和(6.09 ± 1.78),与原发瘤相比差异有显著性(P< 0.01)。
3 讨论
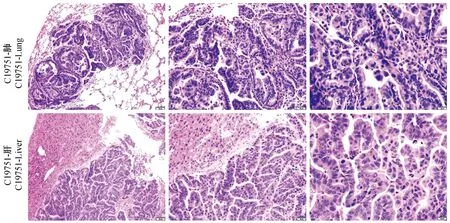
图4 肺和肝转移瘤组织结构(H&E染色,×400,标尺=20 μm)Figure 4 Histology of metastatic lesions in the lung and liver (H&E staining, ×400,Scale bar=20 μm)
肿瘤转移的发生主要取决于肿瘤细胞的转移潜能和生长的微环境[11]。特别是与肿瘤发生相匹配的基质环境能够影响肿瘤的分化、基因的表达和转移的发生。通过手术将肿瘤组织移植到与原发部位相应动物器官的原位移植(patient-derived orthotopic xenograft,PDOX)可提供适合肿瘤生长的体内环境[12];有利于肿瘤特异性抗原的表达,维持肿瘤的异质性;由于移植部位血供丰富,有利于肿瘤转移的发生。与皮下移植相比,PDOX模型更准确、客观地模拟人体肿瘤的体内演进过程,易形成与临床肿瘤相似的转移特征[13]。Lang等[14]将一例临床肾癌组织标本皮下移植后获得PDX模型,进一步将皮下瘤组织原位肾包膜移植,3周后发生肺转移,4周后发生脑转移,体现出较强的转移潜能。我们通过皮下移植建立的14例胃癌PDX模型,无一例发生转移,而将3例PDX模型的F0代瘤组织原位移植裸鼠5周后,就有一例(C19751)发生了肝和肺转移(图3)。
早期转移的发生无法用肉眼观察。七甲川菁(heptamethine cyanine)近红外荧光染料MHI-148可特异性识别肿瘤细胞,不需标记探针可直接用于肿瘤模型的活体成像,具有成像和靶分子的双重功能[15]。研究发现肿瘤细胞对该类染料的吸收主要通过缺氧和活化的HIF1α/OATPs信号实现,从而使该类染料具有了肿瘤靶向性。由于胃癌的形成和发展与缺氧和活化的HIF1α/OATPs分子密切相关[16],这与NIRF染料的靶向识别机制相对应。从而不需标记靶分子,直接用于胃癌模型的检测。基于此,本研究将NIRF染料MHI-148用于胃癌PDOX模型的活体成像,不仅检测到胃部移植瘤,而且成功检测到了肝转移和肺转移病灶,验证了该类染料的肿瘤靶向性,为转移瘤的早期检测提供了有效的影像学方法。

注:Con为原发瘤,Met为转移瘤,与原发瘤比较,**P< 0.01。图5 PCR-Array分析Note. Con is primary tumor, Met is metastatic tumor. Compared with the primary tumor,**P< 0.01.Figure 5 Results of PCR-array analysis
来源于不同肿瘤患者的胃癌细胞具有不同的转移潜能,这为转移模型的筛选提供了材料。通过原位移植可以保持原发瘤的异质性,促进转移相关基因的表达。与胃癌转移相关的分子报道较多,这些分子在鉴别胃癌转移潜能方面存在争议,特别是单个分子表型的可靠性和特异性较差,缺乏临床的应用验证。PCR-Array分析显示,与原发瘤相比较,C19751中趋化因子CXCL12(CXC chemokine ligand 12)、胰岛素样生长因子1 受体(insulin-like growth factor 1 receptor,IGF1R)和基质金属蛋白酶2(matrix metalloproteinase-2,MMP2)表达均显著上调。CXCL12属于CXC 类趋化因子家族,趋化因子受体CXCR4(chemokine receptor 4)是CXCL12 的特异性受体,两者的结合具有专一性,称为CXCL12 / CXCR4轴。该生物轴可调控肿瘤细胞增殖、迁移及侵袭,促进肿瘤血管生成[17]。其中CXCR4 的阳性表达与胃癌的腹腔转移有密切关系,CXCL12-CXCR4 轴可作为评估胃癌腹腔转移的重要指标。IGF1是酪氨酸蛋白激酶家族的成员之一,调节细胞增殖、凋亡、血管内皮生长因子的表达等。研究表明,IGF1受体(IGF1R)在多种肿瘤组织中高表达,参与肿瘤的发生发展过程。IGF1R信号通路对肿瘤细胞侵袭、迁移、增殖和肿瘤的发生发展等过程发挥重要作用[18]。IGF1R 基因的表达量下降可降低胃癌细胞的侵袭、迁移能力。MMP2是MMP家族重要成员,与胃癌的侵袭、转移和生存状态密切相关。该酶主要通过消化基底膜中Ⅳ型胶原纤维来介导血管侵袭和转移。MMP2阳性表达的胃癌组织更易发生转移,与胃癌的浸润深度、淋巴管浸润、区域淋巴结转移及TNM分期有关[19]。
本研究胃癌肿瘤标本原位移植后只发生了肺和肝的转移,但皮下移植后仅有肺的转移灶形成实体瘤。分析原因可能是肝转移病灶肿瘤细胞数量较少,很难在皮下形成实体瘤,需要进一步筛选肝转移瘤获得更多的转移病灶。获得的肺转移瘤通过反复筛选后,直接皮下移植便可形成肺转移瘤,转移发生率达到90%以上,说明该肿瘤具有较强的肺转移潜能。该模型为临床胃癌的转移研究提供了有效的个体化模型。
参考文献
[1] Ratti M, Lampis A, Hahne J C, et al. Microsatellite instability in gastric cancer: molecular bases, clinical perspectives, and new treatment approaches [J]. Cell Mol Life Sci. 2018, 75(22): 4151-4162.
[2] Cassidy JW, Caldas C, Bruna A. Maintaining tumor heterogeneity in patient-derived tumor xenografts [J]. Cancer Res. 2015, 75(15): 2963-2968.
[3] Hiroshima Y, Maawy A, Zhang Y, et al. Patient-derived mouse models of cancer need to be orthotopic in order to evaluate targeted anti-metastatic therapy[J]. Oncotarget. 2016, 7(44): 71696.
[4] Izumchenko E, Meir J, Bedi A, et al. Patient-derived xenografts as tools in pharmaceutical development [J].. Clin Pharmacol Ther.2016, 99(6): 612-621.
[5] Kawaguchi K, Igarashi K, Murakami T, et al. Tumor-targeting Salmonella typhimurium A1-R sensitizes melanoma with a BRAF-V600E mutation to vemurafenib in a patient-derived orthotopic xenograft (PDOX) nude mouse model [J]. J Cell Biochem. 2017, 118(8): 2314-2319.
[6] Shi C, Wu JB, Chu GC, et al. Heptamethine carbocyanine dye-mediated near-infrared imaging of canine and human cancers through the HIF-1alpha/OATPs signaling axis [J]. Oncotarget. 2014, 5(20): 10114-10126.
[7] 张贺,张彩勤,赵勇,等. 基于临床手术标本的胰腺癌原位移植模型建立及评价 [J]. 中国实验动物学报. 2018(03): 296-301.
Zhang H, Zhang CQ, Zhao Y, et al. Establishment and characterization of a patient-derived orthotopic xenograft (PODX) model of pancreatic cancer [ J ]. Acta Lab Animalis Sci Sin, 2018, 26 (03): 296 - 301.
[8] Rapic S, Vangestel C, Verhaeghe J, et al. Characterization of an orthotopic colorectal cancer mouse model and its feasibility for accurate quantification in positron emission tomography [J]. Mol Imag Biol, 2017, 19(5): 762-771.
[9] Zhu W, Cai M, Tong Z, et al. Overexpression of EIF5A2 promotes colorectal carcinoma cell aggressiveness by upregulating MTA1 through C-myc to induce epithelial-mesenchymal transition [J]. Gut. 2012, 61(4): 562-575.
[10] 张贺,陈薛,谭邓旭,等.基于肿瘤个体化治疗药物筛选的异种移植模型评价策略[J].中国实验动物学报. 2018(04): 523-527.
Zhang H, Chen X, Tan DX, et al. Evaluation strategy of patient-derived xenograft models based on drug-screening of individualized treatment [J]. Acta Lab Anim Sci Sin, 2018, 26(04): 523-527.
[11] Monsky WL, Mouta Carreira C, Tsuzuki Y, et al. Role of host microenvironment in angiogenesis and microvascular functions in human breast cancer xenografts: Mammary fat pad versus cranial tumors1 [J]. Clin Cancer Res, 2002, 8(4):1008-1013.
[12] Sicklick JK, Leonard SY, Babicky ML, et al. Generation of orthotopic patient-derived xenografts from gastrointestinal stromal tumor [J]. J Transl Med. 2014, 12: 41.
[13] Murakami T, Murata T, Kawaguchi K, et al. Cervical cancer patient-derived orthotopic xenograft (PDOX) is sensitive to cisplatinum and resistant to Nab-paclitaxel [J]. Anticancer Res. 2017, 37(1): 61-66.
[14] Lang H, Béraud C, Bethry A, et al. Establishment of a large panel of patient-derived preclinical models of human renal cell carcinoma [J]. Oncotarget. 2016, 7(37): 59336.
[15] 王勤周,张成,李丽,等. 七甲川菁荧光染料在肝细胞癌移植模型活体成像中的应用 [J]. 实验动物与比较医学. 2018(04): 250-254.
Wang QZ, Zhang C, Li L, et al. The Application of heptamethine cyanine dye in optical imaging of hepatocellular carcinoma transplantation model [J]. Lab Anim Comp Med, 2018, 38(4): 250-254.
[16] Shi C, Wu JB, Pan D. Review on near-infrared heptamethine cyanine dyes as theranostic agents for tumor imaging, targeting, and photodynamic therapy [J]. J Biomed Optics. 2016, 21(5): 50901.
[17] Balkwill F. The significance of cancer cell expression of the chemokine receptor.CXCR4 [J]. Semin Cancer Biol. 2004, 14(3): 171-179.
[18] 罗玉政,陈波,李红樱. 沉默IGF1R表达对胃癌细胞侵袭与迁移能力的影响及机制 [J]. 中国临床研究. 2018(02): 163-166.
Luo YZ, Chen B, Li HY. Effect of silencing IGF1R expression on invasion and migration abilities of gastric cancer cells and its mechanism [J]. Chin J Clin Res 2018, 31(02): 163-166.
[19] 李倩玉,韩冬艳,蒋虹伟,等. p28、MMP2、β-catenin在胃癌及淋巴结转移癌中的表达 [J]. 诊断学理论与实践. 2016(02): 169-173.
Li QY, Han DY, Jiang HW, et al. Expressions of p28, MMP2 and β-catenin proteins in human gastric carcinoma and metastatic lymph nodes [J]. J Diagn Concepts Practice, 2016, 15(02): 169-173.
