广西贵港地区猪繁殖与呼吸障碍综合征调查分析
2019-03-01张书祥何奇松孔子荣郭建刚周庆安黄胜斌韩银华
张书祥,何奇松,孔子荣,郭建刚,周庆安,黄胜斌,韩银华,熊 毅*
(1.广西大学动物科学技术学院,广西 南宁 530004;2.广西动物疫病预防控制中心,广西 南宁 530001)
【研究意义】猪繁殖与呼吸障碍综合征(PRRS)俗称蓝耳病,是由猪繁殖与呼吸障碍综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)引起的一种以母猪流产、早产、死胎和木乃伊胎等以及仔猪和育肥猪发生呼吸道为特征的传染病[1]。高致病性猪繁殖与呼吸障碍综合征(HP-PRRS),是由PRRSV变异而引起的一种急性、高传染性、高致病性传染病。20世纪90年代初猪繁殖与呼吸障碍综合征在欧洲大爆发,一共造成了超过100万头猪死亡[2-4]。高致病性猪繁殖与呼吸障碍综合征于2006年底传入广西,2007年底引起大爆发[5]。广西地区近年来养猪业发展迅速,特别是贵港地区年出栏数稳步上升,成为当地经济发展的重要组成板块。开展广西贵港地区猪繁殖与呼吸障碍综合征调查分析可为该地区猪繁殖与呼吸障碍综合征的疫情控制、流行状态、防治重点提供科学参考。【前人研究进展】PRRSV是动脉炎病毒属(Arterivirus)成员,单股正链RNA,长约15 kb,共有10个开放阅读框(ORF),编码多个非结构蛋白和8个结构蛋白[6]。20世纪国内外有关研究学者从猪病体内分离出该病毒[7-9],宋云义等[10]研究结果表明,旧的商品猪场种猪群蓝耳病阳性率为98.18 %,仔猪群阳性率为78.65 %,而新建商品猪场种猪群蓝耳病阳性率为63.64 %,仔猪群阳性率为9.52 %。2006年,猪繁殖与呼吸障碍综合征在中国的10多个省(市,区)检测到,超过2百万头感染,约40头猪死亡[11],彭红[12]对湖南省桑植县的578份血样进行了PRRSV抗原检测,阳性率为43.51 %;杨泽林]等[13对重庆市794份组织样品进行了HP-PRRSV检测,阳性率为85.1 %。任奕先[14]等对广西桂林地区PRRS流行情况进行调查,PRRS的阳性率为22.9 %;HP-PRRSV在我国流行至今可以分为3阶段:2006-2008年主要是美洲型(VR-2332),全国各地区也在同一时期分离到的毒株序列比较杂乱;2009-2010年HP-PRRSV仍然以美洲型为主,致病性与VR-2332一致,传染性都很强;2011年以后仍以高致病性猪繁殖与呼吸障碍综合征病毒为主,同时有美洲型、高致病性、欧洲型3种毒株存在[15-16]。猪扁桃体是机体重要的免疫器官,具有抗细菌、抗病毒的防御功能,也是多种病原微生物侵袭、定居、复制的重要场所,采集猪扁桃体样品,用于监测、诊断常见疫病,具有很强的代表性,但目前研究报道较多是采集病死猪的扁桃体或组织病料进行监测,对规模猪场临床健康猪大量进行活体采集扁桃体,再进行监测分析的报道较少。【本研究切入点】采集猪活体扁桃体进行检测,能较全面及客观的反映规模猪场养殖环节中病毒感染、潜伏、流行情况,并可根据监测需求,多次进行重复采样监测,极大提高检测的时效性与准确性,为临床生产上制定科学、合理的疾病防控方案提供可靠数据分析。【拟解决的关键问题】对广西贵港地区2017年PRRS的感染情况进行调查与分析,以期为今后PRRS的深入研究及有效防控提供科学依据,为广西地区PRRS的临床诊断及疫苗的选择提供参考。
1 材料与方法
1.1 样品来源及阳性对照
样品来自广西贵港地区111个规模猪场的1865份扁桃体;阳性对照为高致病性猪繁殖与呼吸综合征活疫苗(HuN4-F112株)和猪繁殖与呼吸综合征活疫苗(CH-1R株),均购自黑龙江省哈尔滨兽医研究所。
1.2 主要试剂
RNAprep pure Tissue Kit RNAprep pure核酸抽提试剂盒购自TianGen公司、One Step RT-PCR Kit Ver.2购自TaKaRa公司,6xLoading Buffer购自TaKaRa公司,DL2000 DNA Marker购自TaKaRa公司,Ager Powder购自Solarbio公司,Gelred购自BIOTIUM公司,用Premier5、Oligo6等分子生物学分析软件设计引物,引物均由TaKaRa公司合成。
1.3 样品的制备
将采集的扁桃体放入无菌的离心管管中,加入高压过的钢珠和1 mL的灭菌生理盐水,用研磨仪在27.0 Hz的频率下研磨3 min,研磨后的样品反复冻融3次后,10 000 r/min于冷冻离心机离心5 min,取上清于-40 ℃或-80 ℃冰箱保存备用。
1.4 RNA的抽提
根据TianGen公司的RNA抽提试剂盒说明书进行RNA的抽提,同时设置高致病性猪繁殖与呼吸障碍综合征病毒与经典猪繁殖与呼吸障碍综合征病毒的阳性对照,以及阴性对照。抽提RNA -20 ℃保存备用。
1.5 引物的合成
参考VR-2332 ( GenBank No. AY-150564) 、CH-1a ( GenBank No. AY032626) 、JXA1( GenBank No. EF112445)设计并合成了一对引物P1/P2, 所设计引物位于紧靠缺失90个核苷酸区域两端的保守区。高致病性PRRSV株和经典PRRSV 株的预期扩增产物长度分别约426和516 bp。上游引物P1:5′-GGC GACAATGTCCCT AAC-3′; 下游引物P2:5′-GATGGCTTGAGCTGAGTAT-3′。引物由TaKaRa公司合成。
1.6 反转录-聚合酶链式反应(RT-PCR)
RT-PCR的反应体系以25 μl体系反应进行:体系内试剂成分及试剂剂量分别为:PrimeScript 1 step Enzyme Mix 1 μl、2×1 step Buffer 10 μl、RNase Free dH2O 8 μl、P1 0.5 μl、P2 0.5 μl、待检RNA产物 5 μl。
反应程序。第1步:反转录,42 ℃ 45 min,94 ℃ 5 min;第2步:PCR程序为94 ℃ 40 s、56 ℃ 40 s、72 ℃ 40 s,共进行34个循环;第3步:72 ℃延伸10 min。
1.7 RT-PCR产物的鉴定
在1 %的琼脂糖凝胶上用90 V电压电泳30 min,紫外灯下观察结果,拍照并保存。
2 结果与分析
2.1 HP-PRRSV与classic PRRSV基因的扩增结果
应用一步法RT-PCR检测方法,对1875份扁桃体样品进行PRRSV核酸检测,若目的条带出现在426 bp左右且与高致病性猪繁殖与呼吸障碍综合征病毒阳性对照条带一致,判定为高致病性猪繁殖与呼吸障碍综合征病毒阳性;若目的条带出现在516 bp左右且与经典猪繁殖与呼吸障碍综合征病毒阳性对照条带一致,则判定为经典猪繁殖与呼吸障碍综合征病毒阳性;其余判定为阴性,其中扩增的4份阳性样品电泳图见图1。

M:DL 2000 DNA marker; 1:HP-PRRSV 阳性对照; 2:经典PRRSV 阳性对照;3:阴性对照;4:HP-PRRSV阳性样品;5、7、8: 经典PRRSV阳性样品;6、9:阴性样品图1 HP-PRRSV与classic PRRSV基因扩增电泳结果Fig.1 The electrophoresis results of HP-PRRSV and classic PRRSV gene amplification
2.2 规模猪场检测结果
从表1可见,在广西贵港地区111个规模猪场的1865份扁桃体样品中,25个猪场检出92份猪繁殖与呼吸障碍综合征病毒,其中9个猪场检测出24份高致病性猪繁殖与呼吸障碍综合征病毒,样品阳性率为1.29 %;18个猪场检测出68份经典猪繁殖与呼吸障碍综合征病毒,样品阳性率为3.65 %;2个猪场同时检测出高致病性猪繁殖与呼吸障碍综合征病毒和经典猪繁殖与呼吸障碍综合征病毒。在25个阳性猪场中,感染高致病性猪繁殖与呼吸障碍综合征病毒最高的猪场阳性率为45.00 %;感染经典猪繁殖与呼吸障碍综合征病毒最高的猪场阳性率为75 %。

表1 检测阳性猪场RT-PCR检测结果Table 1 Results of RT-PCR test in positive pig farm
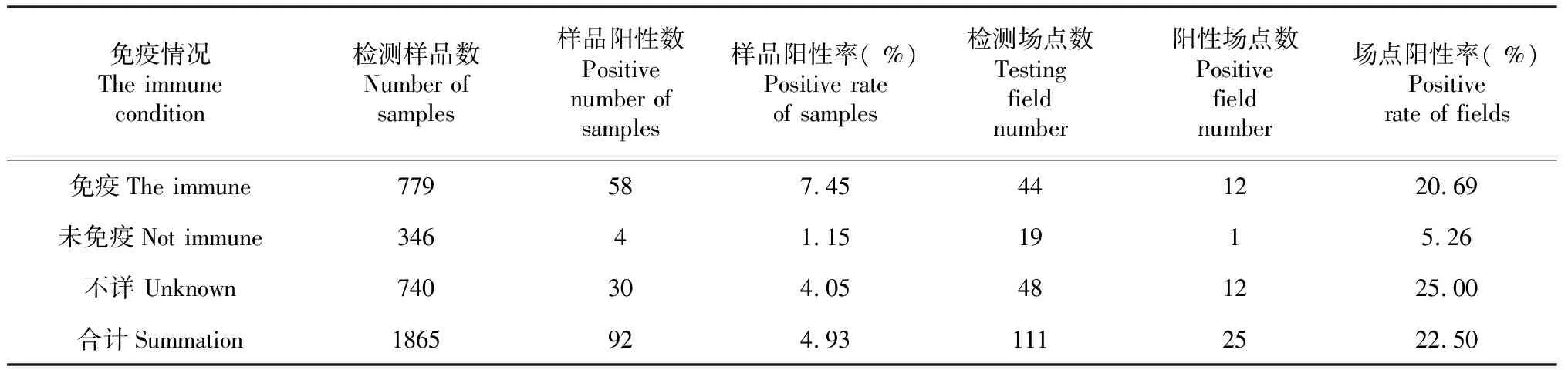
表2 不同免疫状况PRRS核酸检测结果Table 2 Results of PRRS nucleic acid detection in different immune conditions

表3 不同地区PRRS核酸检测表Table 3 PRRSV nucleic acid detection table in different regions
2.3 不同免疫状况下PRRS核酸检测结果
对采样猪群的免疫背景进行调查分析发现,免疫、未免疫、免疫不详猪群的PRRSV阳性率分别为7.45 %、1.15 %、4.05 %,场点阳性率分别为20.69 %、5.26 %、25.00 %(表2)。其中,免疫后的猪场样品阳性率与场点阳性率均显著(P<0.05,下同),高于未免疫的猪场。
2.4 不同区域PRRSV核酸检测结果
对不同采样地区进行分析发现,贵港市周边区域、桂平县、平南县的阳性份数分别是61、28、3份,阳性率分别是5.04 %、6.29 %、1.42 %(表3)。可见桂平市PRRSV的阳性率最高,贵港市PRRSV的阳性率次之,平南县PRRSV的阳性率最低,说明三大区域均不同程度受到PRRSV的感染,其中以桂平及贵港周边区域较为严重,应因地制宜,做出针对性的防控对策。
3 讨 论
本研究结果表明,在111个猪场中有2个猪场同时检测出高致病性猪繁殖与呼吸障碍综合征病毒和经典猪繁殖与呼吸障碍综合征病毒,说明该地区猪场中存在有高致病性猪繁殖与呼吸障碍综合征病毒和经典猪繁殖与呼吸障碍综合征病毒的混合感染。有关研究表明,感染猪群在受外界环境、气候等因素的影响时,可导致猪群的应激抗力或免疫力下降,使病毒毒力增强,同时在受强毒、野毒和其它病原微生物的攻击,即可出现从单一病原体所致的多重感染或混合感染,因而生产上常见呼吸道并发病、继发感染和混合感染的病例显著上升[17-19]。疫苗使用不当导致的疫苗毒反强以及野毒感染也可直接引起混合感染情况的发生[20-22]。
另外有9个猪场检测出24份高致病性猪繁殖与呼吸障碍综合征病毒,场点阳性率为8.10 %,样品阳性率为1.29 %,18个猪场检测出68份经典猪繁殖与呼吸障碍综合征病毒,场点阳性率为16.2 %,样品阳性率为3.65 %,感染经典猪繁殖与呼吸障碍综合征病毒猪场的比例比感染高致病猪繁殖与呼吸障碍综合征病毒的比例高出很多,说明贵港地区以经典猪繁殖与呼吸障碍综合征病毒的流行为主要趋势。分析此结果原因有2点:①高致病性猪繁殖与呼吸障碍综合征病毒对温度较敏感,在外界环境的生存能力较弱,一般在37 ℃环境下3到24小时,或56 ℃环境下6 ~20 min病毒即可丧失活性;在4 ℃时,1周内活性下降90 %;对pH敏感,当pH值小于6或大于7.5时,其感染性很快丧失;当pH 6.5~7.5时病毒稳定[23]。所以贵港地区在HP-PRRS流行很少的大环境下这种趋势在接下来可能仍会持续下去。②经典型猪繁殖与呼吸障碍综合征一旦感染后猪群是长期带毒或终生带毒,致死率较低,带毒猪可长期作为传染源存在,并且其生活的环境,猪舍、猪粪及污染的水源也都可以作为感染源,很容易将病毒通过这些渠道感染给其他易感猪群。贵港地区虽然仍以经典猪繁殖与呼吸障碍综合征流行为主要趋势,但仍然要对高致病性猪繁殖与呼吸障碍综合征保持高度警惕。
本研究中PRRSV的样品阳性率相对较低,仅为4.93 %。这主要与检测的样品类型有关,本研究的样品均为活体采集自正常猪的扁桃体,而上述研究检测的样品多数为发病猪的组织样品。发病猪在确诊发病后进行检测,不能够实现对猪繁殖与呼吸障碍综合征疫情的动态监测与猪场实时发病情况,不能对接下来的疫情进行合理的预测,不能对带毒猪或处于潜伏期未发病猪的检测,有一定的局限性。活体采集生猪扁桃体进行检测比较合理。因PRRSV感染猪群后首先在呼吸系统的鼻粘膜或上呼吸道大量的蓄积复制,之后进入血液后通过血液循环扩散至全身,并在单核巨噬细胞系统内增殖,扁桃体作为猪主要的免疫器官,在感染PRRSV后病毒会在扁桃体内大量的复制,采集生猪扁桃体能够对所有带毒猪进行检测,并不局限于发病猪,所以可以根据检测结果了解猪繁殖与呼吸障碍综合征在猪场内的感染情况、潜伏情况、以及对整个地区的流行情况进行分析,对接下来的疫情发展做出合理预测并及时采取措施。活体采集后第一时间检测也大大提高了检测的准确性。
通过对贵港地区的贵港市周边地区、桂平市、平南县的阳性情况统计发现,桂平市的阳性率最高,达到了6.29 %,贵港市周边地区阳性率次之为5.04 %,这两个地区都显著高于平南县1.42 %的阳性率,提示桂平市及贵港周边地区生猪养殖环节应做好严格的引种控制,以及人员和运输工具出入控制,并加强生物安全管理及卫生防疫工作。
在对2017年贵港地区猪繁殖与呼吸障碍综合征的调查中发现免疫猪群阳性率为7.45 %,显著高于未免疫组群的1.15 %,分析原因可能是目前对PRRS的防控仍以免疫接种为主,在免疫过程中疫苗的选择不够科学,不能良好的控制疫情的发生,灭活苗与弱毒苗在使用后可能引起的反强也会导致猪的感染,而且免疫接种不能彻底解决PRRSV的持续感染和带毒问题,所以注射疫苗后原有感染猪仍然可以检测出阳性,并持续作为传染源,这也可能是导致本研究中免疫猪群的PRRSV阳性率比非免疫猪群高的一个原因,另一方面可能是由于PRRS活疫苗的普遍、频繁、不合理使用,导致该病越变复杂,成为猪场的“常在性”疫病。PRRSV在流行的过程中较容易发生变异,特别是HP-PRRSV的变异速度更快,对于猪繁殖与呼吸障碍综合征疫情相对于稳定的猪场,不推荐使用高致病性猪繁殖与呼吸障碍综合征弱毒苗。对PRRS的防控仍然以科学的猪场管理和适合的免疫机制为主,疫苗的选择应结合当地及猪场的实际情况进行。
4 结 论
广西贵港地区猪群中PRRSV仍以经典株流行为主要趋势,免疫猪群PRRSV阳性率高于未免疫猪群,桂平市及贵港周边地区感染情况较平南县更为严重。
