‘川麦42’ב川农16’重组自交系的主要淀粉特性研究
2019-03-01代小梅邓光兵余懋群潘志芬
代小梅,李 俏,邓光兵,龙 海,余懋群,潘志芬*
(1.中国科学院成都生物研究所,四川 成都 610041;2.中国科学院大学,北京 100049)
【研究意义】小麦是人类饮食所需能量和蛋白质的重要来源[1],其品质的提高对于满足全球对高品质小麦制品的消费需求具有重要意义。淀粉是小麦籽粒的主要组分,占小麦籽粒干重的70 %左右[2],淀粉的糊化特性和膨胀势在很大程度影响着小麦的加工性能和产品的最终质量[3]。膨胀势与面条的食用品质高度相关[4-5],膨胀势高,面条质地、光滑度、弹性等较好[6],糊化峰值粘度与小麦面包体积、中国馒头色泽、面条食味等呈显著正相关[5,7-10],峰值时间、最低粘度、最终粘度、崩解值、回升值也与面条的品质显著相关[6,11-12]。α-淀粉酶(EC 3.2.1.1)是主要的淀粉水解酶之一,属于糖苷水解酶家族(glycoside hydrolase 13 family,GH13),可以催化降解淀粉[13-14],对淀粉糊化特性有显著影响[15-16]。α-淀粉酶的活性可被硝酸银抑制[16-17],加入硝酸银与不加硝酸银测定的糊化峰值粘度差值可以快速预测成熟种子中α-淀粉酶活性,峰值粘度差值越大,α-淀粉酶的活性越高[18]。【前人研究进展】‘川麦42’和‘川农16’是两个分别利用小麦族近缘属种优异基因资源选育出的穗数穗粒并重型及穗数型高产品种,是四川省的主要推广品种。四川省农科院作物所杨武云研究员通过单粒传法构建了‘川麦42’ב川农16’重组自交系群体。目前对该群体的主要淀粉特性还未进行研究。【本研究切入点及拟解决的关键问题】分析不同种植环境下‘川麦42’ב川农16’重组自交系群体的膨胀势、糊化特性及α-淀粉酶活性对糊化特性的影响,旨在有效利用该群体,为小麦品质改良和优质小麦的选育提供基础。
1 材料与方法
1.1 材料
供试材料为‘川麦42’与‘川农16’杂交构建的110个重组自交系(RILs)F8群体,于2015和2016年种植于中国科学院成都生物研究所双流和什邡试验基地。田间采用随机区组设计,3次重复,每小区4行,行长1 m,行距20 cm,每行10穴,来自3个区组的同一材料混收。
1.2 方法
1.2.1 膨胀势的测定 参照翟会生等[19]的测定方法,小麦全麦粉置于37 ℃烘箱中干燥过夜,称量干燥的1.5 mL离心管重量,记为G1。称取40 mg左右全麦粉于离心管中(每个样品重复3次),重量记为G,再向离心管中加入1 mL蒸馏水密封后将水和全麦粉震荡混匀,迅速于92.5 ℃水浴30 min并定时上下温和的颠倒混匀,第1分钟内上下颠倒混匀20次,第1.5、 2、 3、 4、 5、 7.5、 10、15、25分钟时颠倒混匀两次。水浴结束后将离心管置于20 ℃冷却3 min,开始冷却时先轻轻颠倒离心管2次,1.5 min时再轻轻颠倒离心管2次。冷却后于12 000 r/min离心10 min,弃去上清液,70 ℃烘干1 h后取出放于干燥器中,冷却后称量离心管重量记为G2。计算膨胀势:膨胀势=(G2-G1)/G。
1.2.2 糊化特性的测定定 糊化特性的测定仪器为德国Brabender公司的微型粘度糊化仪(Brabender Micro Visco-Amylo-Graph)。称取15 g全麦粉于测量杯中,加入100 mL蒸馏水或98 mL蒸馏水和2 mL 10 % AgNO3(m/v)溶液,搅拌均匀后进行测试。测试程序为:开始以7.5 ℃/min的升温速率升温,到92 ℃恒温5 min后以7.5 ℃/min的速度降温至50 ℃,保温1 min,转速为250 r/min。
1.2.3 α-淀粉酶活性的测定定 使用The CERALPHA 试剂盒测定α-淀粉酶活性。称取50 mg全麦粉,加入α-淀粉酶提取缓冲液(Extraction Buffer solution,pH 5.4)500 μl,剧烈震荡混匀,40 ℃水浴20 min,期间间歇混匀,水浴结束后于17 000 r/min离心10 min,取上清得到α-淀粉酶提取液。吸取15 μl反应底物(Amylase HR Reagent)于96孔板,加入15 μl α-淀粉酶提取液,混合充分后40 ℃水浴20 min,水浴结束后立即加入225 μl反应终止液(Stopping Reagent),于400 nm波长下读取待测液与空白对照液的吸光度值,二者之差即表示为样品中总α-淀粉酶活性。
1.3 分析方法
利用SPSS Statstics 17.0、Excel软件进行数据分析。
2 结果与分析
2.1 膨胀势的变异及分布
在两年三点的试验环境中RILs群体材料膨胀势都存在多样性,其变异系数分别为8.84 %、10.96 %、12.03 %。膨胀势在RILs群体中呈连续变异,存在超亲现象,分布呈正态分布(图1)。2015年什邡试点、2016年双流试点、2016年什邡试点的变幅分别为7.08~11.93、8.62~12.95、7.50~13.29,平均值分别为9.89、10.70、9.84(图2)。两年三点的膨胀势集中于9.00~11.00,此区段材料所占的比例为53.64 %~75.45 %。2015年什邡试点的膨胀势与2016年什邡试验点的膨胀势的差异不显著,而2016年双流和什邡两试验点的膨胀势具有显著差异。结果表明不同种植地点对膨胀势的影响大于年份间对膨胀势的影响,这可能与土壤特性差异有关。
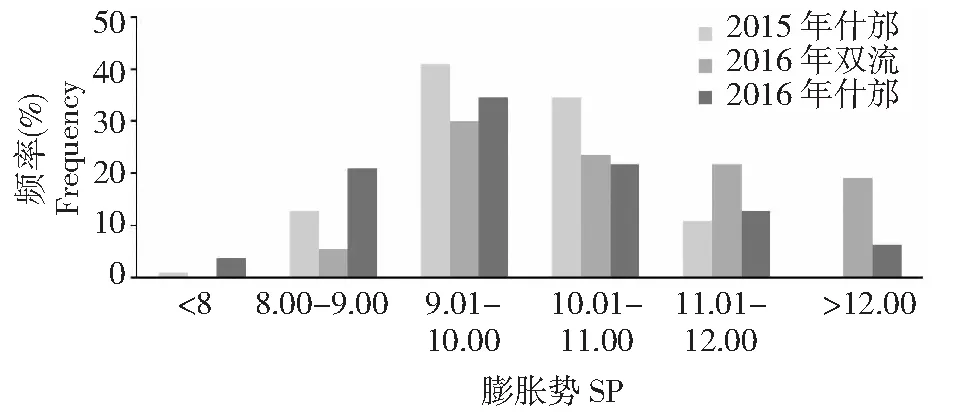
图1 RILs群体的膨胀势分布Fig.1 The frequency distribution of swelling power in the RILs of Chuanmai 42×Chuannong16
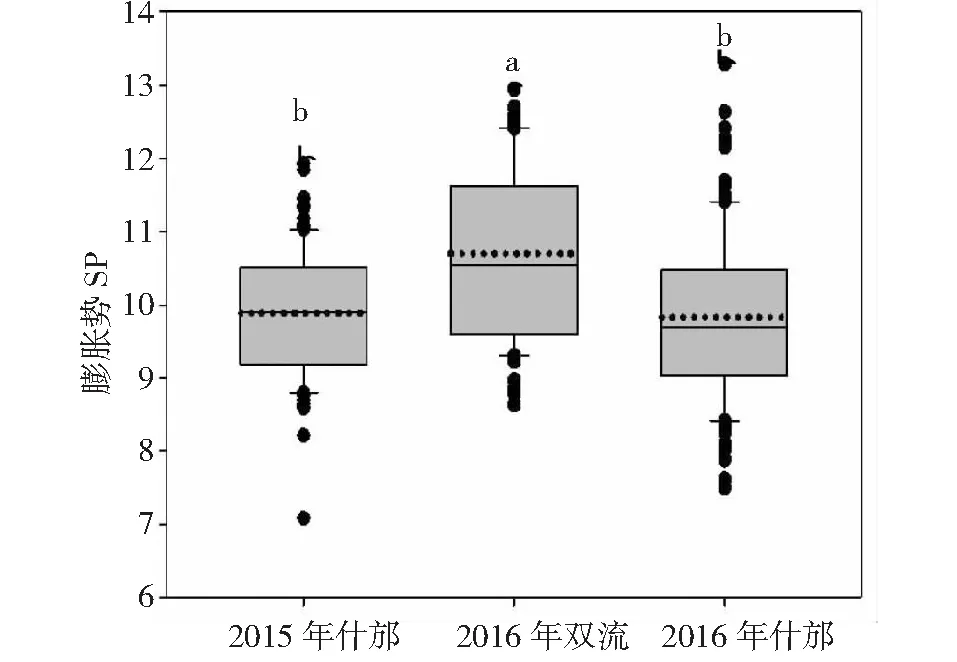
不同字母表示在0.05水平上差异显著Different letters indicate signifcant difference at 0.05 levels图2 不同环境RILs群体的膨胀势Fig.2 Swelling power of RILs of Chuanmai42×Chuannong16 in different environments
2.2 群体材料的糊化特性差异
表1显示,糊化参数变异系数为1.83 %~30.70 %,其中崩解值的变异系数最高。就3个不同环境而言,2015年双流试验点除峰值时间和峰值温度外,其余糊化参数的变异系数都高于另外2个试验环境。
RILs群体材料的各糊化参数在3个试验环境中呈连续变异,均存在超亲现象,分布趋势基本一致且大致呈正态分布(图3)。从糊化参数的分布来看,峰值时间、峰值温度、峰值粘度、最低粘度、最终粘度、崩解值、回升值分别集中于5.00~6.00 min、85.0~89.0 ℃、900~1100 BU、600~800 BU、1000~1200 BU、200~400 BU、400~500 BU。就同一地点不同年份的材料的糊化特性比较,双流试验点在2015年的峰值时间显著低于2016年,峰值温度显著高于2016年,而粘度参数差异不显著;同一年份不同地点的材料的糊化特性比较发现,2016年双流试验点峰值温度、峰值粘度、最低粘度显著高于什邡试验点,回升值显著低于什邡试验点,峰值时间、最终粘度和崩解值差异不显著(表1)。结果表明,年份间对粘度参数的影响小于不同试验点对粘度参数的影响。所以在优质小麦生产中,选择适宜的种植地区是非常重要的。
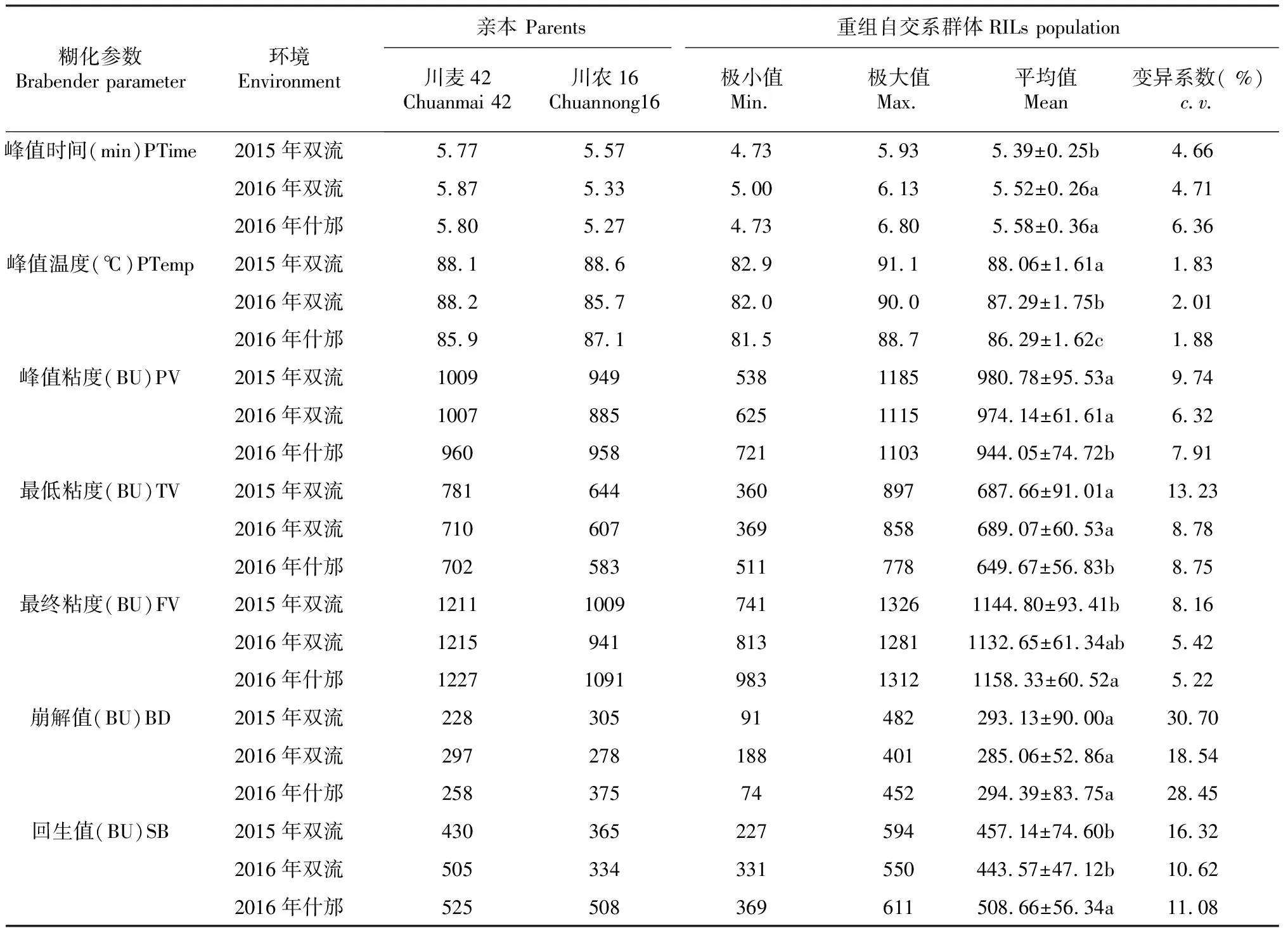
表1 RILs群体的糊化特性Table 1 The Brabender parameters in the RILs of Chuanmai42×Chuannong16
注:PTime:峰值时间;PTemp峰值温度;PV:峰值粘度;TV:最低粘度;FV:最终粘度;BD:崩解值;SB:回生值. 字母不同表示不同参数在不同环境的差异显著。下同。
Notes:PTime=peak time;PTemp=pasting temperature;PV=peak viscosity;TV=trough viscosity; FV=final viscosity;BD=breakdown value;SB=setback value. Different letters show signifcant difference atP<0.05 of Brabender Parameters in different enviroments. The same as below.
2.3 RILs群体材料的α-淀粉酶活性差异
双流、什邡两试验点不添加硝酸银时的峰值时间、峰值温度、峰值粘度、最低粘度、最终粘度、崩解值、回升值均显著低于添加硝酸银时所对应的糊化参数(图4),表明α-淀粉酶活性会显著降低淀粉各糊化参数。以添加硝酸银前后所测的峰值糊化粘度差值大小代表材料中α-淀粉酶活性大小差异。2016年双流、什邡两试验点的峰值粘度差值在RILs群体中呈连续变异,均存在超亲现象,分布趋势基本一致且呈正态分布(图5)。2016年双流、什邡试验点的峰值粘度差值变幅分别为119~820、164~878 BU,平均值分别为443、558 BU,RILs群体在什邡试验点的峰值粘度差值显著高于双流试验点,表明什邡试验点RILs群体的α-淀粉酶活性显著高于双流试验点。
3 讨 论
‘川麦42’ב川农16’重组自交系群体在不同环境下种植,表现出的膨胀势和糊化特性不同,但均出现连续变异,分布趋势基本一致且大致呈正态分布,说明膨胀势和糊化特性为多基因控制的数量性状,这与前人研究结果一致[20-23]。本研究通过对三个环境下RILs群体的膨胀势差异显著性分析发现不同种植试验点对膨胀势的影响大于年份间对膨胀势的影响,而Morris等人的研究发现年份间对膨胀势的影响大于不同种植试验点[24]。同样,本研究发现不同年份对RILs群体的糊化特性影响也小于不同种植试验点的影响。这可能与年份间的气候差异大小或土壤肥力差异大小有关,本研究所得结果可能由于年份间气候差异的影响小于不同种植试验点的土壤特性差异所致。
α-淀粉酶作为小麦粉中一种重要的内源酶,可以催化淀粉的降解,也会影响面粉的吸水率和粘度及面团的发酵特性,从而影响小麦制品的最终质量。已有研究报道,不同的小麦材料的成熟种子中α-淀粉酶的活性有很大差异,从而使不同小麦淀粉特性差异扩大[18]。本研究发现RILs群体中α-淀粉酶活性差异仍然很大,而且随种植环境不同而呈现不同的差异,什邡试验点的α-淀粉酶的活性显著高于双流试验点。因而,优质小麦选育中需要对α-淀粉酶活性进行评估。
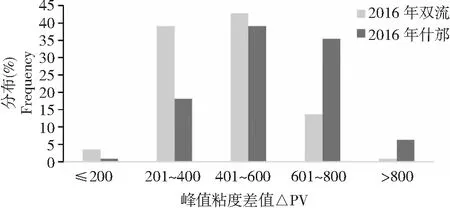
PV:峰值粘度差值PV :Difference between peak viscosities with and without AgNO3图5 RILs群体峰值粘度差值分布Fig.5 The frequency distribution of difference between peak viscosities with and without AgNO3 in the RILs of Chuanmai 42×Chuannong 16
4 结 论
‘川麦42’ב川农16’重组自交系群体的淀粉膨胀势、糊化特性及α-淀粉酶活性差异很大,为多基因控制的数量性状,受种植坏境影响很大,可根据育种需要选择具有适宜淀粉特性指标的材料加以利用。
