阿托伐他汀对KLF4过表达的RAW264.7细胞表型偏移的影响
2019-02-28李鑫马立芝向国安李琦姬文婕魏路清
李鑫,马立芝,向国安,李琦,姬文婕,魏路清
1.解放军总医院第三医学中心a.急诊科,b.呼吸科,北京100039;2.解放军总医院,北京100853;3.武警特色医学中心 呼吸与重症医学科,天津300162
Krüppel 样因子(Krüppel-like factors,KLFs)是包含锌指结构的核转录因子,在机体多项生命活动中具有重要的调节作用[1]。KLF4 是KLFs 家族众多成员之一,因其在消化道含量丰富又称为胃肠富集KLF[2](gut-enriched KLF,GKLF)。KLF4 能够与不同的靶基因结合而发挥不同的生物学作用,表现为转录激活或抑制。近年来的研究表明,KLF4 能够参与并调节机体的炎症反应[3]。巨噬细胞作为机体免疫防御系统的重要组成部分,参与先天性免疫和细胞免疫活动[4-5]。在不同的内环境下,巨噬细胞可分化为具有促炎性的M1型巨噬细胞或抗炎性的M2 型巨噬细胞,参与机体的免疫反应[6]。本课题组在前期研究中发现KLF4在博来霉素致肺纤维化过程中呈明显的动态变化,同时发现给予阿托伐他汀(atorvastatin,ATO)干预后KLF4的表达也随之发生改变[7-8]。为进一步探索ATO和KLF4的作用机制,本研究通过体外实验脂多糖(lipopolysaccharide,LPS)诱导巨噬细胞表型变化,探讨KLF4 对巨噬细胞表型的变化调节与ATO 干预的关系。
1 材料与方法
1.1 材料
野生型RAW264.7细胞(南开大学生命科学院韩际宏教授惠赠);KLF4 过表达RAW264.7细胞(Lenti-KLF4)、空载体对照的RAW264.7细胞(Lenti-pLVX)(实验室前期构建保存[9-10]);胎牛血清(Gibco 公司);DMEM 高糖培养基、胰蛋白酶(HyClone 公司);琼脂糖、阿托伐他汀(Sigma 公司);吗啉代丙烷磺酸(Ambion 公司);PCR 扩增试剂盒(大连TaKaRa 公司);TRIzol 试剂盒、Lipo⁃fectAMINE 3000 试 剂(Invitrogen 公 司);SYB⁃RGreen 实时定量PCR 试剂盒(Roche 公司);引物均由中美泰和生物有限公司合成。
1.2 细胞复苏及培养
取出野生型RAW264.7细胞、Lenti-KLF4细胞、Lenti-pLVX细胞,迅速复苏后置于含2 mL 12%高糖DMEM 培养基的六孔细胞培养板中,于37℃,5% CO2的细胞培养箱中继续培养。
1.3 LPS诱导RAW264.7细胞
分别取对数生长期的RAW264.7细胞接种于12 孔细胞培养板,每孔5×104细胞,1 mL 12%高糖DMEM 培养基,于培养箱中继续培养21 h,从每孔吸出500 μL 培养基于无菌EP 管中,在实验组EP 管中加入5 μL LPS 溶液(20 ng/μL),对照组EP 管中加入5 μL 高糖DMEM 培养基,混匀后加回到原细胞培养孔中,继续培养3 h。
1.4 ATO 干预RAW264.7细胞
分别取处于对数生长期的RAW264.7细胞接种于12 孔细胞培养板,每孔5×104细胞,1 mL 12%高糖DMEM 培养基,于培养箱中继续培养18 h,从每孔吸出500 μL 培养基于无菌EP 管中,在对照组EP 管中加入10 μL DMSO,实验组EP 管中加入10 μL ATO 溶液(10 μmol/mL),混匀后加回到原细胞培养孔中去,继续培养6 h。
1.5 ATO 干预后,LPS 作用于RAW264.7细胞
分别取处于对数生长期的RAW264.7细胞接种于12 孔细胞培养板,每孔5×104细胞,1 mL 12%高糖DMEM 培养基,于培养箱中继续培18 h,从每孔吸出500 μL 培养基于无菌EP 管中,在对照组及LPS 组EP 管中分别加入10 μL DMSO,LPS+ATO 组EP 管中加入10 μL ATO 溶液(10 μmol/mL),混匀后加回到原细胞培养孔中去,继续培养3 h,从每孔吸出500 μL 培养基于无菌EP管中,在对照组EP 管中加入5 μL 高糖DMEM 培养 基,LPS 组 及LPS+ATO 组EP 管 中 加入5 μL LPS 溶液(20 ng/μL),混匀后加回到原细胞培养孔中去,继续培养3 h。
1.6 RT-PCR 检 测KLF4 mRNA的表 达
每组3个样本,实验重复3 次。分别提取各组细胞的总RNA,反转录成cDNA,进行PCR 扩增,用2-ΔΔCt法分析扩增结果。引物序列见表1。
1.7 统计学方法
实验数据采用Stata 14.1 软件进行统计分析。符合正态分布的计量资料用x±s表示,2组间均数比较采用独立样本t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 LPS、ATO 分别作用于野生型RAW264.7细胞后KLF4的mRNA表 达
RT-PCR 结果见图1。 LPS诱导野生型RAW264.7细胞3 h后,KLF4基因的mRNA 相对表达量与对照组相比降低约70%(0.24±0.06 vs 1.00±0.00,P<0.05)。ATO 干预野生型RAW264.7细胞6 h后,KLF4基因的mRNA 相对表达量与对照组相比升高约3倍(3.72±0.71 vs 1.00±0.00,P<0.05)。
2.2 LPS诱导野生型RAW264.7细胞后,巨噬细胞表型相关基因的mRNA表达
RT-PCR 结果见图2。 LPS诱导野生型RAW264.7细胞3 h后,与较野生型对照组相比,IL-10、Arg-1基因的mRNA表达量分别低于对照组约84%(0.16±0.02 vs 1.00±0.00)、74%(0.26±0.04 vs 1.00±0.00)(P<0.05),NF- κB基因的mRNA 相对表达量较对照组升高约1.5倍(1.51±0.21 vs 1.00±0.00,P<0.05)。
2.3 ATO 干预后,LPS诱导的RAW264.7细胞表型相关基因的mRNA表达
RT-PCR 结果见图3。ATO 干预后LPS诱导的RAW264.7细胞,ATO+LPS 组与LPS 组(对照组)相比IL-10、Arg-1基因的mRNA 相对表达量分别高于对照组约1.6倍(1.70±0.16 vs 1.00±0.00)、1.8倍(1.83±0.08 vs 1.00±0.00,P<0.05),NF-κB基因的mRNA表达量较对照组降低了约42%(0.58±0.05 vs 1.00±0.00,P<0.05)。
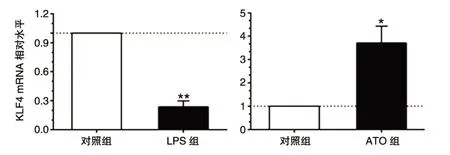
图1 KLF4的mRNA 相对表达

图2 LPS诱导RAW264.7细胞后IL-10、Arg-1、NF-κB基因mRNA的相对表达
2.4 LPS诱导Lenti-KLF4细胞后,巨噬细胞表型相关基因的mRNA表达
RT-PCR 结果见图4。LPS诱导KLF4 过表达的RAW264.7细胞后,LPS 组 中,Lenti-KLF4与Lenti-pLVX 相比IL-10、Arg-1、基因的mRNA 相对表达量分别升高约3倍(1.64±0.09 vs 0.56±0.06,P<0.01)、16倍(4.30±0.29 vs 0.27±0.11,P<0.01),NF-κB基因的相对表达量降低约60%(1.49±0.30 vs 3.79±0.63,P<0.05)。在对照组中,Lenti-KLF4与Lenti-pLVX 相比IL-10、Arg-1基因的mRNA 相对表达量分别升高约3.3倍(3.32±0.94 vs 1.00±0.00,P<0.01)、10.5倍(10.55±2.71 vs 1.00±0.00,P<0.01),NF-κB基因的相对表达量降低约62%(0.38±0.07 vs 1.00±0.00,P>0.05)。
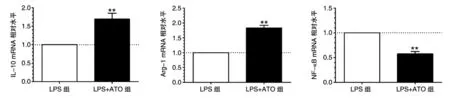
图3 ATO 干预后,LPS诱导的RAW264.7细胞IL-10、Arg-1、NF-κB基因mRNA的相对表达
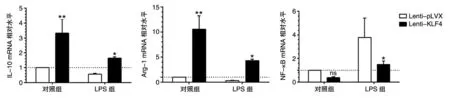
图4 LPS诱导KLF4 过表达的RAW264.7细胞IL-10、Arg-1、NF-κB基因mRNA的相对表达
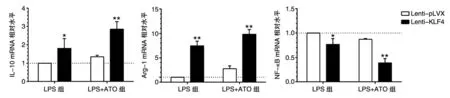
图5 ATO 干预后,LPS诱导的Lenti-KLF4细胞IL-10、Arg-1、NF-κB基因mRNA的相对表达
2.5 ATO干预后LPS诱导Lenti-KLF4细胞,巨 噬细胞表型相关基因的mRNA表达
RT-PCR 结果见图5。ATO+LPS 组中,Lenti-KLF4与Lenti-pLVX相比IL-10、Arg-1基因的mRNA 相对表达量分别升高约2倍(2.85±0.41 vs 1.34±0.08,P<0.01)、3.6倍(9.84±0.96 vs 2.75±0.57,P<0.01),NF-κB基因的相对表达量降低约55%(0.39±0.09 vs 0.87±0.02,P<0.01)。LPS 组中,Lenti-KLF4与Lenti-pLVX 相比IL-10、Arg-1基因的mRNA 相对表达量分别升高约1.8倍(1.81±0.52 vs 1.00±0.00,P<0.05)、7.5倍(7.48±0.95 vs 1.00±0.00,P<0.05),NF-κB基因的相对表达量降低约23%(0.77±0.12 vs 1.00±0.00,P<0.05)。
3 讨论
单核细胞、巨噬细胞、树突状细胞共同构成机体的重要防线。巨噬细胞由单核细胞分化而来,其在机体器官内可进一步分化为经典活化的M1表型(主要功能为识别、提呈、促炎)和选择性活化的M2表型(主要功能为抑炎、修复)[11-12],在不同免疫反应和疾病环境下,功能相异甚至相互抑制来发挥不同的调控作用。在骨关节炎疾病中,M1和M2 型巨噬细胞参与炎症反应的发生发展[13]。在非酒精性脂肪肝肝炎疾病中,调节M1 型巨噬细胞的极化可能是潜在的治疗靶点[14]。在变态反应性疾病中,Egawa[15]等发现炎症细胞聚集并通过嗜碱性粒细胞分泌白介素4 调节巨噬细胞向M2 型偏移发挥抗炎作用,从而减轻变态反应。同时,巨噬细胞极化对过敏性哮喘的发病具有深远影响[16]。在博莱霉素致小鼠肺纤维化中,肺内巨噬细胞明显由M1表型向M2表型偏移且随疾病的发生发展呈动态变化[17]。在小鼠矽肺模型中,同样发现巨噬细胞明显由M1表型向M2表型偏移且随疾病的发生发展呈动态变化的现象[18]。
KLF4 作为一种重要的信号蛋白分子,对巨噬细胞的分化成熟具有调控作用,并成为其分化为M1 型和M2 型的标志物[19-20]。KLF4 能够抑制巨噬细胞向M1表型极化,促进巨噬细胞向M2表型极化[20]。有研究发现,KLF4 能够调控巨噬细胞极化而作为治疗动脉粥样硬化疾病的一个靶点[21-23]。他汀类药物在临床上广泛应用于调节机体脂类代谢,近年来有研究发现他汀类药物还具有免疫调节、抑制心肌肥厚、改善内皮功能等作用[24-26]。阿托伐他汀作为常用的他汀类药物之一,在肺纤维化疾病领域有着广泛的研究和应用,其也被证实可缓解肺纤维化的进展程度[27-28]。
本研究主要通过LPS诱导RAW264.7细胞,构建体外损伤模型,以探讨巨噬细胞表型偏移与他汀类药物及KLF4的关系。我们的研究结果显示,LPS 会抑制RAW264.7细胞内KLF4的表达,同时阿托伐他汀会促进RAW264.7细胞内KLF4的表达。有研究证实,在LPS诱导的RAW264.7 巨噬细胞中,阿托伐他汀可以有效抑制TNF-α和iNOS的mRNA表达[29]。本研究中LPS 作用于RAW264.7细胞后,可以抑制巨噬细胞由M1 型向M2 型偏移,与文献报道一致[30-31]。本研究发现阿托伐他汀干预后,LPS 作用于KLF4 过表达的RAW264.7细胞表型偏移发生部分逆转。结合前期发现通过抑制部分博莱霉素诱导的小鼠巨噬细胞表型偏移而改善肺纤维化情况[32]及肺纤维化模型中KLF4 含量的动态变化[8],阿托伐他汀可能通过KLF4 途径来调节巨噬细胞表型偏移,进而在肺损伤及肺纤维化病理进程中发挥作用。本研究仅通过慢病毒介导KLF4 过表达来探讨其对巨噬细胞的表型调控,存在不足之处,还应通过对KLF4敲低以更进一步探讨其对巨噬细胞表型的调控。在机体稳态及损伤、炎症等不同状态下,巨噬细胞的功能异质性不容忽视,了解阿托伐他汀的可能干预机制,可为我们进一步探索临床治疗肺纤维化等疾病奠定实验和理论基础。
