降钙素基因相关肽受体单克隆抗体的制备与初步鉴定
2019-02-28王佳星许永亮付楚溪张丹雨薛冲张惟材王升厚熊向华
王佳星,许永亮,付楚溪,张丹雨,薛冲,张惟材,王升厚,熊向华
1.沈阳师范大学 生命科学学院,辽宁 沈阳110034;2.军事科学院 军事医学研究院 生物工程研究所,北京100071;3.辽宁大学 生命科学学院,辽宁 沈阳110036
偏头痛是临床常见的慢性神经血管性疾病,于儿童和青春期开始发病,发病高峰期在25~50岁,患病率为5%~10%,且女性常高于男性[1]。多项研究证实,当偏头痛发作时体内降钙素基因相关肽(calcitonin gene-related peptide,CGRP)水平明显增高,且头痛强度与CGRP 水平呈正相关[2]。CGRP 通过与位于细胞膜上的CGRP 受体(CGRP receptor,CGRPR)结合激活环磷酸腺苷信号通路,因此,阻断CGRP与CGRPR的结合从而抑制CGRP 信号传导是治疗偏头痛的关键。目前CGRPR 被认为是偏头痛治疗和预防最具潜力的靶点,靶向结合CGRPR 阻断其与CGRP 结合的单克隆抗体可作为缓解偏头痛的候选药物[3-5]。
CGRPR 是G 蛋白偶联受体家族B 类成员,该家族是体内最大的膜蛋白受体家族,参与多种生理功能的调节,并且与很多疾病紧密相关,目前市场上近50%的药物都以G 蛋白偶联受体家族为作用靶点[6]。CGRPR 由1个N端胞外域、7 次跨膜结构域和1个C端胞内域组成,并与1个跨膜蛋白受体活性修饰蛋白(receptor activity modifying protein 1,RAMP1)和1个胞内蛋白(receptor com⁃ponent protein,RCP)组成功能性受体[7]。CGRP与CGRPR的N端胞外域结合后将信号传递至细胞内,因而本研究截取人源CGRPR的N端胞外域23~146 氨基酸残基区域作为筛选靶点,利用原核系统表达,经包涵体复性、纯化得到的CGRPR 胞外区蛋白作为抗原,通过杂交瘤技术筛选特异性结合CGRPR的单克隆抗体并进行分析测定。
1 材料与方法
1.1 材料
SPF 级BALB/c 雌鼠(北京维通利华实验动物技术有限公司);Sp2/0 骨髓瘤细胞、pGEX-4T 质粒(本实验室保存);大肠杆菌感受态细胞DH5α、BL21(DE3)(北京天根生化科技有限公司);pMD-18T 载体[宝生物工程(大连)有限公司];CGRPR(安徽通用有限公司合成);弗氏完全佐剂、弗氏不完全佐剂(Sigma 公司);单抗亚类鉴定试剂盒(北京博奥龙免疫技术公司);GSTrap FF 亲和层析柱、Protein-G 亲和层析柱(GE 公司);DMEM(Kccell 公司);HAT、胎牛血清(Gibco 公司);Ultra⁃pure RNA Kit、HiFiScript gDNA Removal cDNA Synthesis Kit(北京康为世纪生物科技有限公司);限制性内切酶EcoRⅠ、XhoⅠ,标记HRP 羊抗鼠二抗(Thermo 公司);96 孔板(NEST 公司);PVDF 膜(Millipore 公司);SDS-PAGE 样品缓冲液[生工生物工程(上海)股份有限公司]。
1.2 重组质粒构建
参照NCBI 数据库的人源CGRPR 序列(NP_005786)进行全基因合成,设计上游引物(5'-GG AATTCgaattagaagagagtcctgaggactcaatt-3',下 划 线 序列为EcoRⅠ酶切位点)、下游引物(5'-GGCTCGA Gtatggtcaggtaaaacaaatttagtgcagtcttc-3',下 划 线 序 列为XhoⅠ酶切位点),PCR 扩增CGRPR 胞外区片段(N端胞外域23~146 位氨基酸残基),经1%琼脂糖凝胶电泳分离后切胶回收,回收片段与pGEX-4T 载体分别用EcoRⅠ、XhoⅠ双酶切,酶切产物经电泳回收后,用T4DNA 连接酶连接过夜,连接产物转化大肠杆菌DH5α感受态,次日挑取单克隆接种至LB(含氨苄青霉素)培养基中,200 r/min、37℃培养,菌液PCR 鉴定的阳性克隆送测序。
1.3 蛋白表达及纯化
将构建的pGEX-4T-CGRPR 胞外区重组质粒转化大肠杆菌BL21(DE3)感受态细胞,次日挑取单克隆进行活化,当活化菌液D600nm值约0.5 时加入IPTG 至终浓度为0.5 mmol/L,于200 r/min、16℃条件下诱导表达过夜;菌液于4℃、12 000 r/min 离心10 min,弃上清,菌体沉淀用缓冲液(10 mmol/L Tris-HCl,1 mmol/L EDTA)重悬后超声波破碎,离心得到包涵体沉淀;将包涵体沉淀用洗涤液(2 mol/L 尿素,50 mmol/L Tris-HCl,1 mmol/L EDTA,1% Tween)清洗3 次,再用溶解液(8 mol/L 尿 素,20 mmol/L Tris-HCl,150 mmol/L NaCl,1 mol/L DTT)溶解;离心去杂质,上清逐步于4、2、0.8 mol/L 尿素复性液以及PBS 溶液中梯度复性;用GSTrap FF 亲和层析柱纯化复性蛋白,采用洗脱液(10 mmol/L 磷酸钠缓冲液,150 mmol/L NaCl,10 mmol/L 还原性谷胱甘肽)进行洗脱,收集洗脱峰进行SDS-PAGE 分析。
1.4 动物免疫
选择5只健康的SPF 级6~8周龄BALB/c 雌性小鼠,取纯化抗原GST-CGRPR 胞外区融合蛋白与等量弗氏完全佐剂充分混合后,100 μg/只皮下多点注射于小鼠背部进行基础免疫;每间隔2周取抗原与等量弗氏不完全佐剂混合,50 μg/只背部皮下免疫,共加强免疫3 次;最后一次加强免疫完成2周后,取小鼠尾静脉血测定效价,选择效价最高的小鼠腹腔注射抗原100 μg 进行冲击免疫。
1.5 杂交瘤细胞株建立
冲击免疫后3 d,无菌环境下取免疫小鼠脾脏制成细胞悬液并与Sp2/0 按5∶1 混合,PEG 法进行细胞融合[8],HAT 选择培养基培养细胞,7 d后替换为HT 培养基。待细胞克隆生长至培养孔面积1/3~1/2 时,采用间接ELISA 法筛选阳性细胞株。阳性杂交瘤细胞通过有限稀释法进行连续克隆化,至少3 次,直至阳性率达到100%,即获得能稳定分泌特异性抗体的单克隆细胞株。
1.6 腹水制备及纯化
选择健康的SPF 级8~10周龄BALB/c 雌性小鼠,腹腔注射0.5 mL 弗氏不完全佐剂进行预免疫,7 d后将生长状态良好的阳性细胞株(约1×106/只)接种于小鼠腹腔制备腹水,并以相同方法将Sp2/0细胞接种于小鼠腹腔获得腹水作为阴性对照;7~10 d 小鼠腹部出现明显隆起、精神萎靡、食欲不振、活动受限等状态时收集腹水[9],4℃、5000 r/min 离心15 min后弃上层油脂与下层沉淀,收集中间层上清置-20℃保存;取得的腹水用Protein G 柱进行亲和层析,经0.1 mol/L(pH2.7)的甘氨酸缓冲液洗脱,收集洗脱峰,用1 mol/L(pH9.0)的Tris-HCl 溶液调节洗脱液pH值至7.0,进行还原型SDS-PAGE 分析。
1.7 抗体亚类鉴定及效价测定
用抗体亚类鉴定试剂盒对筛选到的阳性细胞培养上清进行亚型鉴定,间接ELISA 法测定阳性细胞培养上清及腹水效价。
1.8 抗体可变区基因调取
将阳性细胞株培养至增殖期,轻轻吹起细胞并计数,将细胞悬液于800 r/min 离心5 min,弃上清,用细胞总RNA 提取试剂盒提取总RNA,1%琼脂糖电泳检测RNA的完整性,Nano 核酸定量仪测定RNA 浓度;用HiFiScript gDNA Removal cDNA Synthesis 试剂盒,以提取的总RNA 为模版逆转录为cDNA,并以之为模板,利用轻、重链可变区通用引物进行PCR 扩增;1%琼脂糖凝胶电泳后回收轻、重链可变区基因片段,连入pMD-18T 载体,转化大肠杆菌DH5α感受态,挑白斑培养后进行菌液PCR 鉴定,阳性克隆送测序,通过IgBLAST 数据库对轻、重链可变区序列进行比对和分析。
1.9 抗体特异性鉴定
将纯化的GST-CGRPR 融合蛋白、GST-PD1 融合蛋白和GST 标签蛋白进行12.5% SDS-PAGE,半干法电转至PVDF 膜上;用5%脱脂奶粉37℃封闭2 h,PBST 洗膜5 次;加入腹水制备的单抗室温孵育1 h,PBST 洗膜5 次;HRP 标记的羊抗鼠IgG为二抗室温孵育1 h,PBST 洗膜后,立即进行利用Western 印迹显影分析。
1.10 抗体亲和力测定
采用非竞争ELISA 法测定2株抗体的亲和力常数[10]。根据预实验结果,分别设定1F9、1F10 抗体对应抗原起始浓度为32、10 μg/mL,1/2 梯度稀释成5 组浓度,100 μL/孔加入酶标板中,4℃包被过夜;次日PBST 洗涤5 次,5%脱脂奶粉37℃封闭2 h;PBST 洗涤5 次,分别加入一抗1F9、1F10,起始浓度均为1000 μg/mL,1/2 梯度稀释为20个浓度梯度,100 μL/孔依次加入对应孔内,37℃孵育1 h,PBST 洗涤5 次;HRP 标记的羊抗鼠IgG 作为二抗37℃孵育1 h,PBST 洗涤5 次;100 μL/孔加入TMB 显色液进行显色,37℃反应10 min;50 μL/孔加入2 mol/L H2SO4终止反应,测定D450nm值。
2 结果
2.1 重组表达载体构建
将pGEX-4T和CGRPR 胞外区的连接产物转化大肠杆菌DH5α感受态细胞,次日挑取单克隆培养后进行菌液PCR 鉴定。1%琼脂糖凝胶电泳检测结果显示,PCR 产物大小为372 bp,与理论值相符(图1);阳性克隆测序结果经DNAMAN 软件分析显示与目的基因序列一致,表明pGEX-4T-CGRPR 胞外区重组表达载体构建成功。
2.2 目的蛋白纯化
GST-CGRPR 胞外区融合蛋白以包涵体形式表达,包涵体经4、2、0.8 mol/L 尿素及PBS 梯度复性后用GSTrap FF 柱亲和层析,洗脱组分进行SDS-PAGE 分析,结果表明在相对分子质量约42×103处可见特异性蛋白条带,与目的蛋白理论大小相符(图2),Gelpro32 软件分析目的蛋白纯度为92.3%,满足动物免疫蛋白纯度要求(>90%)。
2.3 单克隆抗体筛选
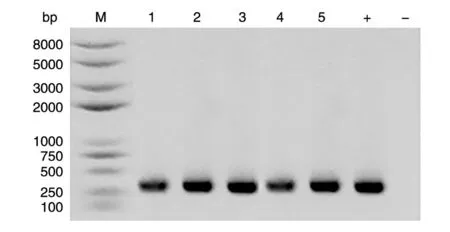
图1 pGEX-4T-CGRPR 胞外区重组质粒菌落PCR 鉴定
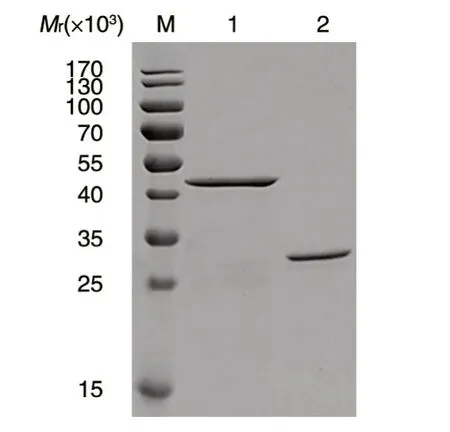
图2 GST-CGRPR 胞外区蛋白的SDS-PAGE 鉴定
以GST-CGRPR 胞外区融合蛋白为抗原免疫雌性BALB/c 小鼠,4 次免疫后2周取小鼠尾静脉血测定效价,结果显示5只小鼠尾血效价均大于1∶6400。选择尾血效价最高的2 号鼠(效价为1∶25 600)进行冲击免疫,3 d后取其脾脏制成细胞悬液与骨髓瘤细胞融合,筛选到的阳性细胞经有限稀释法进行3 次克隆化,最后得到2株能稳定分泌抗体的阳性细胞株1F9和1F10。
2.4 抗体亚型分析及细胞上清效价测定
取1F9和1F10细胞培养上清进行抗体亚型鉴定和效价测定,结果显示2株抗体重链和轻链均分别为鼠源单抗中最常见的IgG1和κ亚型,而细胞上清效价均大于1∶1600(表1)。
2.5 抗体可变区基因序列分析
培养1F9、1F10细胞株至增殖期,克隆抗体轻、重链可变区基因分别连入pMD-18T 载体进行测序,测序结果经IgBLAST 数据库比对分析,结果显示抗体轻链可变区与IGKV3-12*01 胚系基因同源性均高达98.3%,重链可变区与IGHV5-4*02 胚系基因同源性分别为98.0%和98.3%。2株抗体轻链可变区序列完全一致,而重链仅有1个氨基酸残基有差别(表2)。
2.6 抗体制备
1F9、1F10细胞腹腔注射雌性BALB/c 小鼠制备腹水,ELISA检测腹水效价均达到105。腹水离心后经Protein G 亲和层析纯化,SDS-PAGE 结果显示在相对分子质量25×103和50×103处出现特异性蛋白条带,与抗体轻、重链大小相符,Gelpro32软件分析表明蛋白纯度大于95%(图3)。
2.7 单抗特异性鉴定
GST-CGRPR 胞外区融合蛋白、GST 蛋白、GST-PD1 蛋白SDS-PAGE 电泳后转移至PVDF 膜上,分别以1F9、1F10 纯化抗体为一抗、HRP 标记的羊抗鼠IgG 为二抗进行Western 印迹,结果显示1F9、1F10 抗体只和GST-CGRPR 融合蛋白特异性结合,与GST 蛋白和GST-PD1 蛋白不结合(图4),说明1F9、1F10 抗体特异性地结合在CGRPR 胞外区,且结合表位为线性表位。

表1 抗体亚型及细胞上清效价测定
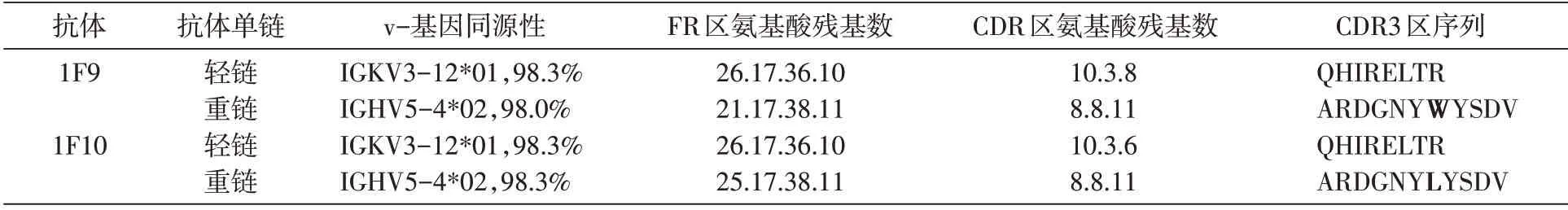
表2 抗体轻、重链可变区序列分析
2.8 抗体亲和力常数测定
通过非竞争ELISA 测定抗体1F9和1F10与抗原GST-CGRPR 胞外区融合蛋白的亲和力常数,如图5 所示,1F9、1F10 抗体的亲和力常数分别为3.95×10-8、1.49×10-8mol/L。杂交瘤筛选得到的鼠源单克隆抗体亲和力常数一般为10-6~10-9mol/L,1F9和1F10 亲和力常数测定结果表明两者均具有较高的亲和力。
3 讨论
CGRPR的膜蛋白特性使得我们很难大量获得CGRPR 全长蛋白[11],而CGRPR的N端胞外结构域可以与配体CGRP 分子特异性识别和结合,所以在本研究中,我们使用CGRPR 蛋白的N端胞外结构域代替全长蛋白作为免疫原来筛选CGRPR特异性单克隆抗体。
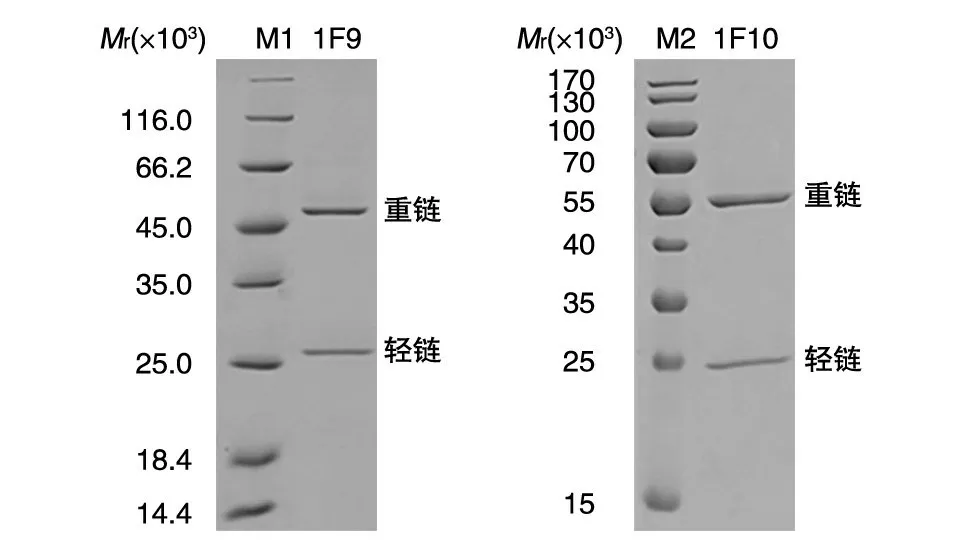
图3 纯化抗体1F9和1F10的SDS-PAGE 分析
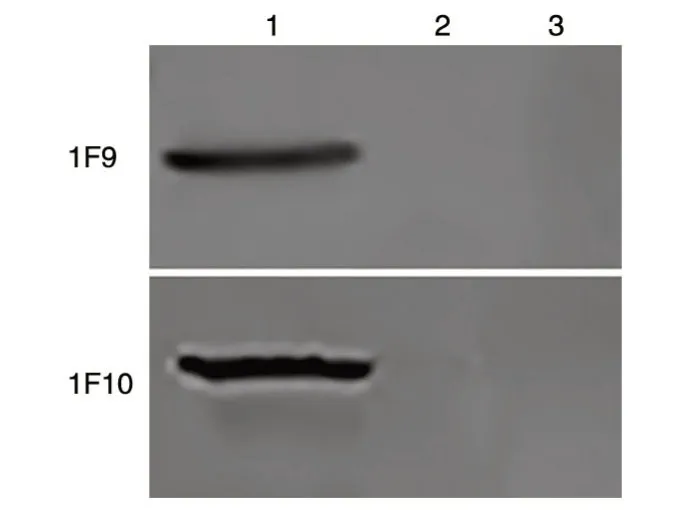
图4 1F9和1F10 抗体的Western 印迹

图5 ELISA 法测定抗体与抗原的亲和力常数
本研究采用大肠杆菌表达系统表达CGRPR蛋白N端胞外结构域,并通过包涵体复性和纯化得到纯度大于90%的重组蛋白来免疫小鼠筛选鼠源单克隆抗体。大肠杆菌表达系统的优点在于能简单、快速、大量地制备目的蛋白。本研究也尝试同时采用高等真核表达系统如毕赤酵母及哺乳动物细胞表达CGRPR 全长N端胞外结构域,但都没有成功。后续计划通过细胞和动物水平实验来评价用原核表达抗原筛选到的1F9和1F10 抗体的药效。
采用杂交瘤技术制备得到的鼠源单克隆抗体具有亲和力高、特异性强、性质均一且易于大量生产等优点,广泛应用于医学实践及生命科学研究中[12]。本研究采用GST-CGRPR 胞外区融合蛋白作为抗原,通过杂交瘤技术最终筛选得到两株高亲和力特异性单抗,药效确证后将通过鼠源抗体人源化改造,如嵌合抗体、CDR 移植或SDR移植来制备全人源抗体。
