不同方法制备的Cu/OMS-2催化剂上甲苯催化氧化性能研究
2019-02-27胡明华郭矩成王雯君
胡明华,岳 琳,郭矩成,王雯君
(江汉大学 工业烟尘污染控制湖北省重点实验室,化学与环境工程学院,湖北 武汉 430056)
工业生产和汽车尾气中排放的挥发性有机污染物(VOCs)危害着大气环境和人类健康[1-2]。现有VOCs控制手段种类繁多,常见的有吸附、吸收、热解、催化燃烧、光催化降解等[1,3-6]。其中,催化燃烧法因操作温度更低、转化效率更高而被公认为是高效节能的VOCs控制手段之一。二十一世纪以来,基于贵金属氧化物和金属氧化物的VOCs催化氧化过程得到了广泛的研究[7-8]。因贵金属氧化物催化剂在处理含杂原子的VOCs气体和极端反应温度条件下易失效,比较而言,金属氧化物具有更好的热稳定性和防中毒能力,更适于在相对较高的操作温度下使用,其中铜系和锰系氧化物在芳香族和含氯VOCs(例如Cl-VOCs[9]、甲苯[10-12]、一氧化碳[13])的去除中展现出较好的催化性能。
近年来,锰氧化物八面体分子筛(OMS-2)用作处理VOCs的催化材料被广泛关注,它是一类具有由2×2 MnO6八面体链形成的一维隧道结构的锰氧化物。Mn4+、Mn3+和Mn2+共同组成一种混合价态的锰离子框架。因其特有的多孔结构和优良的氧化还原性、疏水性和表面酸性,该类材料能在甲醛、苯、甲苯、乙醇、邻二甲苯等VOCs的氧化过程中展现出良好的催化性能[14-17]。目前,关于Cu/OMS-2材料用于甲苯催化氧化过程的研究成果较少,且从反应机理和结构解释层面来深度剖析不同制备方法对Cu/OMS-2催化性能影响的研究鲜见报道。笔者通过不同方法制备了Cu/OMS-2,并对其物相结构、理化性质、热稳定性、表面活性及氧化还原性进行了表征,以甲苯氧化过程为指针反应,考察了不同制备方法对该系列材料催化性能的影响,旨在探索Cu取代OMS-2结构上不同位置的Mn对制得材料的氧化还原性及催化性能的影响。
1 实验材料与方法
1.1 催化剂的制备
采用文献[18]中的回流法制备OMS-2。在典型的合成方法中,将MnSO4·H2O(4.4 g,26.0 mmol)和浓HNO3(1.5 mL)溶解在去离子水(15.0 mL)中,配成溶液A。另将38 mmol KMnO4溶解在去离子水(100 mL)中,配成溶液B。随后,将溶液B加入溶液A并充分搅拌,得到的黑棕色混合物在100℃条件下回流24 h。去离子水抽滤洗涤后的回流产物110℃干燥过夜,得到OMS-2催化剂前驱体。
用30 mL Cu(NO3)2溶液(0.2 mol/L)与1 g OMS-2进行离子交换,每4 h用新鲜的Cu(NO3)2溶液(0.35 mol/L)替换原有溶液,整个离子交换过程持续24 h。随后,将得到的产物进行过滤洗涤,80℃条件下干燥24 h,得到CuW催化剂前驱体。在OMS-2合成过程的回流反应前,将10 mL CuSO4溶液(0.5 mol/L)加入OMS-2合成混合液中,经回流及抽滤洗涤后110℃干燥过夜,得到CuP催化剂前驱体。所有前驱体在500℃煅烧4 h,最终得到的催化剂命名为CuW、CuP和OMS(OMS-2)。
1.2 催化剂的材料表征
催化剂样品的物相结构通过X射线衍射仪(XRD)来测定,衍射仪型号为荷兰帕纳科X’Pert PRO,采用Cu靶作为X射线源,光源波长λ=0.154 18 nm,在5~80°范围内进行扫描,扫描速度为3°/min。
催化剂样品的元素组成通过X射线荧光光谱仪(XRF)测定,仪器型号为日本理学ZSX-Primus II,采用Rh靶为X射线源。
催化剂样品的比表面积(SBET)和孔体积(Dv)通过比表面积分析仪来测定,仪器型号为美国麦克ASAP 2020M。测定前将样品在350℃下真空处理4 h,使系统真空度为0.8 Pa左右,然后以容积法获得N2的低温(77 K)吸附等温线,样品的比表面积根据BET(Brunauer-Emmett-Teller)方法计算得到(计算时取点的相对压力(P/P0)范围0.05~0.3)。
催化剂样品的酸性可用NH3程序升温脱附(NH3-TPD)性能进行评价,该测试在Finetec Finesorb-3010仪上完成。首先,将约0.09 g催化剂样品置于He气流(15 mL/min)中升温至300℃并保持1 h,之后在He吹扫下冷却至室温,对催化剂进行NH3(0.5 vol%NH3/He)吸附直至饱和,室温下He(30 mL/min)吹扫1 h,在流速为(30 mL/min)He气流下,以10℃/min的速率升温至800℃。使吸附的NH3从催化剂表面脱附。除了吸附气体采用高纯CO2以外,CO2程序升温过程(CO2-TPD)与NH3-TPD过程采用了同样的仪器和操作程序。脱附量采用热导检测器(TCD)进行检测,计算机在线记录TPD图谱。
催化剂样品的程序升温还原(H2-TPR)也在Finetec Finesorb-3010仪上测定,将样品(约20 mg)装入U型石英反应管,先在He气流(15 mL/min)中升温至300℃并保持1 h,之后在He吹扫下冷却至室温,切换至10%H2/He混合气(15 mL/min),升温至500℃,流出气体采用热导检测器(TCD)进行检测,计算机在线记录TPR图谱。
催化剂样品的热重分析(TGA)采用美国珀金埃尔默TGA 4000测定,在通入30 mL/min N2气氛中,以10℃/min的速率将初始重量为20 mg的样品从35℃升温至900℃,并在此过程中记录其重量变化情况。
1.3 催化剂的活性评价
本文以甲苯为指针污染物,在固定床反应器(内径为6 mm)内进行了催化剂的活性评价实验。每次测试称取0.3 g催化剂样品(40~60目)置于反应器内,空气载气通过VOC鼓泡反应器,带出高浓度VOCs气流,然后与另一路空气混合,进入固定床反应器。总流速控制为40 mL/min,甲苯流速为150 mL/min时反应空速均为30 000 h-1。实验前将反应器温度升至130℃,VOCs气流通入并稳定30 min后,测定甲苯的初始浓度。然后开始将反应器升温,在每个测定的温度点恒温20 min,根据VOCs浓度的变化来确定该温度点时的转化率。采用气相色谱仪(GC-7806,FID检测器)在线进行VOCs气体成分的定量分析。
2 结果和讨论
2.1 催化剂表征
2.1.1 XRD、XRF和BET结果分析 由图1的XRD衍射图可以看出,所有材料都表现出了较强的OMS-2分子筛特征衍射峰[17],这说明Cu的加入并没有给OMS-2材料原有的分子筛晶型结构带来明显变化。MnO2结构(JCPDS No.44-0141)和Mn2O3结构(JCPDS No.24-0508)出现在两种Cu/OMS-2的图谱中,且相比OMS-2对应的衍射峰更强更宽。两种Cu/OMS-2中均未发现金属铜及其氧化物的衍射峰,这说明浸渍上的金属元素已经很好地分散在OMS-2结构中了。

图1 OMS、CuW和CuP的XRD衍射图Fig.1 XRD diffractogram of catalysts of OMS,CuW and CuP
制得样品的比表面积和总孔体积数据结果见表1,样品的SBET排序如下:OMS(67.0 m2/g)>CuP(52.2 m2/g)>CuW(34.7 m2/g),CuW具有相对较高的孔体积(1.16 cm3/g),这一数值低于CuP,但高于OMS(0.82 cm3/g)。采用XRF检测技术来分析样品中Cu的含量,测得Cu在CuW和CuP的含量接近,分别为2.07 wt%和2.19 wt%。
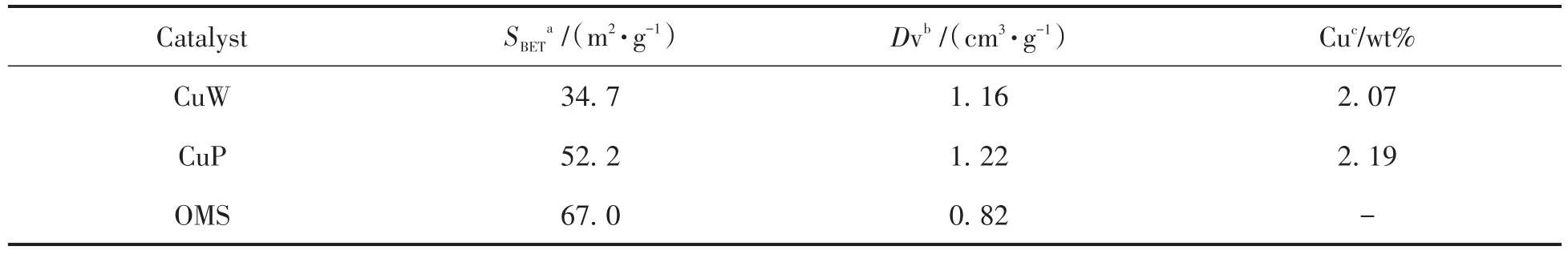
表1 所制备催化剂的理化性质Tab.1 Physicochemical properties of catalysts synthesized
2.1.2 NH3和CO2程序升温脱附结果分析 NH3程序升温脱附测试被用于评价样品的酸性,NH3-TPD图谱见图2(a)。脱附温度低于100℃的NH3脱附现象可归属于物理吸附的NH3[19]。酸性位可被粗略分为弱酸位(90~200℃)和强酸位(350~600℃),而强酸位将在催化反应中起到非常重要的作用。如图2(a)所示,两个铜负载样品的酸性位数少于催化剂。且不同制备方法制备的Cu-OMS-2样品具有的强酸位数量接近。
CO2程序升温脱附测试被用于评价样品的碱性,CuW、CuP和OMS样品的CO2-TPD谱见图2(b)。碱性位也可大致分为两个区间:弱碱位(100~200℃)和强碱位(300~500℃)。图谱中峰的强度越大则碱性位数越多,由图2(b)分析可知:两个铜负载样品的碱性位数基本一样,且明显少于OMS样品。
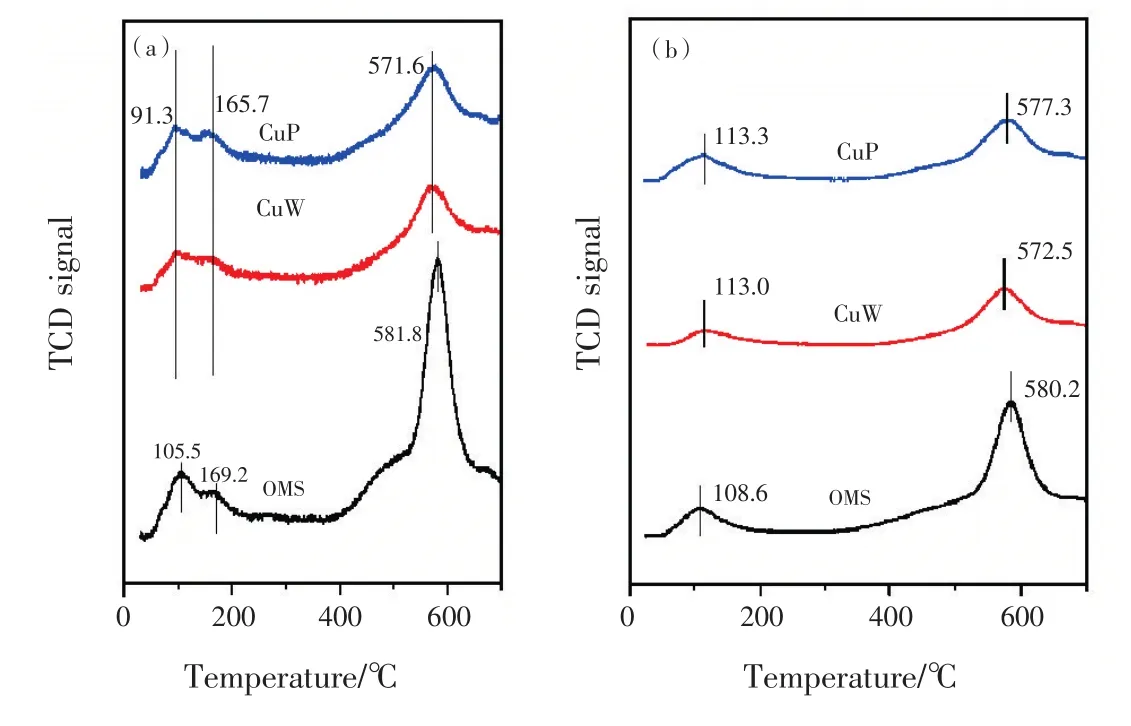
图2 (a)OMS、CuW和 CuP的NH3-TPD图;(b)OMS、CuW和 CuP的CO2-TPD图Fig.2 (a)NH3-TPD diagram of OMS,CuW and CuP;(b)CO2-TPD diagram of OMS,CuW and CuP
2.1.3 TGA结果分析 热解分析过程中,该系列样品在300℃以下损失的重量主要来自于样品中吸附的水、CO2和一些物理吸附的O2[20],在300~450℃损失的轻微重量被认为来自化学吸附氧,而在450~650℃损失的显著重量则对应结晶氧的数量[21]。这个数量可以从此温区的损失量来衡量,依次为OMS>CuW>CuP。据有关报道[20,22],650℃以上的重量损失主要是由于OMS-2分子筛结构倒塌和锰氧化物分解所导致的锰氧化态的降低和第二晶格氧的释放。
由图3中的TGA分析数据可知,3个样品具有不同的热稳定性,总重量损失分别为:5.9%(CuP)、7.1%(OMS)、7.7%(CuW),CuP样品热稳定性最好。

图3 所制备催化剂的热重分析图Fig.3 TGA of prepared catalysts
2.1.4 H2程序升温还原结果分析 图4揭示了OMS、CuW和CuP催化剂的H2-TPR表征结果,常用于评价催化剂的还原性,揭示材料的氧移动性能。催化剂还原能力越大,其氧流动性越好。200~350℃间的谱峰体现了Mn2O3的生成、Mn2O3转化为Mn3O4、Mn3O4转化为MnO过程中H2的消耗[23]。负载铜后,第一个位置的吸附峰朝着低温移动(OMS为345.6℃,CuW为275.1℃,CuP为310.1℃)。H2消耗量可根据脱附峰的积分面积来进行推断,相比铜负载样品,OMS催化剂具有最大面积的H2吸附峰,而CuW的H2吸附峰大于CuP。因此,可以确定3个样品的还原能力大小为:OMS>CuW>CuP,而催化剂的还原能力越强则预示着其表面氧流动性越好。

图4 OMS、CuW和CuP的H2-TPR图Fig.4 H2-TPR diagram of OMS,CuW and CuP
2.2 催化剂的活性评价
图5给出了OMS、CuW和CuP催化剂上甲苯催化氧化行为的图谱,分析可知OMS催化剂具备最优的甲苯催化活性,225℃时甲苯的转化率为90%。以T90%(转化率为90%时的温度)为参考,催化剂的活性顺序为:OMS>CuW>CuP。众所周知,甲苯分子直径为5.8 Å,而OMS-2的孔道尺寸为4.6 Å×4.6 Å,催化反应发生在OMS-2的材料表面,催化活性被认为来自锰钾矿结构中的Mn-O晶格,H2-TPR的结果也很好地证明了这点。VOCs在不同锰氧化物上的催化氧化过程都可以通过Mars-van Krevelen反应机理[23]来描述,总体来说分为两个步骤:1)被氧化了的催化剂表面被VOCs还原;2)催化剂又被气态中的氧气氧化。其中氧的主要来源是化学吸附氧或晶格氧。因此,OMS-2类催化剂外表面上氧的高流动性预示着它具备更好的催化性能。已有研究[17,22,24]发现,Mn3+/Mn4+电子对在催化过程中发挥着重要的作用。从XRD检测结果分析可知,Cu的加入导致了OMS-2纳米颗粒的团聚,可能减少了OMS-2催化剂表面的Mn3+/Mn4+电子对的数量,而两种Cu/OMS-2中均检测到了Mn2O3的存在(OMS-2中并未发现),这证实了Mn3+/Mn4+电子对的减少。因此,OMS-2催化剂表现出比Cu/OMS-2更优的催化活性。

图5 OMS、CuW和CuP催化剂上甲苯氧化Fig.5 Toluene oxidation with OMS,CuW and CuP
3 结论
综上所述,采用离子交换法和前处理法分别制备了铜负载OMS-2催化剂材料。分别用OMS-2、CuW和CuP催化氧化甲苯,采用气相色谱仪检测其催化过程,发现OMS-2具有最强的活性。两种改性方法均没有提高材料的催化性能,原因可能是Cu的加入减少了OMS-2催化剂表面Mn3+/Mn4+电子对的数量,降低了催化剂的还原性和表面氧移动性,导致两种方法制备的Cu/OMS-2催化性能相比OMS-2均有所降低。
