口腔鳞状细胞癌组织PRSS8基因启动子甲基化状态及其临床意义
2019-02-27张素欣李天客常晴晴
张素欣 李天客 郭 杰 包 阳 宋 艳 常晴晴 陈 中
OSCC的治疗手段目前仍是以手术治疗为主,化、放疗、生物治疗相结合的综合治疗,虽然近些年来治疗手段越来越丰富,设备也越来越先进,国际上光动刀疗法及靶向治疗有了长足的进步,但是由于OSCC浸润性强、颈部淋巴结转移早、复发率高,因此患者术后生存质量较差、预后不理想。所以提前发现病灶,并把癌变过程控制在早期阶段显得尤为重要。
人类的前列腺蛋白(Prostasin)基因又被简称为PRSS8或CAP-1,是一种于1994年首次在人体精液中发现的丝氨酸蛋白酶(40KDa)。PRSS8在上皮屏障功能上显示了其重要性,而且参与多种炎症、表皮生长、肿瘤的发生发展过程[1]。研究表明PRSS8在胃癌[2],乳腺癌[3],食管癌[4],膀胱癌[5],前列腺癌[6,7]组织细胞中起到抑癌基因的作用,并且在上述癌症中均因高度甲基化导致了PRSS8表达的减少。PRSS8可以通过调节多种通路抑制多种肿瘤的发生,参与肿瘤的发生与发展。但目前尚未发现PRSS8在OSCC中的相关报道。本实验拟通过利用甲基化特异性聚合酶链反应(methylation specific PCR,MSP)及逆转录-聚合酶链反应(reverse transcriptase-PCR,RT-PCR)法分析52例OSCC组织及相应癌旁2cm处的正常口腔黏膜组织中PRSS8基因的表达情况及甲基化状态,并结合临床数据进行相关分析,进一步揭示OSCC的发病机制,为OSCC的早期发现、预后的判断提供理论依据。
资料和方法
1.实验研究对象:本实验研究所采用标本均来自于2014年8月至2016年8月在河北医科大学第四医院口腔科住院并行手术治疗的OSCC患者。所取标本包括每例患者的OSCC原发灶组织和在距离原发灶2cm处切取的正常口腔黏膜组织,52例OSCC中男性患者30例,女性患者22例,男女比例为1.36:1。年龄最大者79岁,年龄最小者25岁,平均年龄58.3岁,吸烟史(≥3支/天,时间≥1年),吸烟29例,不吸烟23例。饮酒史(≥50ml/天,时间≥1年),饮酒27例,不饮酒25例。按照2010年AJCC对唇和口腔鳞癌TNM分期标准,对术后病人进行TNM分期,其中Ⅰ+Ⅱ期21例,Ⅲ+Ⅳ期31例。依据有无淋巴结转移分组,有淋巴结转移者23例,无淋巴结转移者29例。按照1997年WHO推荐将FuhrmanⅠ、Ⅱ级合并为高分化,FuhrmanⅢ级为中分化,FuhrmanⅣ级为低分化,高中分化组为34例,低分化组18例。所有标本均经术后病理证实,标本离体后均迅速保存于液氮中,之后转移至生物标本库-80℃冰箱统一保存管理。本研究已通过河北医科大学第四医院伦理委员会批准。
2.主要试剂和仪器(表1)。
PRSS8基因RT-PCR引物序列:上游:5'-ACTGCTCGCTTCGGATACTC-3';下游:5'-CAGGCACGCAAGGTAGGAA-3';扩增产物长度为174bp,退火温度56℃。
PRSS8基因甲基化引物序列:上游:5'-TTATAGGTATTCGTTATTACGTTCG-3';下游:5'-ACACTTTAAAAAACCGAAACCGACG-3';扩增产物长度为126bp,退火温度55℃。

表1 主要试剂和仪器
3.MSP检测OSCC组织和癌旁组织中PRSS8甲基化状态:应用DNA提取试剂盒提取OSCC组织中的DNA并进行纯化。设计相应的MSP引物及非甲基化特异性引物。扩增条件∶95℃,预变性10分钟,一个循环;94℃,变性,45秒,退火温度按上述温度,45秒,72℃,延伸45秒,共35个循环;72℃再延伸10分钟。采用Gel Doc XR图像分析系统进行分析。甲基化发生率的统计分析∶甲基化率(%)=(完全甲基化标本数+不完全甲基化标本数)/总标本数×100%。MSP阳性对照采用经甲基化酶SssⅠ处理以后的基因组DNA进行PCR,阴性对照采用灭菌双蒸水代替DNA模板进行PCR扩增。为对MSP检测的进行质量控制,随机选取10%的标本进行重复实验,重复性达到95%以上。
4.RT-PCR法检测OSCC组织中PRSS8基因mRNA表达水平:首先按TRIzol试剂说明书提供的操作步骤提取OSCC和癌旁组织中的总RNA,采用紫外分光光度计测量其含量及纯度,并参照反转录试剂盒说明书步骤,将RNA反转录为cDNA,之后以该cDNA为模板,加入反应体系进行PCR扩增,以GADPH作为内参照。扩增条件:95℃,预变性10分钟,一个循环;94℃,变性,45秒;退火温度按上述温度,45秒;72℃,延伸45秒,共35个循环;72℃再延伸7min。
5.统计学处理:采用SPSS statistics 21.0统计软件进行数据分析,计数资料采用χ2检验统计方法,计量资料两样本间均数比较采用t检验或t'检验,多样本间均数比较采用单因素方差分析统计方法。以P<0.05为差异有统计学意义。
结 果
1.OSCC和癌旁组织中PRSS8基因的甲基化状态:MSP检测结果OSCC组织PRSS8及PTPN22基因启动子甲基化率均明显高于相应正常组织(57.7%vs34.6%χ2=5.571,P=0.018)
2.OSCC和癌旁组织中PRSS8基因mRNA的表达情况:PRSS8基因mRNA的相对表达量在OSCC组织中明显低于相应癌旁组织(0.44±0.12vs0.71±0.13 t=-10.620,P=0.000)
3.PRSS8基因启动子甲基化与患者临床参数之间的关系:PRSS8基因甲基化状态与分化程度、淋巴结转移、病理分级相关(均P<0.05)。
4.OSCC中PRSS8基因mRNA相对表达水平及与临床参数之间的关系:OSCC组织中PRSS8基因mRNA的表达与分化程度、淋巴结转移、病理分级相关(均P<0.05)。
图1 PRSS8基因在口腔鳞癌及正常组织中的甲基化状态
图2 PRSS8基因和内参mRNA在口腔鳞癌及正常组织中的表达
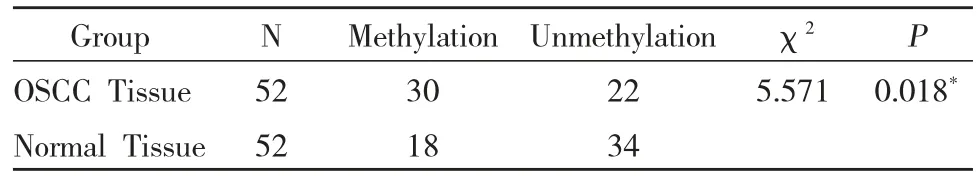
表2 口腔鳞癌组织和正常组织中PRSS8基因甲基化情况

表3 口腔鳞癌组织和正常组织中PRSS8 mRNA相对表达量

表4 口腔鳞癌组织中甲基化组和非甲基化组PRSS8mRNA相对表达量的比较

表5 PRSS8基因甲基化状态与临床病理特征的关系

表6 PRSS8mRNA相对表达量与临床病理特征的关系
讨 论
PRSS8基因位于染色体16p11.2[2],其编码的蛋白又称为人类的前列腺蛋白(Prostasin)或CAP-1,自1994年首次在人体精液中发现以来,关于PRSS8的研究日益受到重视。它是一种丝氨酸蛋白酶,长度约40KDa,其编码的蛋白广泛分布于人类各正常组织中,尤其是上皮组织,能够参与生长因子的调节、细胞的迁移等生理及病理过程[1,2]。近些年来研究表明,PRSS8基因在胃癌[3],乳腺癌[4],食管癌[5],膀胱癌[6],前列腺癌[7,8]等诸多癌症中表达下调,在上述癌组织等中均可以观察到PRSS8的甲基化状态。BAO[5]等人利用转染技术确定PRSS8启动子的区中的CPG岛具有生物学功能,并且这个区域的甲基化可能导致PRSS8表达的抑制,所以推断食管癌癌组织中PRSS8的减少可能与PRSS8的启动子甲基化有关,通过对食管癌细胞使用5-氮杂胞苷(地西他滨,DAC)进行干预,结果显示抑制了食管癌细胞的增殖和迁移,修复后的细胞周期停滞在G1期。由此推断PRSS8可以作为一个抑癌基因在人体内发挥作用的。
本研究的实验结果表明,在52例OSCC组织及相应正常黏膜组织中,OSCC组织中的PRSS8基因启动子区甲基化的发生率显著高于相应正常组织甲基化发生率,提示PRSS8基因通过启动子区甲基化可能是OSCC的发生机制之一。本研究的这一结果与PRSS8基因在食管鳞癌[3]等多种癌症中的研究基本一致。此外,本此研究还检测了52例OSCC患者中癌组织及正常组织中PRSS基因mRNA的相对表达量,结果表明,OSCC组织中PRSS8基因的相对表达量明显低于相应正常组织。这一结果提示,PRSS8基因在OSCC中可能主要起抑癌基因的作用,与PRSS8在其他癌症的研究一致。为探讨OCSS中PRSS8基因表达下降是否与其启动子区发生甲基化密切相关,进一步比较了发生甲基化的OSCC组织与未发生甲基化的OSCC组织中PRSS8基因mRNA的相对表达量,结果表明,甲基化组PRSS8基因mRNA相对表达量低于非甲基化组,初步证实了在OSCC中,PRSS8基因启动子区发生甲基化可能是引起其mRNA相对表达降低的原因之一。本实验同时研究了PRSS8基因甲基化率与OSCC患者临床资料间的关系,发现52例OSCC标本中PRSS8基因甲基化率与患者的性别、年龄、饮酒、吸烟等之间均未见明显统计学差异,这与以往的研究结果有差别,以往的流行病学研究显示,烟草、乙醇和槟榔等是口腔癌发病的化学因素,而此次的研究无统计学意义,分析原因,可能是因为样本量较少,数据进行统计学分析时校验效能下降。也正因如此,本实验中PRSS8mRNA相对表达量与临床资料进行统计学分析也未见明显统计学差异,有待于日后扩大样本量进一步明确PRSS8基因甲基化及其mRNA相对表达量降低与OSCC患者饮酒、吸烟等临床资料的关系。本研究发现PRSS8基因甲基化及其mRNA相对表达量降低与临床分期,淋巴结转移,病理分期等临床资料呈正相关,有统计学意义,说明PRSS8基因启动子区甲基化可能与OSCC的预后有关。
因PRSS8参与了上皮组织的形成与粘附过程,细胞粘附分子(E-cadherin)是一种跨膜糖蛋白,分子量为124KD,主要分布于非神经上皮组织,在维护上皮细胞形态、结构完整性和极性中起到重要作用。
Diniz-Freitas M[9]等发现通过转染E-cadherin蛋白能够抑制肿瘤细胞的侵袭,推测E-cadherin表达的减少是可以作为一种恶性标志。在分子水平,表皮生长因子受体(EGFR),E-cadherin和E-cadherin的转录抑制物(如SNAIL和SLUG)已被证明在恶性膀胱癌的进展过程中扮演了重要的作用[10]。而在慢性结肠炎相关结直肠癌的相关研究中发现PRSS8通过激活Sphk1/S1p/Stat3信号传导信号传导途径对Stat3的持续激活更加促进β-catenin的细胞核内转移和聚集,E-cadherin的表达下降,影响细胞的紧密连接[11]。越来越多的证据表明E-cadherin通过调控GSK3β,Snail/Slug和Akt/PKB[12~14]等信号通路的表达在肿瘤的发生发展中起着重要的作用。E-cadherin的正常表达可以使可以阻止肿瘤的浸润和转移[15]。
E-cadherin的表达下调与OSCC的组织分化、侵袭和转移能力、预后密切相关[16~18]。在今后的研究中,可应用western-blot、基因敲除等技术进一步验证此基因与E-cadherin与OSCC的关系。总之,本研究提示PRSS8启动子区CpG岛的异常高甲基化可能是导致OSCC中相应基因表达降低的重要机制之一,PRSS8有可能是OSCC早期诊断的生物标记物。
