纳米级碳酸钙煅烧分解特性研究
2019-02-27辛善志
夏 伟,黄 芳*,王 梅,辛善志,米 铁
(1.江汉大学 工业烟尘污染控制湖北省重点实验室,化学与环境工程学院,湖北 武汉 430056;2.武汉轻工大学 化学与环境工程学院,湖北 武汉 430023)
石灰石(碳酸钙)用途极为广泛,在水泥工业、脱硫技术以及高温脱碳技术中有着重要的应用,因此探究碳酸钙煅烧特性有重要意义。由于碳酸钙可以从大量不同的原料获取,以致碳酸钙的化学成分及物理结构有相当大的差异。碳酸钙的组成、颗粒尺寸等的变化将会影响碳酸钙的分解[1-4],晶体结构的不同也会导致碳酸钙煅烧分解动力学参数的差异[5]。对于纳米级碳酸钙来说,由于其颗粒粒径小、比表面积大、表面活性高,从而受到愈来愈多的关注。纳米级碳酸钙作为水泥填料的填充量具有一定的补强作用;同时在脱硫或者脱碳技术中,石灰石粉末在高温环境中受热分解将产生多孔氧化钙,而新产生的多孔氧化钙具有较大的初始比表面积,可以提高脱硫率或脱碳率[6-8]。碳酸钙的煅烧分解动力学自1931年便有学者进行研究[9-10],至今较为普遍的观点认为碳酸钙的化学分解反应是煅烧分解速率受控的最主要因素[1,3-4,10-15],即化学反应在碳酸钙的分解过程中占主导地位。然而,在碳酸钙煅烧分解研究中,何种化学机制控制分解反应,目前结论尚不一致。对于纳米级碳酸钙而言,由于粒度对碳酸钙的煅烧分解动力学过程有着重要的影响[3,5],因而研究其煅烧分解特性及相关动力学参数很有意义。
本文主要利用热分析仪器,对纳米级碳酸钙在不同升温速率、不同反应气氛中的煅烧特性进行研究,同时与常规碳酸钙进行比较,最后对其分解动力学机理的相关参数进行了分析。
1 实验
1.1 样品
选取商业购买的纳米级碳酸钙(NO-CaCO3,萨默斯生物科技有限公司),以及两种常规碳酸钙:天然石灰石(NA-CaCO3,粒径45~75 μm)和分析纯碳酸钙(AR-CaCO3,国药集团化学试剂有限公司)作为对照进行研究。3种样品的X射线衍射图(XRD)如图1所示,NO-CaCO3的衍射特征峰都是碳酸钙晶相,但峰强较低,即碳酸钙纯度较高而结晶度较低;NA-CaCO3不仅含有碳酸钙结晶相,还有极少量杂质;AR-CaCO3的衍射峰峰型尖锐,其结晶度最好且纯度也最高。由此可发现,NO-CaCO3峰型及结晶度都不如其他两种碳酸钙。
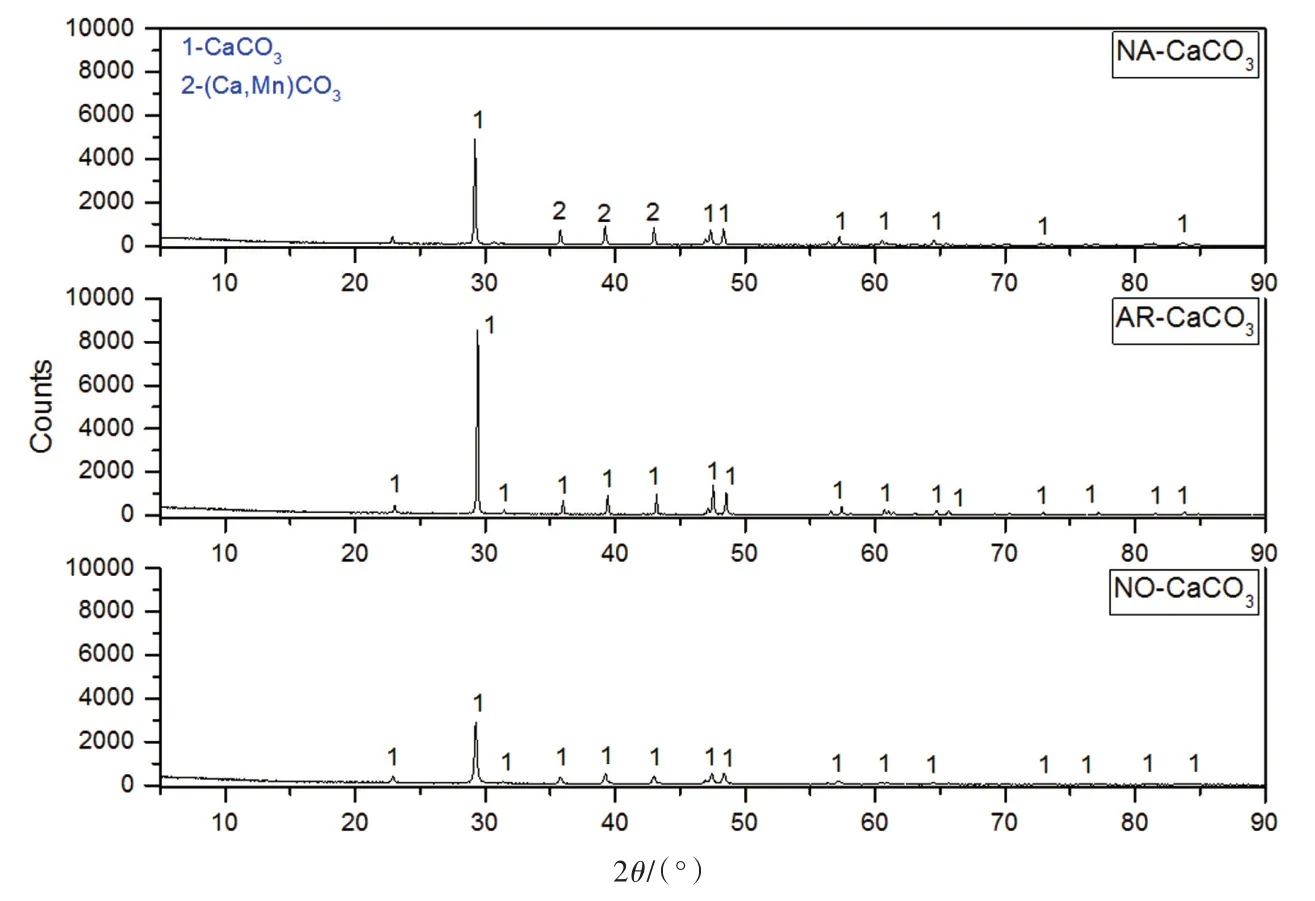
图1 样品XRD衍射图谱Fig.1 XRD diffractogram of samples
1.2 实验装置及方法
实验装置采用美国珀金埃尔默TGA4000热重分析仪,顶部装样设计,最大的样品质量可达1 500 mg,测试温度范围由室温至1 000℃,升温速率0~200℃/min,天平分辨率0.2 μg,天平精度可达0.01%,天平准确度达到0.02%,1 000℃冷却至30℃时间小于15 min,气体流量最高为100 mL/min。
采用氧化铝坩埚,样品量9.7~10.3 mg,气氛分别为N2气氛和CO2气氛,流量为100 mL/min,分别以10、20、30℃/min的升温速率加热样品至1 000℃,随温度、时间等的变化曲线采集样品质量。
2 碳酸钙煅烧动力学分析方法
由反应动力学相关原理,碳酸钙煅烧分解速率可表示为

其中α为转化率;T为温度,K;f(α)为微分形式反应机理函数;β为升温速率,oC/min;E为活化能,KJ/mol;A为指前因子,min-1;R为通用气体常数,J/(mol·K)。根据文献[1,3,11]对方程(1)积分并整理后得

对于碳酸钙的煅烧分解主要有如下化学反应控制机理,各机理对应的F(α)表达式如表1所示。

表1 反应机制和机制函数积分形式Tab.1 Reaction mechanism and integral form of mechanism function
3 结果与讨论
3.1 升温速率对NO-CaCO3煅烧分解的影响
图2显示了本文研究的NO-CaCO3和两种常规碳酸钙在不同升温速率下煅烧分解的热失重(TG)及失重微分(DTG)曲线。对于NO-CaCO3样品,纯N2气氛中升温速率10℃/min时,NO-CaCO3在整个升温加热区间有3个失重段。200~300℃之间微弱的失重峰是颗粒表面少量吸附水蒸发所致;接着300~550℃是颗粒表面吸附水大量蒸发所致;最后一段是NO-CaCO3的碳酸钙分解段,在620℃左右开始分解。由于升温速率的不同,分解基本终止的温度也有所差异,大约在820℃(10℃/min)、880℃(20℃/min)和920℃(30℃/min),随着升温速率的增加,曲线向高温区移动,且煅烧分解结束温度升高,这也进一步说明NO-CaCO3的煅烧分解受动力学控制。NA-CaCO3在纯N2气氛中升温速率10℃/min时,650℃左右开始分解,这与部分文献[4,15-17]的研究结果一致,升温速率增加,分解趋势类似于NO-CaCO3,曲线也向高温区移动,分解终止温度也在升高。AR-CaCO3在N2气氛中升温速率10℃/min时,在640~650℃开始分解,随着升温速率的增加,TG曲线和DTG曲线也向高温区移动。同时发现,在N2气氛下NO-CaCO3分解特性与常规的NA-CaCO3和AR-CaCO3存在较大差异,550℃之前即较低温度下存在明显失重,主要是由于纳米级颗粒极小、表面积大[8,17],其颗粒会团聚且会吸附大量的水汽分子,当颗粒温度逐渐升高,被颗粒表面吸附的水分子会慢慢蒸发出来;其次,NO-CaCO3在620℃左右开始分解,比NA-CaCO3和AR-CaCO3的分解温度降低了近30℃,可能是由于NO-CaCO3样品本身结晶度较低,结构较易破坏,导致分解在较低温度下进行,更大可能是碳酸钙分解温度跟样品颗粒的粒度相关[3],粒度越小分解温度相应降低。
3.2 CO2气氛对NO-CaCO3煅烧分解的影响
由图2发现,NO-CaCO3在高浓度CO2气氛中升温速率10℃/min时,其在550℃以前有一段缓慢的吸附水蒸发阶段,随后的煅烧分解温度较高约为890℃,直至实验结束温度时分解仍未完成,同时随着升温速率的增加,在实验的3个升温速率下其转化率较为接近,说明本实验中几个升温速率对NO-Ca⁃CO3的煅烧分解转化率影响比较小。相较于N2气氛,同等升温速率情况下,NO-CaCO3在高浓度CO2气氛中的分解温度高了近270℃,这是由于碳酸钙的分解过程受气相CO2的分压和平衡压力的影响极大,当气相中CO2浓度较高时,CO2分压较大,平衡压力与分压之间的差值极小,在同等升温速率的情况下,碳酸钙开始煅烧分解的温度推迟[16,18-19]。NA-CaCO3在高浓度CO2气氛中升温速率10℃/min时,其基本也在890℃左右开始煅烧分解,直至实验结束温度时分解仍未完成。然而,升温速率不同起始分解温度有所差异,且随着升温速率的增加,分解曲线向高温区移动,在本实验结束温度时其分解转化率随之减小。AR-CaCO3在高浓度CO2气氛中,升温速率10℃/min时的起始分解温度大约在915℃,且随着升温速率的增加,煅烧分解曲线变化趋势与NA-CaCO3类似。这里,NO-CaCO3、NA-CaCO3的煅烧分解温度比AR-CaCO3稍低,推测原因主要是由于NO-CaCO3本身晶体结晶度稍差,同时粒径极小,而NA-CaCO3含有一定量的杂质,在高浓度CO2气氛中的高温下可能杂质自身分解或者与碳酸钙之间有一定的相互作用[16,20],从而导致NO-CaCO3、NA-CaCO3在高浓度 CO2中的分解温度比纯度极高的AR-CaCO3稍低。

图2 NO-CaCO3、NA-CaCO3与AR-CaCO3样品的TG及DTG曲线Fig.2 TG and DTG curves of NO-CaCO3,NA-CaCO3and AR-CaCO3
综上,NO-CaCO3的分解由于其颗粒粒径极小,具有较大的比表面积,孔隙较为丰富[6-8],颗粒表面易吸附水蒸气分子,升温加热过程中,吸附水会蒸发,且煅烧分解较其他两种碳酸钙更加活跃,煅烧分解温度更低,在高浓度CO2气氛中,1 000℃的终温条件下分解更为彻底。
3.3 动力学参数分析
本文重点以NA-CaCO3在N2气氛下升温速率为10℃/min的热重实验说明动力学分析过程,表2列出了常用8个机制函数相应的截距和斜率计算结果。由表2所列结果可见,这几种机制函数得到的相关性都比较接近,其中n=1的随机成核与生长模型相关系数最接近1(R2=0.993 62),是NA-CaCO3煅烧分解的最适宜机制。同时,在N2气氛中,本文同样计算了其他两种碳酸钙及升温速率相关数据,得到同样的结果,根据公式(2)进一步计算得到相应的动力学参数,活化能E及指前因子A,活化能及LnA与升温速率之间的关系如图3所示,3种碳酸钙在不同升温速率条件下的活化能E基本在190.76~254.82 kJ/mol之间,3种碳酸钙的E和LnA随升温速率增加的变化趋势类似,均随着升温速率的增加而减小。同时可以发现,NO-CaCO3的活化能总体比其他两种常规碳酸钙小,尤其是在升温速率较大的情况下更明显(β=30℃/min)。
本文与大多数文献[1,3-4,10-12]所得的结论类似,但与文献[13-15]认为的相界面反应机制不同。随机成核和随后生长模型所代表的物理意义为:对本文研究的几种碳酸钙的煅烧分解,反应最初发生在某些局域的点上(晶格缺陷所在处),随后这些相邻近的分解产物聚集成一个新物相的核,然后核周围的分子继续在核上发生界面反应。旧物相不断消失,新物相不断生长和扩展,直至整个固相分解完毕。由于核的形成活化能大于其生长活化能,因此当核一旦形成,便能迅速生长和扩展[21]。粒度大大减小,比表面积增大,反应速度变快,活化能减小,因此这可以解释NO-CaCO3煅烧分解活化能总体比其他两种碳酸钙小的现象。

表2 机制函数计算结果Tab.2 Calculation results of mechanism function

图3 碳酸钙在不同升温速率下的动力学参数Fig.3 Kinetic parameters of calcium carbonate at different heating rates
4 结论
通过本文研究,对于NO-CaCO3的分解特性,有如下结论:
1)在N2气氛下,NO-CaCO3由于表面吸附水分子,550℃以前脱除表面吸附水,而其分解温度比常规的碳酸钙低了近30℃,且分解温度随着升温速率的增加而升高。
2)CO2气氛对NO-CaCO3分解有着重要影响,由于碳酸钙分解受气氛中CO2分压的影响极大,NOCaCO3的分解温度比其在N2气氛下推迟了近270℃。
3)NO-CaCO3的分解由于其颗粒粒径极小,具有较大的比表面积,孔隙较为丰富,煅烧分解较其他两种常规碳酸钙更加活跃,煅烧分解温度更低,其煅烧分解动力学受成核与生长机制控制,10℃/min升温条件下的活化能低至199.76 kJ/mol。
